名校
解题方法
1 . 已知:pKa=-lgKa,25℃时,H2XO3的pKa1=10-1.85,pKa2=10-7.19,常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2XO3溶液的滴定曲线如图所示下列说法不正确的是
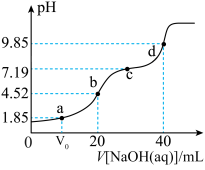

A.a点溶液中:c(H2XO3)=c(HXO ) ) |
B.b点溶液中:c(H2XO3)+c(H+)=c(XO )+c(OH-) )+c(OH-) |
C.c点溶液中:c(Na+)=3c(HXO ) ) |
D.d点溶液中:c(Na+)>c(XO )>c(OH-)>c(HXO )>c(OH-)>c(HXO )>c(H+) )>c(H+) |
您最近一年使用:0次
2023-11-17更新
|
164次组卷
|
2卷引用:新疆奎屯市第一高级中学2023-2024学年高二上学期期中考试化学试题
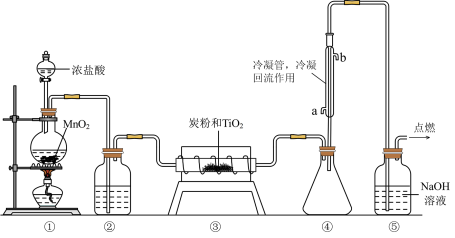
2 . 四氯化钛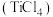 极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用
极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用 与炭粉、
与炭粉、 制备
制备 。下列说法正确的是
。下列说法正确的是
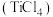 极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用
极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用 与炭粉、
与炭粉、 制备
制备 。下列说法正确的是
。下列说法正确的是
A. 产品最后在装置④中收集 产品最后在装置④中收集 |
| B.②中应盛装饱和氯化钠溶液 |
| C.反应时应先在③处加热,再开始①处的加热 |
| D.该实验设计存在不足,应在⑤后连接装有碱石灰的干燥管,防止空气中的水蒸气进入反应装置 |
您最近一年使用:0次
2023-11-15更新
|
636次组卷
|
4卷引用:新疆伊犁州霍城县江苏中学2023-2024学年高一上学期12月 化学试题
3 . 以某工业废锰渣(含MnO2及少量KOH、MgO、Fe2O3)为原料制备MnSO4晶体,其工艺流程如下:

该工艺条件下金属离子开始沉淀和完全沉淀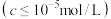 的pH如表所示:
的pH如表所示:
(1)“反应Ⅰ”中加入硫铁矿(主要成分FeS2)将MnO2还原为 。滤渣1的主要成分除FeS2外,还有一种相对分子质量为256的单质,其化学式为
。滤渣1的主要成分除FeS2外,还有一种相对分子质量为256的单质,其化学式为___________ 。
(2)“反应Ⅱ”中主要反应的离子方程式为___________ 。
(3)“反应Ⅲ”中,“某碳酸盐”的化学式为___________ ,加热的目的是___________ 应调节溶液pH的范围是___________ 。
(4)测定产品纯度。取制得的MnSO4晶体0.3020g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将 完全氧化为
完全氧化为 ,过滤、洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体1.072g;充分反应后,用
,过滤、洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体1.072g;充分反应后,用 溶液滴定,用去40.00mL。
溶液滴定,用去40.00mL。
已知: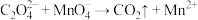 (未配平)。
(未配平)。
①用KMnO4溶液滴定时,滴定终点的现象为___________ 。
②计算产品中MnSO4的质量分数___________ (写出计算过程)。

该工艺条件下金属离子开始沉淀和完全沉淀
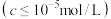 的pH如表所示:
的pH如表所示:| 金属离子 |  |  |  |  |
| 开始沉淀pH | 2.10 | 7.45 | 9.27 | 9.60 |
| 完全沉淀pH | 3.20 | 8.95 | 10.87 | 11.13 |
(1)“反应Ⅰ”中加入硫铁矿(主要成分FeS2)将MnO2还原为
 。滤渣1的主要成分除FeS2外,还有一种相对分子质量为256的单质,其化学式为
。滤渣1的主要成分除FeS2外,还有一种相对分子质量为256的单质,其化学式为(2)“反应Ⅱ”中主要反应的离子方程式为
(3)“反应Ⅲ”中,“某碳酸盐”的化学式为
(4)测定产品纯度。取制得的MnSO4晶体0.3020g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将
 完全氧化为
完全氧化为 ,过滤、洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体1.072g;充分反应后,用
,过滤、洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体1.072g;充分反应后,用 溶液滴定,用去40.00mL。
溶液滴定,用去40.00mL。已知:
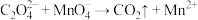 (未配平)。
(未配平)。①用KMnO4溶液滴定时,滴定终点的现象为
②计算产品中MnSO4的质量分数
您最近一年使用:0次
2023-05-16更新
|
317次组卷
|
2卷引用:新疆奎屯市第一高级中学2023-2024学年高二上学期期中考试化学试题
4 . 环烷酸金属(Cu、Ni、Co、Sn、Zn)盐常作为合成聚氨酯过程中有效催化剂,回答下列问题:
(1)基态Cu原子的价电子排布____ ,金属Cu晶体采取的是____ 堆积方式。如图a所示,(●代表Cu原子,○代表O原子),一个Cu2O晶胞中Cu原子的数目为___ 。N和Cu形成的化合物的晶胞结构如图b所示,该化合物的相对分子质量为M,NA为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是____ g•cm-3。硒化锌晶胞结构如图c所示,其晶胞参数为apm。已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标____ 。

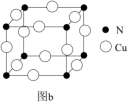
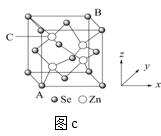
(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有____ 。
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
(3)写出Cu2+的外围电子排布式____ ;比较铁与锰的第三电离能(I3):铁____ 锰(填“>”、“=”或“<”),原因是____ 。
(1)基态Cu原子的价电子排布



(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有
A.离子键 B.共价键 C.配位键 D.氢键 E.σ键 F.π键
(3)写出Cu2+的外围电子排布式
您最近一年使用:0次
5 . 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①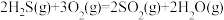
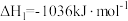
②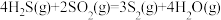
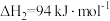
③
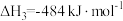
计算 热分解反应④
热分解反应④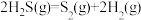 的
的
________  。
。
(2)较普遍采用的 处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解
处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的优点是
。相比克劳斯工艺,高温热分解方法的优点是________ ,缺点是________ 。
(3)在 、
、 反应条件下,将
反应条件下,将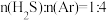 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为________ ,平衡常数
________  。
。
(4)在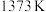 、
、 反应条件下,对于
反应条件下,对于 分别为
分别为 、
、 、
、 、
、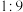 、
、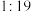 的
的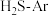 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如下图所示。
转化率随时间的变化如下图所示。 越小,
越小, 平衡转化率
平衡转化率________ ,理由是________ 。
②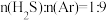 对应图中曲线
对应图中曲线________ ,计算其在 之间,
之间, 分压的平均变化率为
分压的平均变化率为________ 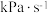 。
。
(1)已知下列反应的热化学方程式:
①
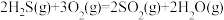
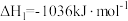
②
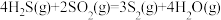
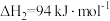
③

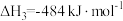
计算
 热分解反应④
热分解反应④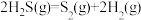 的
的
 。
。(2)较普遍采用的
 处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解
处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解 。相比克劳斯工艺,高温热分解方法的优点是
。相比克劳斯工艺,高温热分解方法的优点是(3)在
 、
、 反应条件下,将
反应条件下,将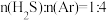 的混合气进行
的混合气进行 热分解反应。平衡时混合气中
热分解反应。平衡时混合气中 与
与 的分压相等,
的分压相等, 平衡转化率为
平衡转化率为
 。
。(4)在
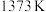 、
、 反应条件下,对于
反应条件下,对于 分别为
分别为 、
、 、
、 、
、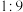 、
、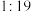 的
的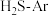 混合气,热分解反应过程中
混合气,热分解反应过程中 转化率随时间的变化如下图所示。
转化率随时间的变化如下图所示。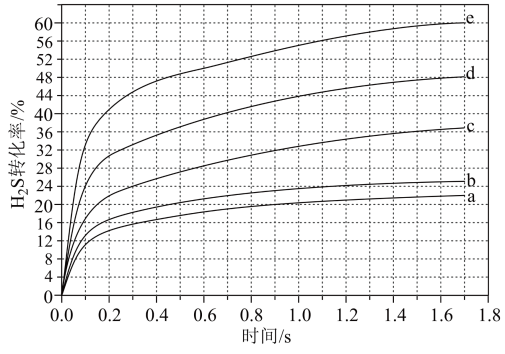
 越小,
越小, 平衡转化率
平衡转化率②
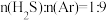 对应图中曲线
对应图中曲线 之间,
之间, 分压的平均变化率为
分压的平均变化率为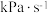 。
。
您最近一年使用:0次
2022-06-09更新
|
23257次组卷
|
24卷引用:新疆奎屯市第一高级中学2023-2024学年高二上学期9月月考化学试题
新疆奎屯市第一高级中学2023-2024学年高二上学期9月月考化学试题2022年高考全国乙卷化学真题(已下线)专题14化学反应原理综合-2022年高考真题+模拟题汇编(全国卷)(已下线)专题15化学反应原理综合-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)第12练 用“三段式”模型突破化学平衡的计算-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题16 化学反应原理综合题-备战2023年高考化学母题题源解密(全国通用)河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期9月月考化学试题湖南师大附属颐华学校2022-2023学年高二上学期入学考试化学试题福建省福州第一中学2022-2023学年高三上学期检考前适应性考试化学试题(已下线)题型26 多反应体系中的化学平衡(已下线)T28-原理综合题(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)2023年湖南卷高考真题变式题(原理综合题)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)河北省保定市唐县第一中学2022-2023学年高三上学期11月期中化学试题江西省宜春市宜丰中学2022-2023学年高二上学期11月期中(第二次月考)化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题天津市第四中学2023-2024学年高三上学期第二次月考化学试卷(已下线)大题04 化学反应原理综合题(逐空突破)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
名校
解题方法
6 . 如图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是

| A.若甲装置中b为精铜,a为镀件,则可实现a上镀铜 |
B.乙池通入CH3OH的电极反应式为CH3OH+6e-+2H2O=CO +8H+ +8H+ |
| C.丙装置可以制取KOH溶液,制得的KOH可以通过g口排出 |
| D.当d电极消耗标准状况下1.12LO2时,丙装置中阳极室溶液质量减少14.9g |
您最近一年使用:0次
2021-10-07更新
|
833次组卷
|
4卷引用:新疆伊犁州霍城县江苏中学2023-2024学年高二上学期12月月考化学试题
解题方法
7 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中___________ 区元素,其基态原子的价电子排布式为___________ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为___________ ,最高能层电子云轮廓图形状为___________ 。
(3)C、O、Cl的电负性由大到小的顺序为___________ (用元素符号表示)。
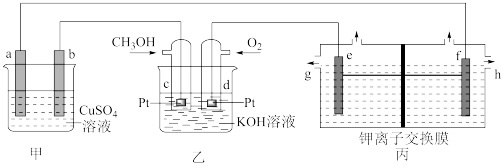
(4)CO 的几何构型为
的几何构型为___________ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为___________ ,1mol碳酸丙烯酯中σ键的数目为___________ 。
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)C、O、Cl的电负性由大到小的顺序为
(4)CO
 的几何构型为
的几何构型为
您最近一年使用:0次
解题方法
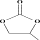
8 . (1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________ (填标号)。
A. B.
B.
C.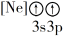 D.
D.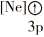
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是___________ 、___________ 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___________ ,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因___________ 。
A.
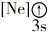 B.
B.
C.
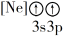 D.
D.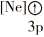
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是
(3)一些氧化物的熔点如下表所示:
| 氧化物 | Li2O | MgO | P4O6 | SO2 |
| 熔点/℃ | 1570 | 2800 | 23.8 | −75.5 |
解释表中氧化物之间熔点差异的原因
您最近一年使用:0次
解题方法
9 . CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
①根据图表数据分析T1 ℃时,该反应在0~10 min内的平均反应速率v(NO)=_____ mol·L-1·min-1;计算该反应的平衡常数K=_______ 。
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是_____ (填字母编号)。
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率_______ (填“升高”或“降低”),∆H______ 0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式_______
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______ 。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO )∶c(CO
)∶c(CO ) =
) =______ 。[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_____ 。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10 -10]。(忽略溶液体积的变化)
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)⇌N2(g)+CO2(g) ∆H,在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
| N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
②若30 min后只改变某一条件,据表中的数据判断改变的条件可能是
A.通入一定量的NO B.适当缩小容器的体积
C.加入合适的催化剂 D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1 kJ·mol-1
2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出CH3OCH3(g)和H2O(g)转化为CO2(g)和H2(g)的热化学方程式
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(HCO
 )∶c(CO
)∶c(CO ) =
) =②欲用1LNa2CO3溶液将4.66 g BaSO4(233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
您最近一年使用:0次
名校
解题方法
10 . 短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是


| A.元素非金属性强弱的顺序为W>Y>Z |
| B.Y单质的熔点低于X单质 |
| C.W的简单氢化物稳定性比Y的简单氢化物稳定性高 |
| D.化合物M中W不都满足8电子稳定结构 |
您最近一年使用:0次
2021-03-16更新
|
1527次组卷
|
6卷引用:新疆维吾尔自治区新源县第二中学2020届高三下学期第一次测试化学试题



