1 . 甘氨酸( )是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL
)是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL 甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)
甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)
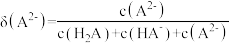
 )是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL
)是一种最简单的氨基酸。其作为内源性抗氧化剂还原型谷胱甘肽的组成氨基酸,在机体发生严重应激时常需外源补充。如图为某兴趣小组通过实验获得在25℃下10mL 甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)
甘氨酸溶液中各组分分布分数和pH的对应关系(通过HCl调节pH,溶液体积不变)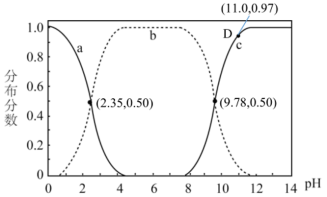
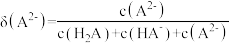
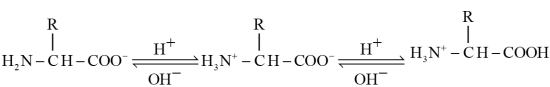
A.a为 ,b为 ,b为 ,c为 ,c为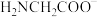 , , , , |
B. 时, 时, |
C.在D点溶液中: |
| D.该兴趣小组测得甘氨酸的pL=6.065,查表得知甘氨酸实际pL=5.97,造成误差的原因可能是因为原甘氨酸样品中有杂质,导致甘氨酸实际浓度偏低 |
您最近一年使用:0次
名校
2 . 铁合金及其化合物在工业、国防、能源等领域用途广泛。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Fe元素在元素周期表中位于第四周期_______ 族,属于_______ 区元素。 )是一种香料的中间体,请画出水杨醛的分子内氢键:
)是一种香料的中间体,请画出水杨醛的分子内氢键:_______ 。
(3)邻二氮菲(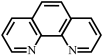 ,平面形分子,简称为phen)能与
,平面形分子,简称为phen)能与 生成稳定的橙色配合物,可测定
生成稳定的橙色配合物,可测定 的浓度,其反应原理如图所示:
的浓度,其反应原理如图所示:__________ 轨道或杂化轨道(只填一种)。
② 中
中 的配位数为
的配位数为_______ 。
③用邻二氮菲测定 的浓度时应控制pH为5~6,请解释原因:
的浓度时应控制pH为5~6,请解释原因:_______ 。
(4)研究发现,用氮化铁作催化材料,对 选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为
选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为 ,B原子的分数坐标为
,B原子的分数坐标为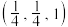 ,则C原子的分数坐标为
,则C原子的分数坐标为_______ (用含b、c的代数式表示);设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①Fe元素在元素周期表中位于第四周期
②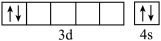 不能正确表示基态钛原子的价电子的电子排布图,因为违背了
不能正确表示基态钛原子的价电子的电子排布图,因为违背了
 )是一种香料的中间体,请画出水杨醛的分子内氢键:
)是一种香料的中间体,请画出水杨醛的分子内氢键:(3)邻二氮菲(
 ,平面形分子,简称为phen)能与
,平面形分子,简称为phen)能与 生成稳定的橙色配合物,可测定
生成稳定的橙色配合物,可测定 的浓度,其反应原理如图所示:
的浓度,其反应原理如图所示: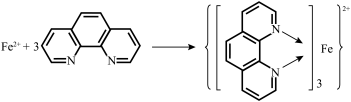
②
 中
中 的配位数为
的配位数为③用邻二氮菲测定
 的浓度时应控制pH为5~6,请解释原因:
的浓度时应控制pH为5~6,请解释原因:(4)研究发现,用氮化铁作催化材料,对
 选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为
选择性加氢制烃类具有重要意义。某氮化铁的晶胞结构如图1所示,沿z轴方向的投影如图2所示,A原子的分数坐标为 ,B原子的分数坐标为
,B原子的分数坐标为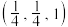 ,则C原子的分数坐标为
,则C原子的分数坐标为 ,该晶体的密度为
,该晶体的密度为 (用含a、b、
(用含a、b、 的代数式表示)。
的代数式表示)。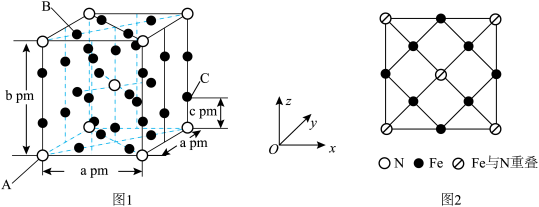
您最近一年使用:0次
名校
解题方法
3 . 铁、镍及其化合物在工业上有广泛的应用。
Ⅰ.从某矿渣[成分为 (铁酸镍)、
(铁酸镍)、 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:
(1)用95℃热水浸泡的目的是________________ ;
(2)矿渣中部分 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是________ ;
(3)向“浸取液”中加入 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为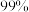 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是________  ;
;
(4)从 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是________ ,过滤,洗涤,干燥;
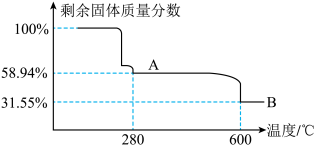
(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是________ ;
(6)基态镍离子 的核外最外层电子排布式是
的核外最外层电子排布式是________ ;
(7) 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为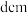 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是________  (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是________  (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
Ⅰ.从某矿渣[成分为
 (铁酸镍)、
(铁酸镍)、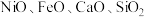 等]中回收
等]中回收 的工艺流程如下:
的工艺流程如下: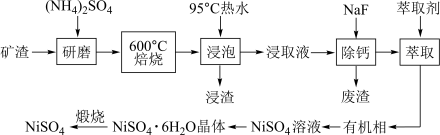
 在350℃分解生成
在350℃分解生成 和
和 。回答下列问题:
。回答下列问题:(1)用95℃热水浸泡的目的是
(2)矿渣中部分
 焙烧时与
焙烧时与 反应生成
反应生成 的化学方程式是
的化学方程式是(3)向“浸取液”中加入
 以除去溶液中
以除去溶液中 (浓度为
(浓度为 ),除钙率为
),除钙率为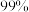 时应控制溶液中
时应控制溶液中 浓度至少是
浓度至少是 ;
;(4)从
 溶液中获得
溶液中获得 晶体的操作依次是
晶体的操作依次是(5)“煅烧”时剩余固体质量分数与温度变化曲线如右图,该曲线中B段所表示的固体物质的化学式是
(6)基态镍离子
 的核外最外层电子排布式是
的核外最外层电子排布式是(7)
 晶体结构与
晶体结构与 晶体类似,其晶胞的棱长为
晶体类似,其晶胞的棱长为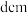 ,则该晶体中距离最近的两个阳离子核间的距离是
,则该晶体中距离最近的两个阳离子核间的距离是 (用含有
(用含有 的代数式表示)。在一定温度下,
的代数式表示)。在一定温度下, 晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是
晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,计算每平方米面积上分散的该晶体的质量是 (已知氧离子的半径为
(已知氧离子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-03-22更新
|
395次组卷
|
4卷引用:湖南省邵阳市2024届高三二模化学试题
4 . 重铬酸钠(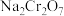 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:

已知: ,
,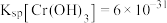
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是________ (填标号)
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式________ 。
(3)为提高铬的“浸出”率,可采取的措施为________ ;浸出液中溶质除 、
、 外,还含有
外,还含有________ (填化学式)。
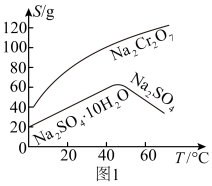
(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是 ,则“操作a”为
,则“操作a”为________ 、________ 、洗涤、干燥。
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
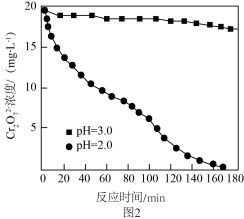
①初始pH为2.0,用铝粉还原 的离子方程式为
的离子方程式为________ 。
②初始pH为3.0,反应180min后,溶液中 浓度仍较高的可能原因是
浓度仍较高的可能原因是________ 。
③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中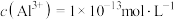 ,则残留的
,则残留的
________  。
。
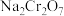 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
已知:
 ,
,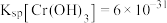
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将
 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式(3)为提高铬的“浸出”率,可采取的措施为
 、
、 外,还含有
外,还含有(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是
 ,则“操作a”为
,则“操作a”为
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有
 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
①初始pH为2.0,用铝粉还原
 的离子方程式为
的离子方程式为②初始pH为3.0,反应180min后,溶液中
 浓度仍较高的可能原因是
浓度仍较高的可能原因是③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中
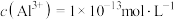 ,则残留的
,则残留的
 。
。
您最近一年使用:0次
名校
5 . 晶体世界丰富多彩、复杂多样,各类晶体具有的不同结构特点,决定着它们具有不同的性质和用途。氢化铝钠 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 下列说法错误的是
下列说法错误的是
 是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为
是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。设阿伏加德罗常数的值为 下列说法错误的是
下列说法错误的是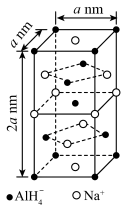
A. 中中心原子 中中心原子 的杂化方式为 的杂化方式为 杂化 杂化 |
B. 晶体中,与 晶体中,与 紧邻且等距的 紧邻且等距的 有4个 有4个 |
C. 晶体的密度为 晶体的密度为 |
D.若 晶胞上下面心处的 晶胞上下面心处的 被 被 取代,得到的晶体的化学式为 取代,得到的晶体的化学式为 |
您最近一年使用:0次
2024-05-09更新
|
247次组卷
|
2卷引用:河北省保定市九校2024届高三下学期二模化学试题
6 . 乙醛 是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
(1)已知:①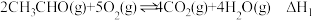
②
③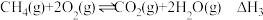
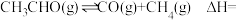
_______ 。
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量 和
和 发生反应:
发生反应: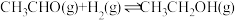 。下列叙述错误的是_______(填标号)。
。下列叙述错误的是_______(填标号)。
(3) 速率方程
速率方程 (k为速率常数,只与温度、催化剂有关;n为反应级数)。
(k为速率常数,只与温度、催化剂有关;n为反应级数)。
①阿伦尼乌斯就关于速率常数与活化能 、温度(T)的关系提出经验关系式:
、温度(T)的关系提出经验关系式: (R为常数,k为速率常数,
(R为常数,k为速率常数, 为活化能,T为温度)。一定温度下,在
为活化能,T为温度)。一定温度下,在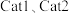 (催化剂)作用下,
(催化剂)作用下, 与
与 关系如图所示。
关系如图所示。_______ (填“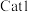 ”或“
”或“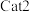 ”),判断依据是
”),判断依据是_______ 。
②为了测定反应级数(n),实验测得 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下:
已知:一步进行的反应称为基元反应,基元反应中反应级数等于反应物的化学计量数之和。下列叙述正确的是_______ (填标号)。
A.该总反应为二级反应
B.速率常数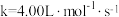
C.上述反应不是基元反应
D.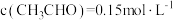 时
时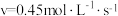
(4)一定温度下,保持总压强为 ,向反应器充入
,向反应器充入 和
和 的混合气体(
的混合气体( 不参与反应)发生反应
不参与反应)发生反应 ,测得
,测得 平衡转化率与起始投料比
平衡转化率与起始投料比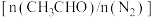 的关系如图所示。
的关系如图所示。 的平衡转化率随着投料比增大而减小的原因是
的平衡转化率随着投料比增大而减小的原因是_______ 。该温度下,上述反应M点平衡常数
_______  。(
。( 为用分压计算的平衡常数,分压=总压×物质的量分数)
为用分压计算的平衡常数,分压=总压×物质的量分数)
(5) 时,向反应器充入一定量
时,向反应器充入一定量 发生反应
发生反应 ,测得单位时间内
,测得单位时间内 转化率与压强关系如图所示。解释
转化率与压强关系如图所示。解释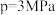 时
时 的转化率达到峰值的原因:
的转化率达到峰值的原因:_______ 。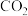 制备乙醛,其阴极的电极反应式为
制备乙醛,其阴极的电极反应式为_______ 。
 是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:(1)已知:①
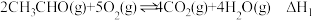
②

③
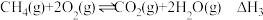
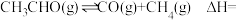
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量
 和
和 发生反应:
发生反应: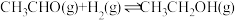 。下列叙述错误的是_______(填标号)。
。下列叙述错误的是_______(填标号)。| A.气体压强不随时间变化时达到平衡状态 |
| B.平衡后充入氖气,平衡向逆反应方向移动 |
| C.上述可逆反应的正反应是嫡增反应 |
D.平衡后,充入少量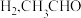 平衡转化率增大 平衡转化率增大 |
(3)
 速率方程
速率方程 (k为速率常数,只与温度、催化剂有关;n为反应级数)。
(k为速率常数,只与温度、催化剂有关;n为反应级数)。①阿伦尼乌斯就关于速率常数与活化能
 、温度(T)的关系提出经验关系式:
、温度(T)的关系提出经验关系式: (R为常数,k为速率常数,
(R为常数,k为速率常数, 为活化能,T为温度)。一定温度下,在
为活化能,T为温度)。一定温度下,在 (催化剂)作用下,
(催化剂)作用下, 与
与 关系如图所示。
关系如图所示。
 ”或“
”或“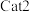 ”),判断依据是
”),判断依据是②为了测定反应级数(n),实验测得
 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下: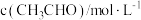 | 0.1 | 0.2 | 0.3 | 0.4 |
 | 0.020 | 0.080 | 0.182 | 0.318 |
A.该总反应为二级反应
B.速率常数
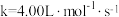
C.上述反应不是基元反应
D.
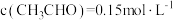 时
时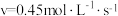
(4)一定温度下,保持总压强为
 ,向反应器充入
,向反应器充入 和
和 的混合气体(
的混合气体( 不参与反应)发生反应
不参与反应)发生反应 ,测得
,测得 平衡转化率与起始投料比
平衡转化率与起始投料比 的关系如图所示。
的关系如图所示。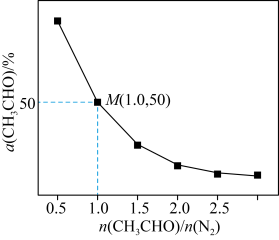
 的平衡转化率随着投料比增大而减小的原因是
的平衡转化率随着投料比增大而减小的原因是
 。(
。( 为用分压计算的平衡常数,分压=总压×物质的量分数)
为用分压计算的平衡常数,分压=总压×物质的量分数)(5)
 时,向反应器充入一定量
时,向反应器充入一定量 发生反应
发生反应 ,测得单位时间内
,测得单位时间内 转化率与压强关系如图所示。解释
转化率与压强关系如图所示。解释 时
时 的转化率达到峰值的原因:
的转化率达到峰值的原因: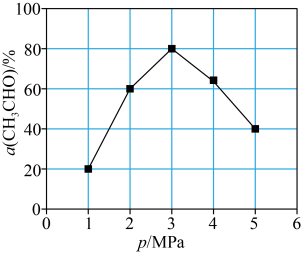
 制备乙醛,其阴极的电极反应式为
制备乙醛,其阴极的电极反应式为
您最近一年使用:0次
7 . 二氧化铈 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成 ,也能与
,也能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: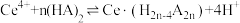 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比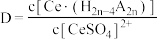 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率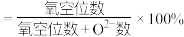 )
) 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂 后得到
后得到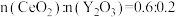 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: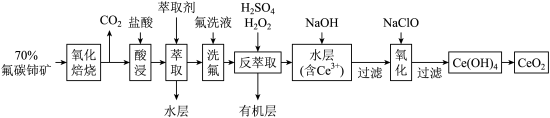
 能与
能与 结合成
结合成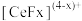 ,也能与
,也能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
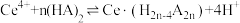 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比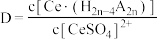 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: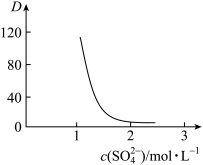
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率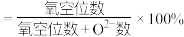 )
)
 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
 后得到
后得到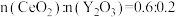 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
2024-04-24更新
|
381次组卷
|
3卷引用:化学(福建卷02)-2024年高考押题预测卷
(已下线)化学(福建卷02)-2024年高考押题预测卷2024届河南省漯河市高级中学高三下学期三模理综试题-高中化学福建省福建师范大学附属中学2023-2024学年高三下学期综合测试三(4月月考)化学试题
解题方法
8 . 一维结构氧化钇( )在光学和陶瓷等领域有重要用途。研究小组制备该
)在光学和陶瓷等领域有重要用途。研究小组制备该 的实验过程如下所示。
的实验过程如下所示。

(1)配制100mL2mol/L硝酸需用到的玻璃仪器有___________ 。
A.烧杯 B.量筒 C.温度计 D.玻璃棒 E.漏斗
(2)滴加浓氨水时,用pH试纸测试的具体操作为___________ 。
(3)洗涤时,先用蒸馏水后用乙醇的目的是___________ 。
(4)探究前驱体化学组成的实验装置如图所示(夹持装置略)。
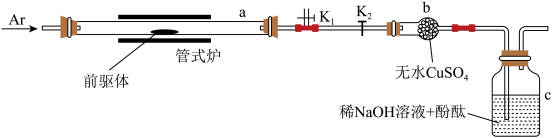
①加热前,打开 关闭
关闭 ,先通入Ar气一段时间;开始加热后,再打开
,先通入Ar气一段时间;开始加热后,再打开 关闭
关闭 ,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有
,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有___________ 。
②前驱体受热分解过程中:a中气体略有红棕色,说明产物含有___________ ;b中试剂变蓝,说明产物含有___________ ;c中溶液颜色变化的过程为___________ 。
(5)前驱体不含结晶水,其摩尔质量是587g/mol,阴离子与阳离子(仅有 )的个数比为2.75,则由前驱体生成
)的个数比为2.75,则由前驱体生成 的化学反应方程式为
的化学反应方程式为___________ 。
 )在光学和陶瓷等领域有重要用途。研究小组制备该
)在光学和陶瓷等领域有重要用途。研究小组制备该 的实验过程如下所示。
的实验过程如下所示。
(1)配制100mL2mol/L硝酸需用到的玻璃仪器有
A.烧杯 B.量筒 C.温度计 D.玻璃棒 E.漏斗
(2)滴加浓氨水时,用pH试纸测试的具体操作为
(3)洗涤时,先用蒸馏水后用乙醇的目的是
(4)探究前驱体化学组成的实验装置如图所示(夹持装置略)。

①加热前,打开
 关闭
关闭 ,先通入Ar气一段时间;开始加热后,再打开
,先通入Ar气一段时间;开始加热后,再打开 关闭
关闭 ,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有
,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有②前驱体受热分解过程中:a中气体略有红棕色,说明产物含有
(5)前驱体不含结晶水,其摩尔质量是587g/mol,阴离子与阳离子(仅有
 )的个数比为2.75,则由前驱体生成
)的个数比为2.75,则由前驱体生成 的化学反应方程式为
的化学反应方程式为
您最近一年使用:0次
解题方法
9 . 砷原子成键的多样性,使砷元素形成了结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)基态砷原子核外价电子排布式为___________ ,同周期中第一电离能大于砷的元素有___________ 种。
(2)砷可以形成多种酸和盐。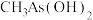 与
与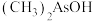 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是___________ (填化学式),原因为___________ 。 和
和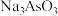 均可用于制农药,其阴离子的键角大小:
均可用于制农药,其阴离子的键角大小:
___________  (填“>”或“<”)。
(填“>”或“<”)。
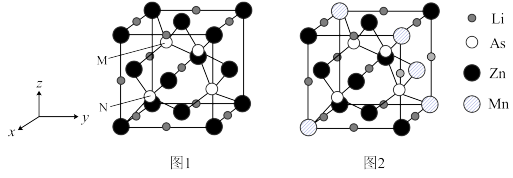
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为 ;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体
;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体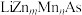 ,其立方晶胞结构如图2所示。
,其立方晶胞结构如图2所示。
①M点原子分数坐标为___________ 。
②m=___________ ,n=___________ 。
③已知NA为阿伏伽德罗常数的值,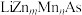 的摩尔质量为
的摩尔质量为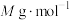 ,晶体密度为
,晶体密度为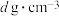 。晶胞中As原子与Mn原子之间的最短距离为
。晶胞中As原子与Mn原子之间的最短距离为___________ nm(列出计算式)。
④图1所示晶胞在 ,0.5和1三个截面上Zn和Li按图3所示分布,请在图4中As原子所在的截面上用“△”补画出As原子的位置
,0.5和1三个截面上Zn和Li按图3所示分布,请在图4中As原子所在的截面上用“△”补画出As原子的位置__________ ,并说明x=___________ 。

(1)基态砷原子核外价电子排布式为
(2)砷可以形成多种酸和盐。
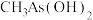 与
与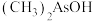 两种含砷有机酸中沸点较高的是
两种含砷有机酸中沸点较高的是 和
和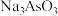 均可用于制农药,其阴离子的键角大小:
均可用于制农药,其阴离子的键角大小:
 (填“>”或“<”)。
(填“>”或“<”)。(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为
 ;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体
;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体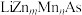 ,其立方晶胞结构如图2所示。
,其立方晶胞结构如图2所示。
①M点原子分数坐标为
②m=
③已知NA为阿伏伽德罗常数的值,
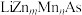 的摩尔质量为
的摩尔质量为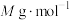 ,晶体密度为
,晶体密度为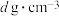 。晶胞中As原子与Mn原子之间的最短距离为
。晶胞中As原子与Mn原子之间的最短距离为④图1所示晶胞在
 ,0.5和1三个截面上Zn和Li按图3所示分布,请在图4中As原子所在的截面上用“△”补画出As原子的位置
,0.5和1三个截面上Zn和Li按图3所示分布,请在图4中As原子所在的截面上用“△”补画出As原子的位置
您最近一年使用:0次
名校
10 . 酚和芳香胺有广泛用途。
资料:i.苯酚分子中O的杂化轨道类型是sp2,未参与杂化的p轨道中有一对电子,该p轨道正好与苯环的π电子轨道发生侧面重叠,形成p-π共轭体系(大π键),使O的电子向苯环转移。
ii.苯胺分子结构与苯酚有相似之处,N的孤对电子占据的轨道也和苯环的π电子轨道部分重叠,形成共轭体系。
(1)p电子云轮廓图的形状是_______ 。
(2)C、H、O三种元素的电负性由强到弱的顺序是_______ 。
(3)比较相同条件下,苯酚与氯苯在水中的溶解度并说明理由:_______ 。
(4)苯胺分子中的原子不在同一平面内,N的杂化轨道类型是_______ 。
(5)下列说法正确的是_______ (填序号)。
a.第一电离能: O>N>C
b.苯酚具有酸性与分子中的p-π共轭有关
c.苯胺的碱性比氨强
d.苯胺可能与溴水发生取代反应
(6)80℃,有CuI存在时,邻氨基苯酚与碘苯可发生反应生成邻羟基二苯胺,过程如下:

①基态Cu+的价电子排布式是_______ ,CuI的作用是_______ 。
②用对硝基碘苯为原料与邻氨基苯酚反应,所需实验温度_______ 80℃ (填“>”或“<”)。
③增大碘苯与邻氨基苯酚的物质的量之比,使碘苯显著过量,则反应的主产物是X。
i.X的结构简式是_______ 。
ii.生成X的反应比生成邻羟基二苯胺的_______ (填 “易”或“难”),理由是_______ 。
资料:i.苯酚分子中O的杂化轨道类型是sp2,未参与杂化的p轨道中有一对电子,该p轨道正好与苯环的π电子轨道发生侧面重叠,形成p-π共轭体系(大π键),使O的电子向苯环转移。
ii.苯胺分子结构与苯酚有相似之处,N的孤对电子占据的轨道也和苯环的π电子轨道部分重叠,形成共轭体系。
(1)p电子云轮廓图的形状是
(2)C、H、O三种元素的电负性由强到弱的顺序是
(3)比较相同条件下,苯酚与氯苯在水中的溶解度并说明理由:
(4)苯胺分子中的原子不在同一平面内,N的杂化轨道类型是
(5)下列说法正确的是
a.第一电离能: O>N>C
b.苯酚具有酸性与分子中的p-π共轭有关
c.苯胺的碱性比氨强
d.苯胺可能与溴水发生取代反应
(6)80℃,有CuI存在时,邻氨基苯酚与碘苯可发生反应生成邻羟基二苯胺,过程如下:

①基态Cu+的价电子排布式是
②用对硝基碘苯为原料与邻氨基苯酚反应,所需实验温度
③增大碘苯与邻氨基苯酚的物质的量之比,使碘苯显著过量,则反应的主产物是X。
i.X的结构简式是
ii.生成X的反应比生成邻羟基二苯胺的
您最近一年使用:0次



