解题方法
1 .  是一种常用的氧化剂。某实验小组利用氯气氧化
是一种常用的氧化剂。某实验小组利用氯气氧化 制备
制备 并对其性质进行探究。
并对其性质进行探究。
【 的制备】
的制备】
(1)用下图装置制备 (加热和夹持装置已略去),装置B的作用是
(加热和夹持装置已略去),装置B的作用是___________ 。 ;
;___________ 。
【 的性质探究】
的性质探究】
资料:i. 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原成
,在近中性条件下被还原成 。
。
ii.单质硫可溶于 溶液,溶液呈淡黄色。
溶液,溶液呈淡黄色。
某小组研究 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。
(3)①甲同学取实验Ⅰ中少量溶液进行实验,检测有 ,得出
,得出 被氧化成
被氧化成 的结论,乙同学否定了该结论,理由是
的结论,乙同学否定了该结论,理由是___________ 。
②同学讨论后,设计了如下实验,证实该条件下 的确可以将
的确可以将 氧化成
氧化成 。
。___________ 。
b.连通后电流计指针偏转,一段时间后,___________ (填操作和现象)。
(4)实验I的现象与资料i不相符,其原因是新生成的产物( )与过量的反应物(
)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是___________ 。
(5)实验II的现象与资料也不完全相符,丙同学猜想原因与(4)中所述原因相似,其原因是___________ ,请设计验证此猜想的实验方案___________ 。
(6)反思:反应物相同而现象不同,表明物质变化不仅与其自身的性质有关,还与___________ 等因素有关。
 是一种常用的氧化剂。某实验小组利用氯气氧化
是一种常用的氧化剂。某实验小组利用氯气氧化 制备
制备 并对其性质进行探究。
并对其性质进行探究。【
 的制备】
的制备】(1)用下图装置制备
 (加热和夹持装置已略去),装置B的作用是
(加热和夹持装置已略去),装置B的作用是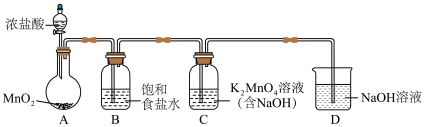
 ;
;【
 的性质探究】
的性质探究】资料:i.
 在强酸性条件下被还原为
在强酸性条件下被还原为 ,在近中性条件下被还原成
,在近中性条件下被还原成 。
。ii.单质硫可溶于
 溶液,溶液呈淡黄色。
溶液,溶液呈淡黄色。某小组研究
 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。| 实验序号 | 实验过程 | 实验现象 |
| Ⅰ |
| 紫色变浅( ),生成棕褐色沉淀( ),生成棕褐色沉淀( ) ) |
| Ⅱ |
| 溶液呈淡黄色( ),生成浅粉色沉淀(MnS) ),生成浅粉色沉淀(MnS) |
(3)①甲同学取实验Ⅰ中少量溶液进行实验,检测有
 ,得出
,得出 被氧化成
被氧化成 的结论,乙同学否定了该结论,理由是
的结论,乙同学否定了该结论,理由是②同学讨论后,设计了如下实验,证实该条件下
 的确可以将
的确可以将 氧化成
氧化成 。
。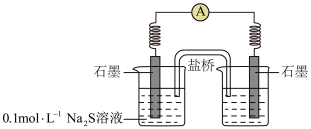
b.连通后电流计指针偏转,一段时间后,
(4)实验I的现象与资料i不相符,其原因是新生成的产物(
 )与过量的反应物(
)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是(5)实验II的现象与资料也不完全相符,丙同学猜想原因与(4)中所述原因相似,其原因是
(6)反思:反应物相同而现象不同,表明物质变化不仅与其自身的性质有关,还与
您最近一年使用:0次
解题方法
2 . 草酸钴( )可用于催化剂的制备,用水钻矿(主要成分为
)可用于催化剂的制备,用水钻矿(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 、
、 杂质)制备草酸钴工艺流程如图所示:
杂质)制备草酸钴工艺流程如图所示: 不能直接被
不能直接被 浸出;
浸出;
②酸性条件下, 转化为
转化为 ,但
,但 不会氧化
不会氧化 ;
;
③部分阳离子以氢氧化物形式沉淀时溶液的 如表所示:
如表所示:
(1)酸浸时,为提高矿石的溶解速率可采取的一种措施为___________ 。
(2)浸出过程中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)向“浸出液”中加入 的作用是
的作用是___________ 。
(4)加入 调节溶液
调节溶液 至5.2,过滤所得到的沉淀成分为
至5.2,过滤所得到的沉淀成分为___________ 。
(5)滤液I“除镁、钙”是将镁、钙离子转化为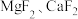 沉淀。已知在该操作温度下,
沉淀。已知在该操作温度下,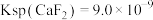 ,若使
,若使 沉淀完全[c(Ca2+)≤10-5mol/L],所需
沉淀完全[c(Ca2+)≤10-5mol/L],所需 浓度不低于
浓度不低于___________  。
。
(6)在萃取除锰时,先向除杂后的溶液中加入有机酸萃取剂,金属离子的萃取率与溶液 的关系如图,萃取应选择的
的关系如图,萃取应选择的 范围是
范围是___________ 。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5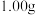 样品,将其用适当试剂转化,得到草酸铵[
样品,将其用适当试剂转化,得到草酸铵[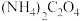 ]溶液,再用过量稀硫酸酸化,用
]溶液,再用过量稀硫酸酸化,用
 溶液滴定,已知
溶液滴定,已知 在酸性条件下被还原为
在酸性条件下被还原为 ,达到滴定终点时,用去
,达到滴定终点时,用去 溶液
溶液 。所得草酸钴样品中
。所得草酸钴样品中 的纯度为
的纯度为___________ [已知: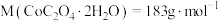 ]。
]。
 )可用于催化剂的制备,用水钻矿(主要成分为
)可用于催化剂的制备,用水钻矿(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 、
、 、
、 杂质)制备草酸钴工艺流程如图所示:
杂质)制备草酸钴工艺流程如图所示:
 不能直接被
不能直接被 浸出;
浸出;②酸性条件下,
 转化为
转化为 ,但
,但 不会氧化
不会氧化 ;
;③部分阳离子以氢氧化物形式沉淀时溶液的
 如表所示:
如表所示:| 沉淀物 |  |  |  |  |  |
开始沉淀时的 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
完全沉淀时的 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(2)浸出过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)向“浸出液”中加入
 的作用是
的作用是(4)加入
 调节溶液
调节溶液 至5.2,过滤所得到的沉淀成分为
至5.2,过滤所得到的沉淀成分为(5)滤液I“除镁、钙”是将镁、钙离子转化为
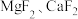 沉淀。已知在该操作温度下,
沉淀。已知在该操作温度下,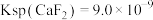 ,若使
,若使 沉淀完全[c(Ca2+)≤10-5mol/L],所需
沉淀完全[c(Ca2+)≤10-5mol/L],所需 浓度不低于
浓度不低于 。
。(6)在萃取除锰时,先向除杂后的溶液中加入有机酸萃取剂,金属离子的萃取率与溶液
 的关系如图,萃取应选择的
的关系如图,萃取应选择的 范围是
范围是A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

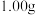 样品,将其用适当试剂转化,得到草酸铵[
样品,将其用适当试剂转化,得到草酸铵[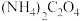 ]溶液,再用过量稀硫酸酸化,用
]溶液,再用过量稀硫酸酸化,用
 溶液滴定,已知
溶液滴定,已知 在酸性条件下被还原为
在酸性条件下被还原为 ,达到滴定终点时,用去
,达到滴定终点时,用去 溶液
溶液 。所得草酸钴样品中
。所得草酸钴样品中 的纯度为
的纯度为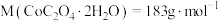 ]。
]。
您最近一年使用:0次
解题方法
3 . 氮元素能与金属或者非金属元素形成种类繁多、应用广泛的化合物。
(1)基态N原子的价层电子轨道表示式是___________ 。
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是___________ 。
② 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由___________ 。
(3)配合物 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于___________ 区元素,该配合物中的配位原子是___________ ,配位数是___________ 。
(4) 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是___________ 。
(5) 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。 最近的
最近的 有
有___________ 个。
②已知阿伏加德罗常数为 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为___________  (
(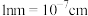 )。
)。
(1)基态N原子的价层电子轨道表示式是
(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。
①在最简单的氮烯分子中,N的杂化方式是
②
 具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断
具有很强的还原性,是常用的火箭推进剂,它在常温常压下为无色液体。判断 是否溶于水并说明理由
是否溶于水并说明理由(3)配合物
 可用作广谱杀菌剂,其中Cu属于
可用作广谱杀菌剂,其中Cu属于(4)
 的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是
的某种晶体结构中,原子间均以单键结合,其硬度比金刚石大,原因是(5)
 和
和 形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为
形成的化合物是一种重要的半导体材料。其某种晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。
 最近的
最近的 有
有②已知阿伏加德罗常数为
 ,氮化镓(GaN)的摩尔质量为
,氮化镓(GaN)的摩尔质量为 ,该晶体的密度表达式为
,该晶体的密度表达式为 (
(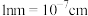 )。
)。
您最近一年使用:0次
4 . 在催化剂作用下, 分解生成
分解生成 和
和 可能的反应机理如下图所示。
可能的反应机理如下图所示。
 分解生成
分解生成 和
和 可能的反应机理如下图所示。
可能的反应机理如下图所示。
| A.催化剂能降低反应的活化能 |
| B.第一步转化中N与H间形成的化学键是配位键 |
| C.第三步转化涉及极性键的断裂与非极性键的生成 |
D.若用 HCOOD代替 HCOOD代替 ,反应除生成 ,反应除生成 外,还生成 外,还生成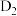 |
您最近一年使用:0次
5 . 下列化学用语或图示表达正确的是
A. 的电子式: 的电子式: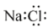 |
B.基态 原子的价层电子排布式: 原子的价层电子排布式: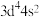 |
C. 的空间结构:V形 的空间结构:V形 |
D.顺-2-丁烯的分子结构模型: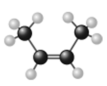 |
您最近一年使用:0次
6 . 下列离子方程式与所给事实不相符的是
A.电解水制氢气中的阳极反应: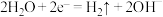 |
B.常温下醋酸钠溶液 : : |
C. 与水反应制硝酸: 与水反应制硝酸: |
D.金属 与水发生反应: 与水发生反应: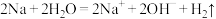 |
您最近一年使用:0次
7 . 下列事实不能用化学平衡移动原理解释的是
A. 的醋酸溶液加水稀释100倍, 的醋酸溶液加水稀释100倍,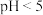 |
B.密闭烧瓶内的 和 和 的混合气体,受热后颜色加深 的混合气体,受热后颜色加深 |
C.水垢中含有 ,可先用 ,可先用 溶液浸泡处理,再用盐酸溶解 溶液浸泡处理,再用盐酸溶解 |
D.锌片与稀 反应过程中,加入少量 反应过程中,加入少量 固体,促进 固体,促进 的产生 的产生 |
您最近一年使用:0次
8 . 工业上利用“碘循环”吸收 ,同时制得
,同时制得 ,流程如图所示。下列说法正确的是
,流程如图所示。下列说法正确的是
 ,同时制得
,同时制得 ,流程如图所示。下列说法正确的是
,流程如图所示。下列说法正确的是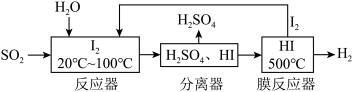
A.反应器中发生的反应离子方程式为: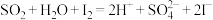 |
B.反应器中控制温度的目的是增大 的溶解度以加快吸收 的溶解度以加快吸收 |
| C.分离器中物质分离的方法为蒸馏 |
| D.膜反应器中,增大压强有利于提高平衡转化率 |
您最近一年使用:0次
名校
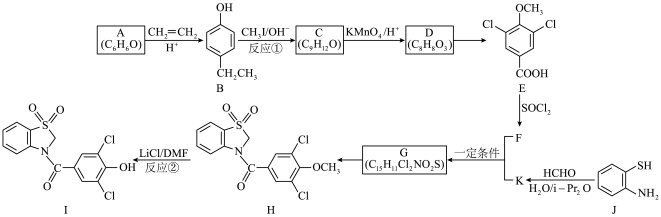
9 . 多丁纳德(化合物I)是一种治疗痛风的药物,以下为其合成路线之一(部分条件已略去)。___________ 。
(2)A→B的反应类型是___________ 。
(3)C的结构简式是___________ 。
(4)D→E的反应试剂和条件是___________ 。
(5)在D的同分异构体中,同时满足下列条件的结构简式是___________ 。
①含有苯环
②遇 溶液显紫色
溶液显紫色
③与 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为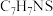 ,F+K→G的方程式是
,F+K→G的方程式是___________ 。
(7)设计反应①和反应②的目的是___________ 。
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式___________ 。
已知: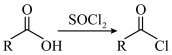
(2)A→B的反应类型是
(3)C的结构简式是
(4)D→E的反应试剂和条件是
(5)在D的同分异构体中,同时满足下列条件的结构简式是
①含有苯环
②遇
 溶液显紫色
溶液显紫色③与
 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为
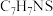 ,F+K→G的方程式是
,F+K→G的方程式是(7)设计反应①和反应②的目的是
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式
您最近一年使用:0次
2024-04-10更新
|
335次组卷
|
2卷引用:北京市房山区2024届高三一模化学试题
名校
解题方法
10 . 大气中 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。
(1) 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ: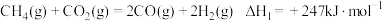
Ⅱ: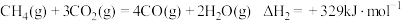
反应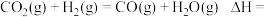
___________
(2)工业上可利用 制备
制备 :
:
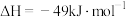
① 时,该反应的平衡常数
时,该反应的平衡常数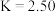 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②提高反应速率且增大 的平衡产率,可采取的措施
的平衡产率,可采取的措施___________ 。
A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出
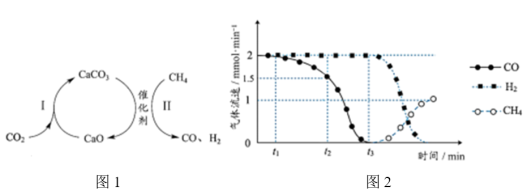
(3)一种捕获 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的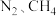 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。___________ 。
② 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因___________ 。
③ 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为___________ 。
(4)在铜基配合物的催化作用下,利用电化学原理可将 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。___________ 。
②当有 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为___________ 。
 含量的控制和
含量的控制和 资源化利用具有重要意义。
资源化利用具有重要意义。(1)
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
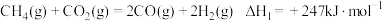
Ⅱ:
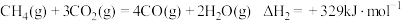
反应
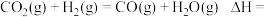
(2)工业上可利用
 制备
制备 :
:
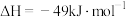
①
 时,该反应的平衡常数
时,该反应的平衡常数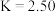 ,该温度下某时刻测得体系内四种物质的浓度均为
,该温度下某时刻测得体系内四种物质的浓度均为 ,则此时
,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②提高反应速率且增大
 的平衡产率,可采取的措施
的平衡产率,可采取的措施A.升高反应温度
B.使用合适的催化剂
C.增大体系压强
D.从平衡体系中及时分离出

(3)一种捕获
 并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以
并实现资源利用的反应原理如图1所示。反应Ⅰ完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的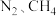 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了副反应(反应Ⅲ):
,在催化剂上有积碳,推测发生了副反应(反应Ⅲ): 。
。
②
 时间段内,反应Ⅱ速率减小至0的原因
时间段内,反应Ⅱ速率减小至0的原因③
 时刻,反应II和反应Ⅲ生成
时刻,反应II和反应Ⅲ生成 的速率之比为
的速率之比为(4)在铜基配合物的催化作用下,利用电化学原理可将
 转化为碳基燃料(包括
转化为碳基燃料(包括 、烷烃和羧酸等),其装置原理如图所示。
、烷烃和羧酸等),其装置原理如图所示。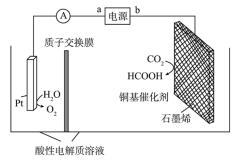
②当有
 通过质子交换膜时,理论上最多生成
通过质子交换膜时,理论上最多生成 的质量为
的质量为
您最近一年使用:0次
2024-04-10更新
|
293次组卷
|
2卷引用:北京市房山区2024届高三一模化学试题





