解题方法
1 . 如图所示将锌、铜通过导线相连,置于硫酸溶液中。___________ 能转化为___________ 能。
(2) 电极为
电极为___________ 极,发生___________ (填“氧化”或“还原”)反应,电极方程式为___________ 。
(3)外电路电流由___________ (填“锌”或“铜”,下同)电极经导线流向___________ 电极。
(4)标准状况下,若反应过程中溶解了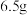 锌,则生成的氢气的体积为
锌,则生成的氢气的体积为___________  。
。

(2)
 电极为
电极为(3)外电路电流由
(4)标准状况下,若反应过程中溶解了
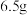 锌,则生成的氢气的体积为
锌,则生成的氢气的体积为 。
。
您最近一年使用:0次
2 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、铁、钴、硼、镓、硒等。其中某种重要的含铜的化合物结构如图。请回答下列问题:___________ 区。在第___________ 周期
(2)基态二价铜离子的电子排布式为___________ ,已知高温下 比CuO更稳定,试从核外电子排布角度解释
比CuO更稳定,试从核外电子排布角度解释
(3)硼核外电子的运动状态的概率密度分布可用___________ 形象化描述。
(4) 的价电子排布图为
的价电子排布图为___________ 。
(5)N、O、Se三种元素中的第一电离能最大的为:___________ ,电负性最大的是___________ 。
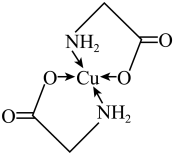
(2)基态二价铜离子的电子排布式为
 比CuO更稳定,试从核外电子排布角度解释
比CuO更稳定,试从核外电子排布角度解释(3)硼核外电子的运动状态的概率密度分布可用
(4)
 的价电子排布图为
的价电子排布图为(5)N、O、Se三种元素中的第一电离能最大的为:
您最近一年使用:0次
解题方法
3 . 砷化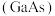 是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。
是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。
回答下列问题:
(1)写出基态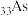 原子的核外电子排布式
原子的核外电子排布式___________ 。
(2)原子半径Ga___________ As,第一电离能Ga___________ As。
(3) 熔点为
熔点为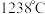 ,晶胞结构如图所示,则一个晶胞含
,晶胞结构如图所示,则一个晶胞含
___________ 个,含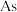
___________ 个。
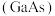 是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。
是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。回答下列问题:
(1)写出基态
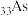 原子的核外电子排布式
原子的核外电子排布式(2)原子半径Ga
(3)
 熔点为
熔点为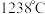 ,晶胞结构如图所示,则一个晶胞含
,晶胞结构如图所示,则一个晶胞含

您最近一年使用:0次
4 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ (填“氧化”或“还原”,下同)。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________ 性。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。
①配平上述氧化还原反应方程式___________ 。
②该反应中,氧化剂是___________ (填化学式),被氧化的元素是___________ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为:
的反应为: 。
。
①该反应中的还原产物是___________ (写化学式),反应中每生成1mol 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为___________ ,转移电子的数目为___________ 。
②用“单线桥”标出反应中电子转移的方向与数目___________ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是___________ (填字母)。
a. b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为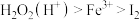 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为___________ 。
(1)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。①配平上述氧化还原反应方程式
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为:
的反应为: 。
。①该反应中的还原产物是
 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为②用“单线桥”标出反应中电子转移的方向与数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是a.
 b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为
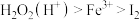 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近一年使用:0次
名校
5 . 某学习小组探究B及其化合物的性质。
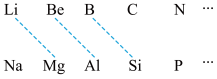
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。___________ 。其最高价氧化物的化学式为___________ ,与氢氧化钠溶液反应的化学方程式为___________ 。
(2)某科研团队研究发现硼氢化钠( )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。___________ 。
②图中反应的总化学方程式为___________ 。
③___________ g 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。
(2)某科研团队研究发现硼氢化钠(
 )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。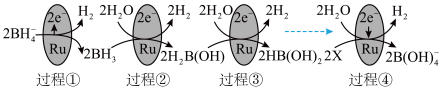
②图中反应的总化学方程式为
③
 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
您最近一年使用:0次
2024-02-06更新
|
60次组卷
|
2卷引用:新疆伊犁州霍城县江苏中学2023-2024学年高一上学期12月 化学试题
名校
解题方法
6 . SO2是大气的主要污染物,工业上利用钠碱循环法可除去SO2。回答下列问题:
(1)除SO2的吸收液为Na2SO3溶液,该反应的离子方程式是__________ 。
(2)在0.1mol/L Na2SO3溶液中离子浓度关系不正确 的是__________(填字母)。
(3)泡沫灭火器内外桶中各盛有一定浓度的NaHCO3、Al2(SO4)3溶液。使用时须将该灭火器反转并拔掉插销,让上述溶液混合并由喷嘴喷射出一定量的气流和难溶物,覆盖在可燃物的表面起到灭火效果。
①该灭火器一般用塑料内桶盛装Al2(SO4)3的原因是(用离子方程式表示):__________ 。
②写出该灭火器灭火原理的离子方程式__________ 。
(1)除SO2的吸收液为Na2SO3溶液,该反应的离子方程式是
(2)在0.1mol/L Na2SO3溶液中离子浓度关系
A.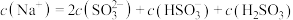 |
B. |
C. |
D. |
①该灭火器一般用塑料内桶盛装Al2(SO4)3的原因是(用离子方程式表示):
②写出该灭火器灭火原理的离子方程式
您最近一年使用:0次
2023-12-14更新
|
89次组卷
|
2卷引用:新疆伊犁州霍城县江苏中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
7 . 实验室(室温下)存放着如下几种试剂:
①0.1mol/LCH3COOH溶液②0.1mol/LCH3COONa溶液③0.1mol/LNaOH溶液④0.1mol/L盐酸⑤0.1mol/L氨水⑥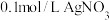 溶液⑦
溶液⑦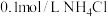 溶液⑧
溶液⑧ 溶液
溶液
回答下列问题:
(1)溶液的 ,且促进水的电离的试剂是
,且促进水的电离的试剂是___________ (填序号,下同)。
(2)试剂①、④、⑥中由水电离的氢离子浓度 由大到小的顺序是
由大到小的顺序是___________ 。
(3)试剂⑤、⑦、⑧溶液中 由大到小的顺序是
由大到小的顺序是___________ 。
(4)将试剂⑤和试剂⑦等体积混合后测得混合溶液显碱性,则混合溶液中离子浓度由大到小的顺序是___________ 。试剂⑦中某离子M的浓度为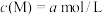 ,将试剂④和试剂⑦等体积混合后测得
,将试剂④和试剂⑦等体积混合后测得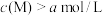 ,则该离子M是
,则该离子M是___________ (填序号)。
A. B.
B. C.
C. D.
D.
(5)试剂⑧中电荷守恒的表达式是___________ 。
(6)已知醋酸的电离常数 ,将试剂①和试剂②等体积混合后,
,将试剂①和试剂②等体积混合后, 的水解常数
的水解常数
___________ 。已知亚硫酸的电离常数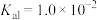 ,
,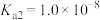 。向
。向 溶液中加入过量试剂①发生反应的离子方程式是
溶液中加入过量试剂①发生反应的离子方程式是___________ 。
①0.1mol/LCH3COOH溶液②0.1mol/LCH3COONa溶液③0.1mol/LNaOH溶液④0.1mol/L盐酸⑤0.1mol/L氨水⑥
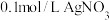 溶液⑦
溶液⑦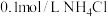 溶液⑧
溶液⑧ 溶液
溶液回答下列问题:
(1)溶液的
 ,且促进水的电离的试剂是
,且促进水的电离的试剂是(2)试剂①、④、⑥中由水电离的氢离子浓度
 由大到小的顺序是
由大到小的顺序是(3)试剂⑤、⑦、⑧溶液中
 由大到小的顺序是
由大到小的顺序是(4)将试剂⑤和试剂⑦等体积混合后测得混合溶液显碱性,则混合溶液中离子浓度由大到小的顺序是
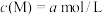 ,将试剂④和试剂⑦等体积混合后测得
,将试剂④和试剂⑦等体积混合后测得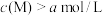 ,则该离子M是
,则该离子M是A.
 B.
B. C.
C. D.
D.
(5)试剂⑧中电荷守恒的表达式是
(6)已知醋酸的电离常数
 ,将试剂①和试剂②等体积混合后,
,将试剂①和试剂②等体积混合后, 的水解常数
的水解常数
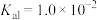 ,
,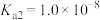 。向
。向 溶液中加入过量试剂①发生反应的离子方程式是
溶液中加入过量试剂①发生反应的离子方程式是
您最近一年使用:0次
2023-12-13更新
|
297次组卷
|
3卷引用:新疆伊犁州霍城县江苏中学2023-2024学年高二上学期12月月考化学试题
新疆伊犁州霍城县江苏中学2023-2024学年高二上学期12月月考化学试题河北省张家口市张垣联盟2023-2024学年高二上学期12月阶段测试化学试题(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
8 . 按要求回答下列问题:
(1)已知下列物质电离平衡常数
①次氯酸的电离方程式为___________ 。
②物质的量浓度相同的HF、CH3COOH、H2CO3、HClO中,酸性由小到大的顺序为___________ 。
③下列实验事实不能证明醋酸是弱酸的是___________ 。
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.在相同条件下,同浓度醋酸溶液的导电性比盐酸的弱
(2)高温下H2O可以分解成分子或原子。
①若在相同温度下,1molH2O按下列两种途径转化成氢原子与氧原子。则△H1、△H2、△H3三者之间的关系是___________ 。
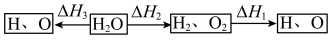
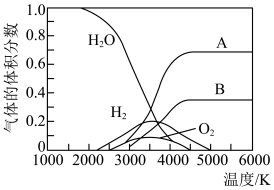
②高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A表示的物质(或微粒)是___________ 。等物质的量的A、H2相比,化学能较低的物质是___________ 。
(1)已知下列物质电离平衡常数
| 化学式 | HF |  |  |  |
| 电离平衡常数 | 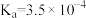 |  | 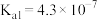  | 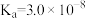 |
②物质的量浓度相同的HF、CH3COOH、H2CO3、HClO中,酸性由小到大的顺序为
③下列实验事实不能证明醋酸是弱酸的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.在相同条件下,同浓度醋酸溶液的导电性比盐酸的弱
(2)高温下H2O可以分解成分子或原子。
①若在相同温度下,1molH2O按下列两种途径转化成氢原子与氧原子。则△H1、△H2、△H3三者之间的关系是
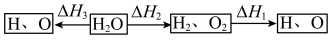
②高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A表示的物质(或微粒)是

您最近一年使用:0次
9 . 回答下列问题:
(1)在298K、100Kpa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3=___________ (用△H1和△H2表示)。
(2)在一定体积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度t的关系如表所示:
,其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=___________ 。
②该反应为___________ (填“吸热”或“放热)反应。
③某温度下平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为______ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 ,
, ,
, ,
, ,则下一时刻,反应向
,则下一时刻,反应向___________ (填“正向”、“逆向”或“平衡”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中 的大小:
的大小:
___________  (填“>”或“<”)。
(填“>”或“<”)。
①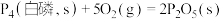

②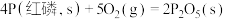

(1)在298K、100Kpa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3=
(2)在一定体积的密闭容器中,进行如下化学反应:
 ,其化学平衡常数K和温度t的关系如表所示:
,其化学平衡常数K和温度t的关系如表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②该反应为
③某温度下平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
 ,
, ,
, ,
, ,则下一时刻,反应向
,则下一时刻,反应向(3)已知常温时红磷比白磷稳定,比较下列反应中
 的大小:
的大小:
 (填“>”或“<”)。
(填“>”或“<”)。①
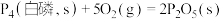

②
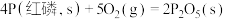

您最近一年使用:0次
10 . 电化学是化学研究重要分支,在生产生活中发挥着非常重要的作用。请回答下列问题:
铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为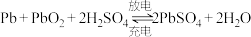 。
。
(1)放电时,正极的电极反应式:______ ,电解质溶液中硫酸的浓度______ (填“增大”“减小”或“不变”),当外电路通过1mol 时,理论上负极板的质量增加
时,理论上负极板的质量增加______ g。
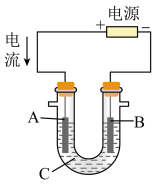
(2)用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。
如下图所示,电解液c选用______ 溶液,A电极的材料是______ ,B电极反应式是______ 。
铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为
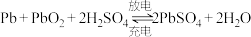 。
。(1)放电时,正极的电极反应式:
 时,理论上负极板的质量增加
时,理论上负极板的质量增加(2)用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。
如下图所示,电解液c选用

您最近一年使用:0次
2023-12-04更新
|
72次组卷
|
2卷引用:新疆伊犁州霍城县江苏中学2023-2024学年高二上学期12月月考化学试题



