1 . 将21.6g生锈的铁粉(铁锈主要成分为Fe2O3·xH2O)放入200mL3.5mol/L的盐酸中,完全溶解后产生气体3.36L(标准状况),向反应后的溶液中滴入几滴KSCN溶液,溶液无明显现象,再向溶液中加入NaHCO3至溶液pH=7,又产生气体2.24L(标准状况)。已知:氧化性Fe3+>H+,回答下列问题:
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:___________ 。
(2)反应产生的前后两种气体质量之比为___________ 。
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)___________ 。
(1)写出铁粉溶解过程中氧化还原反应的离子方程式:
(2)反应产生的前后两种气体质量之比为
(3)计算生锈铁粉中铁元素的质量分数(无计算过程不给分)
您最近一年使用:0次
2022-01-20更新
|
414次组卷
|
2卷引用:四川省自贡市田家柄中学教育集团2021-2022学年高一下学期入学考试化学试题
13-14高一上·河北石家庄·期中
名校
解题方法
2 . 取100mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51 g白色沉淀,再用过量稀硝酸处理沉淀,最后减少到4.66 g,并有气体放出。
计算:(1)原混合液中Na2SO4的物质的量浓度__________ 。
(2)产生的气体在标准状况下的体积________________ 。
计算:(1)原混合液中Na2SO4的物质的量浓度
(2)产生的气体在标准状况下的体积
您最近一年使用:0次
2020-10-17更新
|
137次组卷
|
8卷引用:四川省自贡市田家柄中学教育集团2021-2022学年高一上学期期中考试化学试题
四川省自贡市田家柄中学教育集团2021-2022学年高一上学期期中考试化学试题(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷江西省崇义中学2017-2018学年高一上学期第一次月考化学试题江苏省沭阳县修远中学2019-2020学年高一上学期第一次月考化学试题江苏省苏州市震泽中学2019-2020学年高一上学期第一次月考(非杨班)化学试题云南省玉溪市玉溪一中2019-2020学年高一上学期期中考试化学试题江苏省苏州市吴江区吴江平望中学2020-2021学年高一上学期阶段性测试(一)化学试题江苏省常州市戚墅堰高级中学2020-2021学年高一上学期期中质量调研考试化学试题
解题方法
3 . 把3.86 g Cu﹣Zn合金粉末放入40 mL 2.0 mol/L的稀硫酸中,完全反应产生气体448 mL(标准状况).试计算:(必须列出计算过程,计算结果保留1位小数)
(1)合金中铜的质量分数;
(2)再向上述溶液中滴加稀硝酸,要使金属完全溶解,最少需要2.0 mol/L的硝酸多少毫升?
(1)合金中铜的质量分数;
(2)再向上述溶液中滴加稀硝酸,要使金属完全溶解,最少需要2.0 mol/L的硝酸多少毫升?
您最近一年使用:0次
4 . 用NA表示阿伏加 德罗常数的数值,按要求完成下列填空。
(1)1个CO2分子含有________ 个电子,1 mol CO2含有______ molO ,_____ mol e-。
(2)1.204x1024个NH3分子含有原子_______ mol,含有N________ mol ,含H______ mol 。
(3)0.5 mol H2O中含有________ 个水分子,含有原子________ 个。
(4)质量都是50 g的 HCl、NH3、SO3、O2四种气体,含原子个数最多的是_______ 。
(5)写出NaHCO3在水溶液中的电离方程式:__________________ 。
(1)1个CO2分子含有
(2)1.204x1024个NH3分子含有原子
(3)0.5 mol H2O中含有
(4)质量都是50 g的 HCl、NH3、SO3、O2四种气体,含原子个数最多的是
(5)写出NaHCO3在水溶液中的电离方程式:
您最近一年使用:0次
5 . 3.6g H2O的物质的量是______ ,含有______ 个水分子,含有______ mol H;12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为______ ,R的相对原子质量为______ 。含R的质量为1.6g的Na2R,其物质的量为_______ 。
您最近一年使用:0次
6 . 将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·-1的NaOH溶液。请回答:
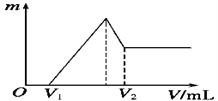
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如图所示,当V1=160 mL时,则金属粉末中n(Mg)=______________ mol,V2=_____________ mL。
(2)若混合物仍为0.1 mol,其中Mg粉物质的量分数为a ,用100 mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol/LNaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是______________ 。

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如图所示,当V1=160 mL时,则金属粉末中n(Mg)=
(2)若混合物仍为0.1 mol,其中Mg粉物质的量分数为a ,用100 mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol/LNaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是
您最近一年使用:0次
2017-03-04更新
|
616次组卷
|
2卷引用:四川省自贡市田家炳中学2020-2021学年高一12月月考化学试题
7 . 浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为4.48L(标准状况)。
试计算:
(1)反应后生成硫酸铜的物质的量_______ 。
(2)若将反应后的溶液稀释至500mL,计算该溶液中硫酸铜的物质的量浓度_______ 。
试计算:
(1)反应后生成硫酸铜的物质的量
(2)若将反应后的溶液稀释至500mL,计算该溶液中硫酸铜的物质的量浓度
您最近一年使用:0次
2016-12-09更新
|
380次组卷
|
3卷引用:四川省自贡市田家炳中学2021-2022学年高一下学期期中考试化学试题
11-12高一上·江西·期中
8 . 实验室常用盐酸的质量分数为36.5%,密度为1.20g/mL。
(1)此浓盐酸的物质的量浓度是多少?_______________ (列式计算)
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?______________ (列式计算)
(3)用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):______ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
(1)此浓盐酸的物质的量浓度是多少?
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?
(3)用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
您最近一年使用:0次
2011-11-09更新
|
752次组卷
|
10卷引用:四川省自贡市田家炳中学2019-2020学年高一上学期期中考试化学试题
四川省自贡市田家炳中学2019-2020学年高一上学期期中考试化学试题(已下线)2011-2012学年江西省白鹭洲中学高一上学期期中考试化学试卷(已下线)2013-2014学年广东省梅州市重点中学高一上学期质检化学试卷(已下线)2014-2015学年山东桓台第二中学高一上学期(10月)检测化学试卷2015-2016学年山东省桓台二中高一上学期期中测试化学试卷广西钦州市钦州港经济技术开发区中学2017-2018学年高一上学期开学考试化学试题福建省莆田第九中学2018-2019学年高一上学期开学考试化学试题湖北省利川市第五中学2018-2019学年高一上学期期中模拟考试化学试题湖北省黄冈市2018-2019学年高一6月月考化学试题甘肃省兰州市兰州新区高级中学2019-2020学年高一上学期期中考试化学试题



