解题方法
1 . 回答下列问题:
(1)多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和相应的能量图如图。
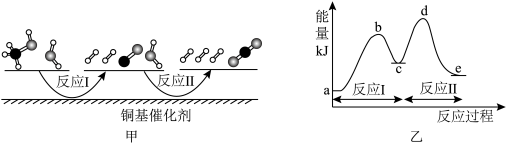
已知:a,b,c,d,e均表示能量值。
①选择优良的催化剂降低反应I和Ⅱ的活化能,有利于_____ (填“增加”或“减少”)过程中的能耗,反应Ⅱ的热化学方程式为_____ 。
②该反应属于_____ (填“放热”或“吸热”)反应,请写出总反应的热化学方程式:_____ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合并在高温下煅烧,所得物质可作耐高温材料:
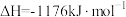 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为_____ 。
(3)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式为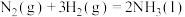

_____ 。
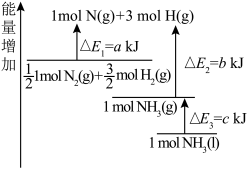
(4)下表是部分化学键的键能数据。
①已知1mol白磷完全燃烧生成固态 的反应热
的反应热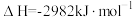 ,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
_____ 。
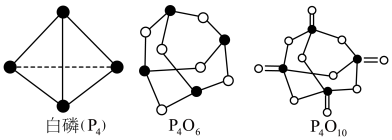
②0.5mol白磷(P4)与O2完全反应生成固态P4O6,放出的热量为_____ kJ。
(1)多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和相应的能量图如图。

已知:a,b,c,d,e均表示能量值。
①选择优良的催化剂降低反应I和Ⅱ的活化能,有利于
②该反应属于
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合并在高温下煅烧,所得物质可作耐高温材料:

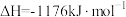 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为(3)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式为
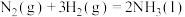


(4)下表是部分化学键的键能数据。
| 化学键 |  |  |  | 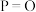 |
| 键能/(kJ·mol-1) | 198 | 360 | 498 |  |
 的反应热
的反应热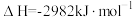 ,白磷(P4)、P4O6、P4O10结构如图所示,则上表中
,白磷(P4)、P4O6、P4O10结构如图所示,则上表中

②0.5mol白磷(P4)与O2完全反应生成固态P4O6,放出的热量为
您最近一年使用:0次
2023-10-27更新
|
262次组卷
|
3卷引用:四川省仁寿第一中学校(北校区)2023-2024学年高二上学期10月月考化学试题
2 . 完成下列问题。
(1)写出下列物理量的单位:物质的量_______ ,摩尔质量_______ ,气体摩尔体积_______ ,物质的量浓度_______ 。
计算:
(2)标况下,11.2LNH3的物质的量是_______ mol,质量是_______ g。0.5molNa2SO4中含_______ 个Na+。
(3)1mol 中含有质子的物质的量为
中含有质子的物质的量为_______ mol,含有电子的物质的量为_______ mol。
(4)100mL2mol/L的硫酸溶液溶质的物质的量为_______ mol。
(1)写出下列物理量的单位:物质的量
计算:
(2)标况下,11.2LNH3的物质的量是
(3)1mol
 中含有质子的物质的量为
中含有质子的物质的量为(4)100mL2mol/L的硫酸溶液溶质的物质的量为
您最近一年使用:0次
名校
解题方法
3 . 叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。
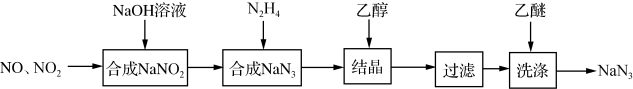
(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式___ ,生成1molNaNO2时转移电子___ mol。
(2)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3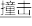 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的氧化剂为___ ,还原剂为___ (填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___ ?(写出计算过程,保留一位小数,不考虑固体的体积)。

(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式
(2)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3
 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。①该反应中的氧化剂为
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克
您最近一年使用:0次
解题方法
4 . (1)质量为8gCH4气体分子数目为_______ ,在标准状况下的体积为_______ L;
(2)0.1mol某物质的质量为10.6g,则该物质的摩尔质量是_______ ;
(3)将53 g Na2CO3固体溶于水配成100 mL溶液,其密度为1.06g·mL-1,则该溶液中Na2CO3的物质的量浓度为_______ ,该溶液中Na2CO3的质量分数约为_______ 。
(4)10.8gAl与100mLNaOH溶液恰好完全反应,溶液体积变化忽略不计,则该NaOH溶液的物质的量浓度为_______ ,产生的H2在标准状况下的体积为_______
(2)0.1mol某物质的质量为10.6g,则该物质的摩尔质量是
(3)将53 g Na2CO3固体溶于水配成100 mL溶液,其密度为1.06g·mL-1,则该溶液中Na2CO3的物质的量浓度为
(4)10.8gAl与100mLNaOH溶液恰好完全反应,溶液体积变化忽略不计,则该NaOH溶液的物质的量浓度为
您最近一年使用:0次
5 . (1)若t=25℃时,Kw=___________ ,若t=100℃时,Kw=1.0×10-12,则100℃时0.05 mol•L-1 Ba(OH)2 溶液的pH=___________ 。
(2)已知25℃时,0.1 L 0.1 mol•L-1的Na2A溶液的pH=11,用离子方程式表示其原因为___________ 。
(3)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH___________ NaOH溶液的pH(填“>”“=”或“<”) 。
(4)室温下,pH=2的H2SO4溶液、pH=12的NaOH溶液、pH=12的Na2CO3溶液,水电离出的c(H+)之比为___________ 。
(5)相同物质的量浓度的①NH4HSO4、②NH4HCO3、③NH4Cl三种溶液,pH值从大到小的顺序为___________ (用数字标号填空,下同);相同温度下,NH 浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为
浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为___________ 。
(6)含有Cr2O 的废水毒性较大。某工厂酸性废水中含5.0×10-3 mol•L-1的Cr2O
的废水毒性较大。某工厂酸性废水中含5.0×10-3 mol•L-1的Cr2O ,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。
,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。
①写出加入绿矾的离子方程式___________ 。
②若处理后的废水中残留的c(Fe3+)=4.0×10-13 mol•L-1,则残留的Cr3+的浓度为___________ mol•L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-33)。
(2)已知25℃时,0.1 L 0.1 mol•L-1的Na2A溶液的pH=11,用离子方程式表示其原因为
(3)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH
(4)室温下,pH=2的H2SO4溶液、pH=12的NaOH溶液、pH=12的Na2CO3溶液,水电离出的c(H+)之比为
(5)相同物质的量浓度的①NH4HSO4、②NH4HCO3、③NH4Cl三种溶液,pH值从大到小的顺序为
 浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为
浓度相等的上述三种溶液,物质的量浓度从大到小的顺序为(6)含有Cr2O
 的废水毒性较大。某工厂酸性废水中含5.0×10-3 mol•L-1的Cr2O
的废水毒性较大。某工厂酸性废水中含5.0×10-3 mol•L-1的Cr2O ,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。
,可先向废水中加入绿矾(FeSO4·7H2O),搅拌后撒入生石灰处理。①写出加入绿矾的离子方程式
②若处理后的废水中残留的c(Fe3+)=4.0×10-13 mol•L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
6 . (1)在标准状况下,H2和C2H4的混合气体共11.2L,质量为3.6g,则两种气体的物质的量之和为________ mol,其中H2为________ mol,C2H4占总体积的________ ,混合气体的摩尔质量为________ 。
(2)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是____________ 。
(3)标准状况下,1.6g某气态氧化物RO2的体积为0.56L。该气体的摩尔质量是____________ 。
(4)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl−完全沉淀。原混合溶液中的K+的物质的量浓度为___________________ mol·L−1。
(2)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是
(3)标准状况下,1.6g某气态氧化物RO2的体积为0.56L。该气体的摩尔质量是
(4)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl−完全沉淀。原混合溶液中的K+的物质的量浓度为
您最近一年使用:0次
7 . (1)有以下10种物质:①铜 ②稀硫酸 ③氯化氢 ④氨气 ⑤空气 ⑥二氧化碳 ⑦金属汞(俗称水银) ⑧氯化钠 ⑨硫酸钡 ⑩氯气
按照表中提示的信息,把符合左栏条件的物质序号填入右栏相应的位置。
(2)将5.6 g铁放入足量的稀盐酸中充分反应,得到100 mL密度为1.27 g/mL的溶液,试回答:
①写出反应的离子方程式____________ 。
②所得溶液中生成物的物质的量浓度为__________ ,质量分数为____________ 。
③生成的气体在标准状况下的体积为____________ 。
按照表中提示的信息,把符合左栏条件的物质序号填入右栏相应的位置。
| 序号 | 符合条件 | 物质序号 |
| Ⅰ | 混合物 | |
| Ⅱ | 电解质,但熔融状态下并不导电 | |
| Ⅲ | 电解质,但难溶于水 | |
| Ⅳ | 非电解质 | |
| Ⅴ | 纯净物,既不是电解质,也不是非电解质,但本身能导电 |
①写出反应的离子方程式
②所得溶液中生成物的物质的量浓度为
③生成的气体在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
8 . 常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1 mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ /mol)。下表是一些键能数据(kJ /mol):
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围为_______ <C-Br键能<_______ 。
(2)热化学方程式2H2(g)+S2(g)=2H2S(g)△H=Q kJ·mol-1;则Q=___________ 。
(3)已知下列热化学方程式:
O2(g)=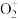 (g)+e- ΔH1=+1175.7 kJ·mol-1
(g)+e- ΔH1=+1175.7 kJ·mol-1
PtF6(g)+e-=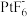 (g) ΔH2=-771.1kJ·mol-1
(g) ΔH2=-771.1kJ·mol-1
 (s)=
(s)=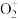 (g)+
(g)+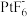 (g) ΔH3=+482.2kJ·mol-1
(g) ΔH3=+482.2kJ·mol-1
则反应O2(g)+_______ (g)= (s) ΔH=
(s) ΔH=_______ 。
(4)实验测得25℃、101kPa时5gCH3CH3完全燃烧恢复至常温时共放出393.5 kJ的热量,则CH3CH3燃烧热的热化学方程式为___________________________________________ 。
(5)2.4g碳在4.8gO2中燃烧至反应物耗尽,放出XkJ的热量。已知单质碳的燃烧热为YkJ/mol。试写出碳与氧气反应生成CO的热化学反应方程式_____________________________ 。
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
(1)由表中数据规律预测C-Br键的键能范围为
(2)热化学方程式2H2(g)+S2(g)=2H2S(g)△H=Q kJ·mol-1;则Q=
(3)已知下列热化学方程式:
O2(g)=
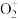 (g)+e- ΔH1=+1175.7 kJ·mol-1
(g)+e- ΔH1=+1175.7 kJ·mol-1PtF6(g)+e-=
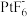 (g) ΔH2=-771.1kJ·mol-1
(g) ΔH2=-771.1kJ·mol-1 (s)=
(s)=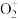 (g)+
(g)+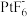 (g) ΔH3=+482.2kJ·mol-1
(g) ΔH3=+482.2kJ·mol-1则反应O2(g)+
 (s) ΔH=
(s) ΔH=(4)实验测得25℃、101kPa时5gCH3CH3完全燃烧恢复至常温时共放出393.5 kJ的热量,则CH3CH3燃烧热的热化学方程式为
(5)2.4g碳在4.8gO2中燃烧至反应物耗尽,放出XkJ的热量。已知单质碳的燃烧热为YkJ/mol。试写出碳与氧气反应生成CO的热化学反应方程式
您最近一年使用:0次
9 . 按要求书写热化学方程式:
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________________
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+ O2(g)=H2O(l)ΔH3=-285.8kJ/mol
O2(g)=H2O(l)ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式________________
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+
 O2(g)=H2O(l)ΔH3=-285.8kJ/mol
O2(g)=H2O(l)ΔH3=-285.8kJ/mol写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
您最近一年使用:0次
2020-09-21更新
|
349次组卷
|
4卷引用:四川省眉山市仁寿第二中学2020-2021学年高二上学期10月月考理综化学试题
10 . 某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)
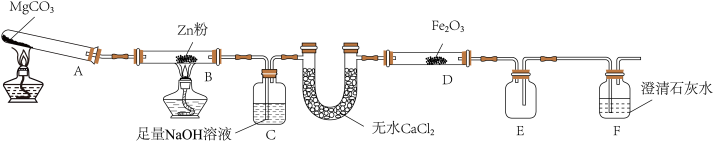
(1)图中盛无水CaCl2的仪器名称为______ 装置B中的化学反应方程式为_______ 。
(2)装置C中发生反应的离子方程式为_________ ,处理尾气的方法为________ 。
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
①乙组得到的黑色粉末成分是________ 。
②根据甲组实验现象写出甲组步骤1中反应的离子方式__________ 。
③乙组步骤4中,溶液变红的原因为________ ,溶液褪色可能的原因________ 及其验证方法为________ 。

(1)图中盛无水CaCl2的仪器名称为
(2)装置C中发生反应的离子方程式为
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末成分是
②根据甲组实验现象写出甲组步骤1中反应的离子方式
③乙组步骤4中,溶液变红的原因为
您最近一年使用:0次



