解题方法
1 . 用 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
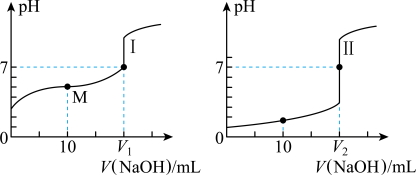
(1)用 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为______ (选填“酚酞”、“甲基橙”或“石蕊”),符合其滴定曲线的是______ (选填“Ⅰ”或“Ⅱ”)。
(2) 盐酸中,由水电离出的
盐酸中,由水电离出的
______  。
。
(3)图中 和
和 大小的比较:
大小的比较:
______ (选填“<”或“=”或“>”) 。
。
(4)在 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和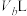 该
该 溶液。
溶液。
①若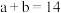 ,则
,则
______ (填数字)。
②若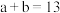 ,则
,则
______ (填数字)。
 溶液滴定体积均为
溶液滴定体积均为 、浓度均为
、浓度均为 盐酸和醋酸溶液得到如图所示的滴定曲线:
盐酸和醋酸溶液得到如图所示的滴定曲线:
(1)用
 溶液滴定醋酸溶液通常所选择的指示剂为
溶液滴定醋酸溶液通常所选择的指示剂为(2)
 盐酸中,由水电离出的
盐酸中,由水电离出的
 。
。(3)图中
 和
和 大小的比较:
大小的比较:
 。
。(4)在
 时,有
时,有 为
为 的盐酸和
的盐酸和 为
为 的
的 溶液,
溶液, 该盐酸恰好中和
该盐酸恰好中和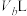 该
该 溶液。
溶液。①若
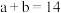 ,则
,则
②若
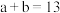 ,则
,则
您最近一年使用:0次
2 . 正常体温下,人体动脉血液的 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下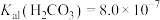 ,
,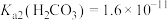 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。
(1)正常体温下,若某人动脉血 为
为 ,则属于
,则属于______ 中毒(选填“酸”或“碱”),他的血液中
______ 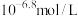 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(2)已知: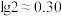 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中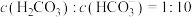 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。_____________________
 在
在 之间,之所以能够控制在该范围内,主要是因为血液中
之间,之所以能够控制在该范围内,主要是因为血液中 分子与
分子与 共存形成“缓冲溶液”[正常体温下
共存形成“缓冲溶液”[正常体温下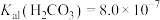 ,
,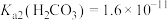 ],若血液
],若血液 超出正常范围,则可能导致酸中毒或碱中毒。
超出正常范围,则可能导致酸中毒或碱中毒。(1)正常体温下,若某人动脉血
 为
为 ,则属于
,则属于
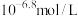 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。(2)已知:
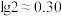 。正常体温下,某人动脉血液中
。正常体温下,某人动脉血液中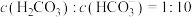 ,试通过计算判断属于酸中毒或碱中毒。
,试通过计算判断属于酸中毒或碱中毒。
您最近一年使用:0次
名校
3 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
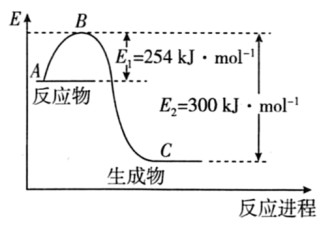
(1)如图是 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶___________
(2)若已知下列数据∶
试根据表中及图中数据计算N-H的键能∶___________ kJ·mol-1
(3)用 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知:
 ①
①
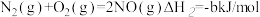 ②
②
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3___________ kJ/mol(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应I: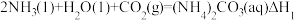
反应II: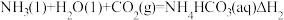
反应Ⅲ: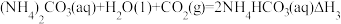
则△H3与△H1、△H2之间的关系是△H3=___________ 。
(1)如图是
 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶
(2)若已知下列数据∶
| 化学键 | H-H | N=N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能∶
(3)用
 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知: ①
①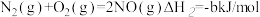 ②
②若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3(4)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应I:
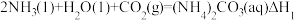
反应II:
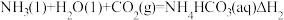
反应Ⅲ:
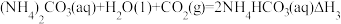
则△H3与△H1、△H2之间的关系是△H3=
您最近一年使用:0次
2021-06-20更新
|
1309次组卷
|
7卷引用:四川省攀枝花市成都外国语学校2021-2022学年高二上学期10月月考化学试题
四川省攀枝花市成都外国语学校2021-2022学年高二上学期10月月考化学试题四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
名校
解题方法
4 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______ (填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
计算可得:2H2(g)+ O2(g) =2H2O(g) ∆H=____________ kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+ O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________ 。
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________ (填序号)。
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体
(1)下列反应中,属于吸热反应的是
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
| 化学键种类 | H—H | O=O | O—H |
| 键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) ∆H=
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+
 O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体
您最近一年使用:0次
5 . 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)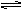 C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
(1)该温度下,该反应的化学平衡常数K=________________ 。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________ ,通过计算说明此时,该反应是否达到了平衡状态__________ ?
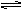 C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是
您最近一年使用:0次
名校
解题方法
6 . 将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经过5 min反应,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,试求:
(1)x的值是________ ;
(2)A在5 min时的浓度是___ ;
(3)5 min 内B的平均反应速率是_____ ;
(4)A转化率是____ ;
(5)容器内在5 min时与开始时的压强比为_____________ 。
(1)x的值是
(2)A在5 min时的浓度是
(3)5 min 内B的平均反应速率是
(4)A转化率是
(5)容器内在5 min时与开始时的压强比为
您最近一年使用:0次
名校
解题方法
7 . 按要求回答下列问题:
(1)N2与O2生成NO的过程如下:

则:N2(g)+O2(g)=2NO(g) ΔH=______________ kJ/mol
(2) 已知:甲烷的燃烧热ΔH=-890 kJ/mol,则甲烷完全燃烧的热化学方程式可表示为________________ 。
(3)已知:1 mol水蒸气变成液态水放热44 kJ,结合本题(1)、(2)信息,推知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=________ kJ/mol
(1)N2与O2生成NO的过程如下:

则:N2(g)+O2(g)=2NO(g) ΔH=
(2) 已知:甲烷的燃烧热ΔH=-890 kJ/mol,则甲烷完全燃烧的热化学方程式可表示为
(3)已知:1 mol水蒸气变成液态水放热44 kJ,结合本题(1)、(2)信息,推知:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=
您最近一年使用:0次
名校
解题方法
8 . 向Fe和Fe2O3组成的3.84 g 混合物中加入120 mL某浓度的盐酸,恰好完全反应,生成672mLH2(标准状况下),若向反应后的溶液中滴入几滴KSCN溶液,溶液不呈红色。试求:
(1)原混合物中Fe2O3和Fe的质量分别为_______ 、________ ;
(2)原盐酸的物质的量浓度为___________ 。
(1)原混合物中Fe2O3和Fe的质量分别为
(2)原盐酸的物质的量浓度为
您最近一年使用:0次
2020-06-10更新
|
209次组卷
|
2卷引用:四川省攀枝花市第十五中学2019-2020学年高一下学期第二次月考化学试题
名校
解题方法
9 . 甲、乙、丙各取300mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
求:(1)盐酸的物质的量浓度是多少___ ?
(2)合金中镁铝的质量分数各是多少___ 、___ ?
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 765 | 918 |
| (标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少
(2)合金中镁铝的质量分数各是多少
您最近一年使用:0次
2020-04-27更新
|
90次组卷
|
3卷引用:四川省攀枝花市2019-2020学年高一上学期教学质量监测化学试题
10 . 将28.8g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为___ L,NO2的体积为___ L;
(2)待产生的气体全部释放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___ mol·L-1。
(1)NO的体积为
(2)待产生的气体全部释放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为
您最近一年使用:0次
2020-04-14更新
|
450次组卷
|
2卷引用:四川省攀枝花市第十五中学2019-2020学年高一下学期期中考试化学试题



