名校
解题方法
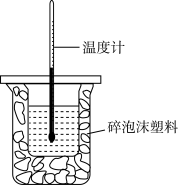
1 . Ⅰ、某实验小组用100mL0.55mol·L NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
(1)回答下列问题:
①图中装置缺少的仪器是___________ 。
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1___________ ΔH (填写<、>、=);若测得该反应放出的热量为2.84kJ,请写出盐酸与NaOH溶液反应的中和热的热化学方程式:___________
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为___________ 。
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

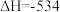 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:___________ 。
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为___________ kJ·mol 。
。
 NaOH溶液与100mL0.5mol·L
NaOH溶液与100mL0.5mol·L 盐酸进行中和热的测定,装置如图所示。
盐酸进行中和热的测定,装置如图所示。
(1)回答下列问题:
①图中装置缺少的仪器是
②若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
Ⅱ、已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(2)写出表示甲烷燃烧热的热化学方程式为
Ⅲ、发射卫星可用肼做燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。已知:

 kJ·mol
kJ·mol

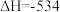 kJ·mol
kJ·mol
(3)写出肼和二氧化氮反应的热化学方程式为:
(4)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol
 ,O=O键能为498kJ·mol
,O=O键能为498kJ·mol ,计算H-H键能为
,计算H-H键能为 。
。
您最近一年使用:0次
2023-01-08更新
|
350次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2022-2023学年高二下学期开学考试化学试题
2 . 回答下列问题:
(1)3.6 g H2O的物质的量是_______ ,含有水分子的数目是_______ ,含有氢原子的物质的量是_______ 。
(2)1.5molCO2和_______ g CH4在标准状况下占有相同的体积,其体积为_______ 。
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量_______ 。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为_______ mol;一个X原子的质量为_______ g;该气体在标准状况下的体积为_______ L。
(5)200 mL Al2(SO4)3溶液中含Al3+ 5.4 g,则溶液中c(SO )=
)=_______ 。
(6)标准状况下,将V L HCl溶解在1 L水中(水的密度近似为1g/cm3),所得溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则c=_______ 。(用含V、ρ的式子表示)
(1)3.6 g H2O的物质的量是
(2)1.5molCO2和
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为
(5)200 mL Al2(SO4)3溶液中含Al3+ 5.4 g,则溶液中c(SO
 )=
)=(6)标准状况下,将V L HCl溶解在1 L水中(水的密度近似为1g/cm3),所得溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则c=
您最近一年使用:0次
3 . 计算
(1)3.01×1023个H2O的物质的量为_______ mol,其中,所含原子的物质的量为_______ mol,所含电子的物质的量为_______ mol。
(2)_______ g H2O中的氧原子数目与标准状况下22.4 LCO2中的氧原子数目相同。
(3)2g NaOH溶于水配制成_______ mL溶液时其物质的量浓度为2mol/L。
(4)在相同的条件下,等质量的N2、CO2、NH3的体积由大到小的顺序为_______ ,在相同条件下,等体积的N2、CO2、NH3的质量由大到小的顺序为_______ ,在相同条件下,等体积的N2、CO2、NH3密度由大到小的顺序为_______ 。
(5)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为_______
(6)电解1.8 g H2O所得的H2在标准状况下的体积为_______
(1)3.01×1023个H2O的物质的量为
(2)
(3)2g NaOH溶于水配制成
(4)在相同的条件下,等质量的N2、CO2、NH3的体积由大到小的顺序为
(5)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为
(6)电解1.8 g H2O所得的H2在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
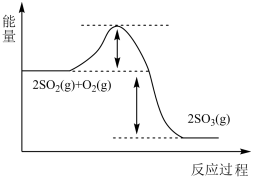
4 . 工业制备硫酸的主要反应之一为SO2与O2反应生成SO3。请回答下列问题:
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为_______ (填“放热”或“吸热”)反应。
(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。
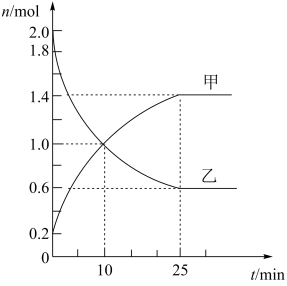
①甲为_______ (填化学式,下同),乙为_______ 。
②SO2与O2反应生成SO3的反应是_______ (填“可逆”或“不可逆”)反应。
③10 min时,v正(SO2)_______ (填“>”“<”或“=”)v逆(SO2)。
④从反应开始到平衡,反应速率v(SO3)_______ mol·L-1·min-1。
⑤反应达到平衡时,SO2的转化率为_______ 。
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为

(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。

①甲为
②SO2与O2反应生成SO3的反应是
③10 min时,v正(SO2)
④从反应开始到平衡,反应速率v(SO3)
⑤反应达到平衡时,SO2的转化率为
您最近一年使用:0次
解题方法
5 . 按要求完成下列各题
(1)49gH2SO4中含有氧原子的物质的量为_______ ;
(2)标准状况下,0.2molNH3的体积是__________ ;
(3)在25gCuSO4·5H2O中:含有的Cu2+的数目是_________ ;含有的 的质量是
的质量是________ ;
(4)用14.2gNa2SO4配制成500mL溶液,其物质的量浓度为______ ,若从中取出10mL,含溶质质量为______ 。
(1)49gH2SO4中含有氧原子的物质的量为
(2)标准状况下,0.2molNH3的体积是
(3)在25gCuSO4·5H2O中:含有的Cu2+的数目是
 的质量是
的质量是(4)用14.2gNa2SO4配制成500mL溶液,其物质的量浓度为
您最近一年使用:0次
名校
6 . 合成氨工业中,每生产2molNH3,放出92.4kJ热量。
(1)写出合成氨反应的热化学方程式为_______________ 。
(2)已知:

1mol N-H键断裂吸收的能量等于______ kJ。
(3)已知关于铁的氧化物存在下列三个热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
Fe2O3(s)+ CO(g)=
CO(g)=  Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH=-15.73 kJ/mol ②
CO2(g) ΔH=-15.73 kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol ③
则CO还原FeO的热化学方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=________ kJ/mol。
(1)写出合成氨反应的热化学方程式为
(2)已知:

1mol N-H键断裂吸收的能量等于
(3)已知关于铁的氧化物存在下列三个热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
Fe2O3(s)+
 CO(g)=
CO(g)=  Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH=-15.73 kJ/mol ②
CO2(g) ΔH=-15.73 kJ/mol ② Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol ③
则CO还原FeO的热化学方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=
您最近一年使用:0次
解题方法
7 . 已知标准状况下CH4的体积为4.48L,该气体的物质的量为___________ ,分子数为___________ , 原子数约为___________ ,质子数为___________ ,电子数为___________ ,摩尔质量为___________ ,质量为___________ 。
您最近一年使用:0次
名校
8 . (1)相同质量的氢气、甲烷(CH4)、水,其中含分子数最多的是________ ;等物质的量的三种物质含氢原子最多的是________ 。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g该氧化物的体积为448 mL,则该氧化物的物质的量为______ ,该氧化物的摩尔质量为______ 。
(3)某化学兴趣小组对某品牌矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,Mg2+的物质的量浓度为______ 。
(4)现有0.1 mol·L-1 Na2SO4和0.3 mol·L-1 H2SO4的混合溶液100 mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
①当加入50 mL Ba(OH)2溶液时,所得溶液中SO42-离子的物质的量浓度为________ mol·L-1。
②当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为________ mL。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g该氧化物的体积为448 mL,则该氧化物的物质的量为
(3)某化学兴趣小组对某品牌矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,Mg2+的物质的量浓度为
(4)现有0.1 mol·L-1 Na2SO4和0.3 mol·L-1 H2SO4的混合溶液100 mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
①当加入50 mL Ba(OH)2溶液时,所得溶液中SO42-离子的物质的量浓度为
②当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为
您最近一年使用:0次
名校
9 . 铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___ 族,基态钴原子中未成对电子的个数为_____ 。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___ ;尿素分子中氮原子的杂化方式是___ ,尿素中所含非金属元素的电负性由大到小的顺序是___ 。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____ 。
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____ 堆积,其配位数是_____ ;一个晶胞中平均含有的π键的个数为_____ 。

图1
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____ 。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______ ,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____ pm(阿伏伽德罗常数的值用NA表示,写出计算式即可)。

图2
(1)钴位于元素周期表中第
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于

图1
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为

图2
您最近一年使用:0次
2019-05-07更新
|
767次组卷
|
4卷引用:四川省宜宾市叙州区第二中学2020届高三下学期第二次高考适应性考试理综化学试题
名校
10 . 能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是______ (填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
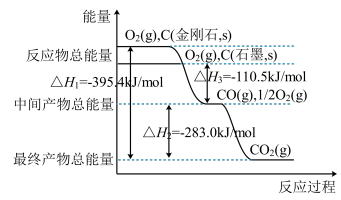
由上图可知,在通常状况下,金刚石和石墨中___ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__ kJ·mol−1
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol−1、497 kJ·mol−1,N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol−1。NO分子中化学键的键能为_____ kJ·mol−1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:________ 。
(1)下列做法有助于能源“开源节流”的是
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
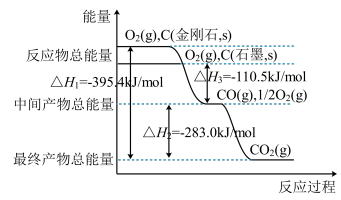
由上图可知,在通常状况下,金刚石和石墨中
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol−1、497 kJ·mol−1,N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol−1。NO分子中化学键的键能为
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:
您最近一年使用:0次
2019-05-05更新
|
717次组卷
|
3卷引用:四川省宜宾市第四中学2018-2019学年高二下学期期中考试化学试题



