名校
1 . 分析下列有机物的结构简式,并填空

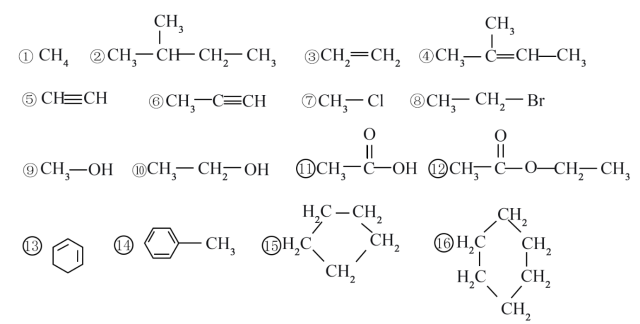
(1)上述有机化合物根据分子中碳骨架的形状可分为______ 。
(2)有机物⑫官能团名称为______ 。
(3)有机物④的系统命名为______ 。
(4)上述有机物互为同系物的有______ 组。
(5)上述有机物核磁共振氢谱只有一组吸收峰的有______ 组。
(6)写出⑬与等物质的量Br2加成产物______ 。


(1)上述有机化合物根据分子中碳骨架的形状可分为
(2)有机物⑫官能团名称为
(3)有机物④的系统命名为
(4)上述有机物互为同系物的有
(5)上述有机物核磁共振氢谱只有一组吸收峰的有
(6)写出⑬与等物质的量Br2加成产物
您最近一年使用:0次
2 . 已知: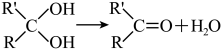
芳香烃A能发生下面一系列化学反应。
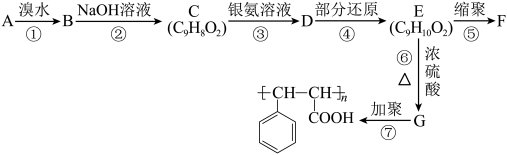
请回答下列问题:
(1)写出G的结构简式______ 。
(2)写出下列反应的反应类型:①______ ;②______
(3)按要求回答下列问题
①A→B的化学方程式为______ 。
②C与银氨溶液反应的化学方程式为______ 。
③2分子E在浓硫酸作用下生成环状化合物的结构简式为______ 。
(4)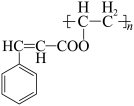 可用于制造电路,其单体可以通过G与
可用于制造电路,其单体可以通过G与______ 发生加成反应制得。

芳香烃A能发生下面一系列化学反应。

请回答下列问题:
(1)写出G的结构简式
(2)写出下列反应的反应类型:①
(3)按要求回答下列问题
①A→B的化学方程式为
②C与银氨溶液反应的化学方程式为
③2分子E在浓硫酸作用下生成环状化合物的结构简式为
(4)
 可用于制造电路,其单体可以通过G与
可用于制造电路,其单体可以通过G与
您最近一年使用:0次
名校
3 . 1928年,狄尔斯和阿尔德在研究1,3-丁二烯的性质时发现如下反应:
 (也可表示为:
(也可表示为: )
)
回答下列问题:
(1)下列具有类似1,3-丁二烯性质的有机物是______ 。
a. b.
b. c.
c. d.
d.
(2)工业上通常以甲醛、乙炔为原料制取1,3-丁二烯,生产流程如下:
 HOCH2C≡CCH2OH
HOCH2C≡CCH2OH X
X CH2=CHCH=CH2
CH2=CHCH=CH2
上述流程中甲醛和乙炔的反应类型是______ ;X的结构简式为______ 。
(3)以CH2=CHCH=CH2、X和HOCH2C≡CCH2OH为原料,合成高分子化合物M的路线如下:(已知:羧酸在醇溶液中几乎不和NaOH反应)

①设置反应a、b的目的是:______ ;
②写出B→C的化学方程式:______ ;
③写出高分子化合物M的结构简式______ 。
(4)已知:
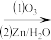
 +CH3CH2CHO
+CH3CH2CHO
则F在 条件下发生反应,所得产物的结构简式为
条件下发生反应,所得产物的结构简式为______ 。
 (也可表示为:
(也可表示为: )
)回答下列问题:
(1)下列具有类似1,3-丁二烯性质的有机物是
a.
 b.
b. c.
c. d.
d.
(2)工业上通常以甲醛、乙炔为原料制取1,3-丁二烯,生产流程如下:
 HOCH2C≡CCH2OH
HOCH2C≡CCH2OH X
X CH2=CHCH=CH2
CH2=CHCH=CH2上述流程中甲醛和乙炔的反应类型是
(3)以CH2=CHCH=CH2、X和HOCH2C≡CCH2OH为原料,合成高分子化合物M的路线如下:(已知:羧酸在醇溶液中几乎不和NaOH反应)

①设置反应a、b的目的是:
②写出B→C的化学方程式:
③写出高分子化合物M的结构简式
(4)已知:

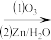
 +CH3CH2CHO
+CH3CH2CHO则F在
 条件下发生反应,所得产物的结构简式为
条件下发生反应,所得产物的结构简式为
您最近一年使用:0次
4 . M是一种无毒的聚酯纤维,可用作毛级玩真的内充物。工业上常以有机物A和乙二醇为原料在一定条件下合成高分子化合物M。有机物A的结构、性质如下:
①16.6gA完全燃烧,可产生0.8molCO2和0.3molH2O。
②A的相对分子质量在100-200之间,分子中含有一个苯环,苯环上有两个互为对位的取代基。
③1molA可与足量NaHCO3溶液反应,放出2molCO2气体。
请回答:
(1)A的结构简式是_______ 。
(2)等质量的钠分别与足量的A和乙二醇反应生成气体的体积比为_______ 。
(3)合成M的反应的化学方程式和反应类型是_______ ;_______ 反应。
(4)A有多种同分异构体,其中既能与NaHCO3溶液反应放出CO2气体,又能发生银镜反应和水解反应,且分子内含有苯环,请写出一种符合要求的物质的结构简式_______ 。
①16.6gA完全燃烧,可产生0.8molCO2和0.3molH2O。
②A的相对分子质量在100-200之间,分子中含有一个苯环,苯环上有两个互为对位的取代基。
③1molA可与足量NaHCO3溶液反应,放出2molCO2气体。
请回答:
(1)A的结构简式是
(2)等质量的钠分别与足量的A和乙二醇反应生成气体的体积比为
(3)合成M的反应的化学方程式和反应类型是
(4)A有多种同分异构体,其中既能与NaHCO3溶液反应放出CO2气体,又能发生银镜反应和水解反应,且分子内含有苯环,请写出一种符合要求的物质的结构简式
您最近一年使用:0次
名校
5 . 利用丙烯合成双酚A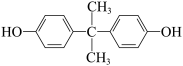 的流程如下图所示,C的核磁共振氢谱只有一种峰,D遇浓溴水出现白色沉淀。下列说法不正确的是
的流程如下图所示,C的核磁共振氢谱只有一种峰,D遇浓溴水出现白色沉淀。下列说法不正确的是
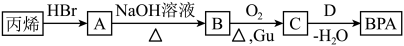
| A.双酚A的分子式为C15H16O2 |
| B.有机物A的名称为2-溴乙烷 |
| C.由C生成双酚A的过程是加成反应 |
| D.控制不同条件,C与D可能生成聚合物 |
您最近一年使用:0次
6 . 现通过以下具体步骤由 制取
制取 ,下列说法正确的是
,下列说法正确的是

| A.有机物N的核磁共振氢谱吸收峰数量为2 |
| B.反应①的条件是光照 |
| C.B和C都可以与氢气反应,但反应比例不同 |
| D.②④⑥的反应类型相同,①③⑤的反应类型相同 |
您最近一年使用:0次
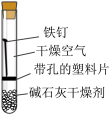
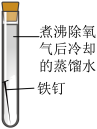
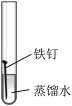
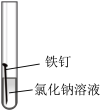
7 . 某小组同学对不同条件下铁钉的锈蚀进行了实验。
(1)一周后观察,铁钉被腐蚀程度最大的是___________ (填实验序号)。
(2)实验小组将实验④中氯化钠溶液分别替换为pH=2和pH=4的盐酸溶液。在密闭容器中,分别用压强传感器记录实验过程中的压强变化,如图所示。___________ (填字母,下同)。
a.两容器中负极反应均为Fe-2e⁻=Fe2+
b.曲线a记录的是pH=2的盐酸中压强的变化
c.在弱酸性溶液中,铁钉能发生吸氧腐蚀
d.曲线b记录的容器中正极反应是O2+4e⁻+2H2O=4OH⁻
(3)电化学原理在保护海水中钢闸门中有广泛应用。______ 。
a.牺牲阳极法 b.外加电流法
②为了减缓海水对钢闸门A的腐蚀,图1中材料B可以选择______ 。
a.碳棒 b.锌板 c.铜板
③图2中,钢闸门C应连接直流电源的___________ (填“正”或“负”)极。
| 序号 | ① | ② | ③ | ④ |
| 实验 |
|
|
|
|
(1)一周后观察,铁钉被腐蚀程度最大的是
(2)实验小组将实验④中氯化钠溶液分别替换为pH=2和pH=4的盐酸溶液。在密闭容器中,分别用压强传感器记录实验过程中的压强变化,如图所示。

a.两容器中负极反应均为Fe-2e⁻=Fe2+
b.曲线a记录的是pH=2的盐酸中压强的变化
c.在弱酸性溶液中,铁钉能发生吸氧腐蚀
d.曲线b记录的容器中正极反应是O2+4e⁻+2H2O=4OH⁻
(3)电化学原理在保护海水中钢闸门中有广泛应用。
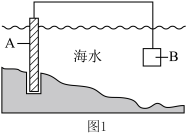
a.牺牲阳极法 b.外加电流法
②为了减缓海水对钢闸门A的腐蚀,图1中材料B可以选择
a.碳棒 b.锌板 c.铜板
③图2中,钢闸门C应连接直流电源的
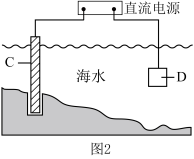
您最近一年使用:0次
2023-12-25更新
|
162次组卷
|
2卷引用:北京市第十五中学2022-2023学年高二上学期期中考试 化学试题
名校
8 . 下列物质① 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液
(1)属于非电解质的是:___________ ;属于强电解质的是:___________ ;属于弱电解质的是:___________ ;既不是电解质也不是非电解质,常温下能导电的物质是___________ (均填序号)。
(2)写出①的电离方程式___________ 。
(3)向⑦的溶液中滴加几滴浓盐酸,平衡___________ 移动(填“正向”、“逆向”或“不移动”),平衡时溶液中
___________ (填“增大”、“减小”或者“不变”),
___________ (填“增大”、“减小”或者“不变”)。
(4)将 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是___________ (结合有关离子方程式说明)。
(5)将标准状况下2.24L⑥缓慢通入 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系___________ 。
(6)将足量⑥缓慢通入 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度___________ 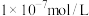 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH___________ (填“增大”、“减小”、或“不变”)。
 、 ②
、 ② 、③NaOH、④
、③NaOH、④ 、⑤
、⑤ 、⑥
、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨Fe、⑩氯化钠溶液
、⑨Fe、⑩氯化钠溶液(1)属于非电解质的是:
(2)写出①的电离方程式
(3)向⑦的溶液中滴加几滴浓盐酸,平衡


(4)将
 的①溶液和
的①溶液和 的③溶液等体积混合后溶液显酸性,原因是
的③溶液等体积混合后溶液显酸性,原因是(5)将标准状况下2.24L⑥缓慢通入
 的③的溶液中,气体被充分吸收,离子浓度大小关系
的③的溶液中,气体被充分吸收,离子浓度大小关系(6)将足量⑥缓慢通入
 的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度
的③的溶液中,所得溶液显碱性,则溶液中水电离出的氢氧根离子浓度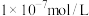 (填“大于”、“小于”、或“等于”),加水稀释后pH
(填“大于”、“小于”、或“等于”),加水稀释后pH
您最近一年使用:0次
名校
9 .  溶液在稀释过程中,溶液中逐渐增大的量是
溶液在稀释过程中,溶液中逐渐增大的量是
① ②
② ③pH ④
③pH ④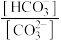
 溶液在稀释过程中,溶液中逐渐增大的量是
溶液在稀释过程中,溶液中逐渐增大的量是①
 ②
② ③pH ④
③pH ④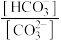
| A.①③ | B.①④ | C.②③ | D.②④ |
您最近一年使用:0次
2023-11-06更新
|
498次组卷
|
6卷引用:上海市上海中学2022-2023学年高二上学期期中考试化学试题
上海市上海中学2022-2023学年高二上学期期中考试化学试题【精品卷】3.3.2 影响盐类水解的主要因素课堂例题-人教版2023-2024学年选择性必修1(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河北省高碑店市崇德实验中学2023-2024学年高二上学期期中考试化学试题 上海市新中高级中学2023-2024学年高二下学期阶段检测化学试题 陕西省兴平市南郊高级中学2023-2024学年高二上学期第三次化学质量检测题
名校
解题方法
10 . Ⅰ.实验室用如图所示简易量热计进行中和热的测定实验,请回答。
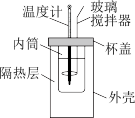
(1)简易量热计有利于减小误差的设计措施有_____ 、_____ 。
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式_____ 。
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①
②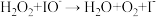
其反应过程的能量变化如图所示,回答下列问题:
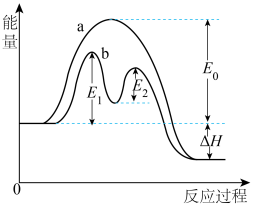
(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为_____ ,决定总反应速率的是第_____ 步基元反应,
(4)反应过程中I-和IO-的浓度变化趋势为_____。
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g) S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
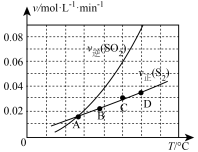
(5)A、B、C、D四点对应的状态中,达到平衡状态的有_____ (填字母)。
(6)该反应的△H_____ 0(填>、<或=)。
(7)下列措施能够增大SO2平衡转化率的是_____。

(1)简易量热计有利于减小误差的设计措施有
(2)分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行反应,经测定并计算得出该反应放出的热量为QkJ。写出其热化学方程式
Ⅱ.在I-存在下,H2O2分解的反应历程为:
①

②
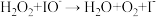
其反应过程的能量变化如图所示,回答下列问题:

(3)在I-存在下,H2O2分解过程的最大能垒(活化能)为
(4)反应过程中I-和IO-的浓度变化趋势为_____。
A.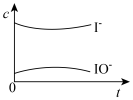 | B.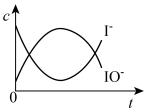 |
C.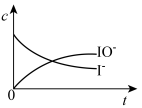 | D.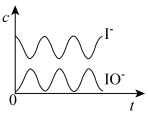 |
Ⅲ.向1L容器中加入1molSO2和足量焦炭,发生反应2C(s)+2SO2(g)
 S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
S2(g)+2CO2(g)。测得反应速率v正(S2)和v逆(SO2)随温度变化如图所示,请回答:
(5)A、B、C、D四点对应的状态中,达到平衡状态的有
(6)该反应的△H
(7)下列措施能够增大SO2平衡转化率的是_____。
| A.降温 | B.增加C(s)的量 | C.减小容器体积 | D.恒压通入一定量SO2 |
您最近一年使用:0次