名校
1 . 草酸亚铁晶体(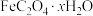 )为淡黄色粉末,是生产电池的原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。回答下列问题:
)为淡黄色粉末,是生产电池的原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。回答下列问题:
(1)实验室要配制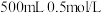 的
的 溶液,必须使用的玻璃仪器除烧杯、玻璃棒、量筒外,还有
溶液,必须使用的玻璃仪器除烧杯、玻璃棒、量筒外,还有_____ 。
(2)为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关 和
和 ,设为装置A)称重,记为
,设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
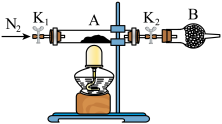
实验操作步骤为:打开 、
、 ,缓缓通入
,缓缓通入 →点燃酒精灯,小火加热→熄灭酒精灯→冷却至室温→停止通
→点燃酒精灯,小火加热→熄灭酒精灯→冷却至室温→停止通 ,关闭
,关闭 、
、 →称量A.重复上述操作步骤,直至A恒重,记为
→称量A.重复上述操作步骤,直至A恒重,记为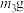 。
。
①仪器B的名称是_____ 。
②缓缓通入 目的是
目的是_____ 。
③根据实验记录,计算草酸亚铁晶体中结晶水数目
_____ 。
(3)为探究草酸亚铁的热分解产物,将实验(2)中已恒重的装置A接入下图所示装置进行实验。
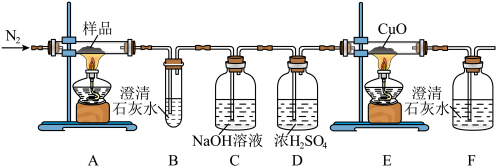
①停止实验时要先熄灭A、E两处酒精灯,再继续通 至玻璃管冷却到室温,目的是
至玻璃管冷却到室温,目的是_____ 。
②实验中观察到:A装置中剩余黑色固体,装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。经测定,A装置中样品完全分解,且黑色固体为铁的某种氧化物,为进一步确认,取少量的黑色固体,在稀硫酸溶液中充分溶解,得澄清溶液,向其中滴加KSCN溶液,无现象,再滴加氯水,溶液变红。
草酸亚铁受热分解的化学方程式为_____ 。
(4)氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取 草酸亚铁晶体溶于稀硫酸中,用
草酸亚铁晶体溶于稀硫酸中,用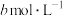 的高锰酸钾标准液滴定,滴定终点时消耗高锰酸钾
的高锰酸钾标准液滴定,滴定终点时消耗高锰酸钾 ,则
,则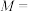
_____ 。(已知:部分反应产物为 、
、 、
、 )
)
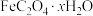 )为淡黄色粉末,是生产电池的原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。回答下列问题:
)为淡黄色粉末,是生产电池的原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。回答下列问题:(1)实验室要配制
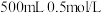 的
的 溶液,必须使用的玻璃仪器除烧杯、玻璃棒、量筒外,还有
溶液,必须使用的玻璃仪器除烧杯、玻璃棒、量筒外,还有(2)为测定草酸亚铁晶体中结晶水含量,将石英玻璃管(带两端开关
 和
和 ,设为装置A)称重,记为
,设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
实验操作步骤为:打开
 、
、 ,缓缓通入
,缓缓通入 →点燃酒精灯,小火加热→熄灭酒精灯→冷却至室温→停止通
→点燃酒精灯,小火加热→熄灭酒精灯→冷却至室温→停止通 ,关闭
,关闭 、
、 →称量A.重复上述操作步骤,直至A恒重,记为
→称量A.重复上述操作步骤,直至A恒重,记为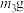 。
。①仪器B的名称是
②缓缓通入
 目的是
目的是③根据实验记录,计算草酸亚铁晶体中结晶水数目

(3)为探究草酸亚铁的热分解产物,将实验(2)中已恒重的装置A接入下图所示装置进行实验。

①停止实验时要先熄灭A、E两处酒精灯,再继续通
 至玻璃管冷却到室温,目的是
至玻璃管冷却到室温,目的是②实验中观察到:A装置中剩余黑色固体,装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。经测定,A装置中样品完全分解,且黑色固体为铁的某种氧化物,为进一步确认,取少量的黑色固体,在稀硫酸溶液中充分溶解,得澄清溶液,向其中滴加KSCN溶液,无现象,再滴加氯水,溶液变红。
草酸亚铁受热分解的化学方程式为
(4)氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取
 草酸亚铁晶体溶于稀硫酸中,用
草酸亚铁晶体溶于稀硫酸中,用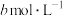 的高锰酸钾标准液滴定,滴定终点时消耗高锰酸钾
的高锰酸钾标准液滴定,滴定终点时消耗高锰酸钾 ,则
,则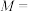
 、
、 、
、 )
)
您最近一年使用:0次
解题方法
2 . 某实验小组探究浅黄色草酸亚铁晶体( )分解产物的装置如图所示。
)分解产物的装置如图所示。

回答下列问题:
(1)仪器M的名称是_______ 。
(2)点燃酒精灯之前,先通入 ,其目的是
,其目的是_______ 。
(3)装置C的作用是_______ 。
(4)如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有_______ (填化学式)。
(5)在300℃、500℃下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
根据上述实验,实验①产生蓝色沉淀的离子方程式为_______ 。乙中的成分可能为_______ (填化学式)。
(6)测定草酸亚铁晶体( )纯度。准确称取W g样品于锥形瓶,加入适量的稀硫酸,用c
)纯度。准确称取W g样品于锥形瓶,加入适量的稀硫酸,用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液b mL。滴定反应:
溶液b mL。滴定反应: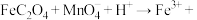
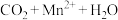 (未配平)。该样品纯度为
(未配平)。该样品纯度为_______ %。若滴定管没有用待装液润洗,测得结果_______ (填“偏高”、“偏低”或“无影响”)。
 )分解产物的装置如图所示。
)分解产物的装置如图所示。
回答下列问题:
(1)仪器M的名称是
(2)点燃酒精灯之前,先通入
 ,其目的是
,其目的是(3)装置C的作用是
(4)如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有
(5)在300℃、500℃下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
| 实验 | 实验操作及现象 |
| ① | 用强磁铁接近甲,无明显现象;将黑色粉末溶于稀硫酸,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
| ② | 用强磁铁接近乙,吸起部分粉末,将吸起来的粉末投入盐酸中,产生气泡;将剩余黑色粉末溶于稀硫酸,滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(6)测定草酸亚铁晶体(
 )纯度。准确称取W g样品于锥形瓶,加入适量的稀硫酸,用c
)纯度。准确称取W g样品于锥形瓶,加入适量的稀硫酸,用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液b mL。滴定反应:
溶液b mL。滴定反应: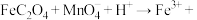
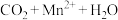 (未配平)。该样品纯度为
(未配平)。该样品纯度为
您最近一年使用:0次
名校
解题方法
3 . KI可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I:3I2+6KOH=KIO3+5KI+3H2O
反应Ⅱ:3H2S+KIO3=3S↓+KI+3H2O
(1)装置中盛装30%氢氧化钾溶液的仪器名称是___________ 。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液。待观察到三颈烧瓶中溶液颜色由棕黄色变为___________ (填现象),停止滴入KOH溶液;然后打开启普发生器活塞,待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是___________ 。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有单质硫和___________ (填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
(5)碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KIO3用于加碘盐中。实验室模拟工业制备KIO3流程如下:
①由上表数据分析可知,“操作a”为___________ 。
②反应Ⅰ中,两种还原产物得电子数相等,请写出发生的化学反应方程式___________ 。
(6)某同学测定上述流程生产的KIO3样品的纯度。
取1.00g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0mol·L-1Na2S2O3溶液,恰好完全反应时共消耗12.60mLNa2S2O3溶液。该样品中KIO3的质量分数为___________ (已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)。
反应I:3I2+6KOH=KIO3+5KI+3H2O
反应Ⅱ:3H2S+KIO3=3S↓+KI+3H2O

(1)装置中盛装30%氢氧化钾溶液的仪器名称是
(2)关闭启普发生器活塞,先滴入30%的KOH溶液。待观察到三颈烧瓶中溶液颜色由棕黄色变为
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有单质硫和
(5)碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KIO3用于加碘盐中。实验室模拟工业制备KIO3流程如下:
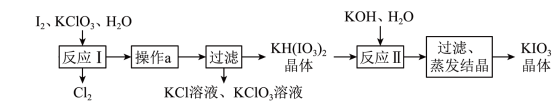
| KCl | KH(IO3)2 | KClO3 | |
| 25℃时的溶解度 | 20.8 | 0.8 | 7.5 |
| 80℃时的溶解度 | 37.1 | 12.4 | 16.2 |
②反应Ⅰ中,两种还原产物得电子数相等,请写出发生的化学反应方程式
(6)某同学测定上述流程生产的KIO3样品的纯度。
取1.00g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0mol·L-1Na2S2O3溶液,恰好完全反应时共消耗12.60mLNa2S2O3溶液。该样品中KIO3的质量分数为
您最近一年使用:0次
2023-08-28更新
|
246次组卷
|
3卷引用:辽宁省沈阳市第二中学2023-2024学年高三上学期开学暑假阶段验收化学测试题
解题方法
4 . 草酸(H2C2O4)及其盐类化合物在化学工业中有重要作用。请回答下列问题:
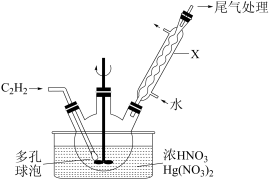
(1)实验室中可以在 用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如图所示。
用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如图所示。
 的电子式为
的电子式为_______ ;仪器X的名称为_______ ;装置中浓硝酸的还原产物为 ,生成草酸的化学方程式为
,生成草酸的化学方程式为_______ ,若反应温度高于 ,生成草酸的速率会减慢,主要原因是
,生成草酸的速率会减慢,主要原因是_______ 。
(2)三草酸合铁酸钾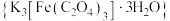 为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用
为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用 为原料制备三草酸合铁酸钾的步骤如下:
为原料制备三草酸合铁酸钾的步骤如下:
①称取 晶体,溶解,加硫酸酸化,边搅拌边加入
晶体,溶解,加硫酸酸化,边搅拌边加入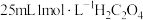 溶液,静置,析出黄色的
溶液,静置,析出黄色的 沉淀,过滤并洗涤沉淀
沉淀,过滤并洗涤沉淀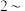 3次。
3次。
②将上述 沉淀溶解在
沉淀溶解在 饱和草酸钾溶液中,再加入
饱和草酸钾溶液中,再加入 饱和
饱和 溶液,保持溶液温度为
溶液,保持溶液温度为 ,缓慢滴加
,缓慢滴加 溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾
溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾 ,再加入
,再加入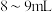 草酸溶液,控制
草酸溶液,控制 为
为 ,变为绿色透明的三草酸合铁酸钾溶液。
,变为绿色透明的三草酸合铁酸钾溶液。
③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体 次,干燥、称量。
次,干燥、称量。
其中生成 的化学方程式为
的化学方程式为_______ ;保持溶液温度为 所采用的加热方式是
所采用的加热方式是_______ ,加热至沸腾 的目的是
的目的是_______ ;洗涤晶体所用试剂为_______ 。
(3)制得的三草酸合铁酸钾晶体中往往会混有少量草酸。为测定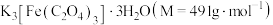 的纯度,进行如下实验:
的纯度,进行如下实验:
称取样品 ,加稀硫酸溶解后配成
,加稀硫酸溶解后配成 溶液。取
溶液。取 配制的溶液,用浓度为
配制的溶液,用浓度为 的
的 溶液滴定至终点时消耗
溶液滴定至终点时消耗 溶液
溶液 ,已知:
,已知: ,样品中
,样品中 的质量分数为
的质量分数为_______ (结果保留三位有效数字)。
(1)实验室中可以在
 用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如图所示。
用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如图所示。
 的电子式为
的电子式为 ,生成草酸的化学方程式为
,生成草酸的化学方程式为 ,生成草酸的速率会减慢,主要原因是
,生成草酸的速率会减慢,主要原因是(2)三草酸合铁酸钾
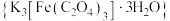 为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用
为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用 为原料制备三草酸合铁酸钾的步骤如下:
为原料制备三草酸合铁酸钾的步骤如下:①称取
 晶体,溶解,加硫酸酸化,边搅拌边加入
晶体,溶解,加硫酸酸化,边搅拌边加入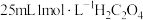 溶液,静置,析出黄色的
溶液,静置,析出黄色的 沉淀,过滤并洗涤沉淀
沉淀,过滤并洗涤沉淀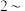 3次。
3次。②将上述
 沉淀溶解在
沉淀溶解在 饱和草酸钾溶液中,再加入
饱和草酸钾溶液中,再加入 饱和
饱和 溶液,保持溶液温度为
溶液,保持溶液温度为 ,缓慢滴加
,缓慢滴加 溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾
溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾 ,再加入
,再加入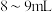 草酸溶液,控制
草酸溶液,控制 为
为 ,变为绿色透明的三草酸合铁酸钾溶液。
,变为绿色透明的三草酸合铁酸钾溶液。③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体
 次,干燥、称量。
次,干燥、称量。其中生成
 的化学方程式为
的化学方程式为 所采用的加热方式是
所采用的加热方式是 的目的是
的目的是(3)制得的三草酸合铁酸钾晶体中往往会混有少量草酸。为测定
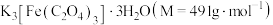 的纯度,进行如下实验:
的纯度,进行如下实验:称取样品
 ,加稀硫酸溶解后配成
,加稀硫酸溶解后配成 溶液。取
溶液。取 配制的溶液,用浓度为
配制的溶液,用浓度为 的
的 溶液滴定至终点时消耗
溶液滴定至终点时消耗 溶液
溶液 ,已知:
,已知: ,样品中
,样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2023-01-20更新
|
446次组卷
|
4卷引用:辽宁省六校协作体2023-2024学年高三上学期11月期中考试化学试题
名校
5 . 近年来,人们对微生物的氮转化进行了深入研究,将其归纳为如图1所示过程。请回答下列问题:
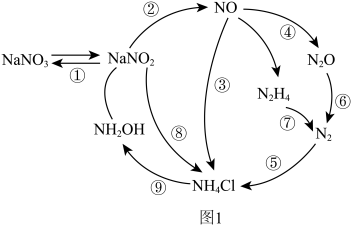
(1)N2的电子式为_____ ;羟胺(NH2OH)的结构式为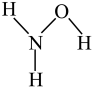 ,属于
,属于_____ (填“离子”或“共价”)化合物。
(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:_____ 。
(3)图1转化过程中具有固氮功能的是_____ (填标号)。
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。
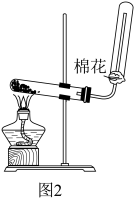
I.写出该反应的化学方程式:_____ 。
Ⅱ.棉花的作用为_____ 。
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。
I.请配平该离子方程式:_____ 。
Ⅱ.NaNO2的质量分数为_____ %。

(1)N2的电子式为
 ,属于
,属于(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:
(3)图1转化过程中具有固氮功能的是
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。

I.写出该反应的化学方程式:
Ⅱ.棉花的作用为
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO
 +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。I.请配平该离子方程式:
Ⅱ.NaNO2的质量分数为
您最近一年使用:0次
2023-04-18更新
|
406次组卷
|
3卷引用:辽宁省部分学校联考2022-2023学年高一下学期4月月考化学试题
6 . 叠氮化钠(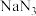 )常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入 。
。
④冷却,向产物中加入乙醇(降低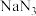 的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

已知:Ⅰ.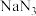 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
Ⅱ.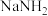 熔点210℃,沸点400℃,在水溶液中易水解。
熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)实验室若采用固体加热方式制取氨气的化学方程式为_______ 。
(2)步骤①中先加热通氨气的目的是_______ ;步骤②氨气与熔化的钠反应生成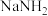 的化学方程式为
的化学方程式为_______ ;步骤③中最适宜的加热方式为_______ (填“水浴加热”,“油浴加热”)
(3)图中仪器a用的材料是铁质而不用玻璃,其主要原因是_______ 。
(4)汽车经撞击后30毫秒内,会引发叠氮化钠迅速分解为两种单质,其中氧化产物和还原产物的质量之比为_______ 。
(5)步骤④中用乙醚洗涤的主要原因除因其易挥发,有利于产品快速干燥外,还因为_______ 。
(6)实验室用滴定法测定叠氮化钠样品中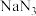 的质量分数:
的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL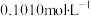
 溶液。
溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用 标准溶液滴定过量的
标准溶液滴定过量的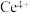 ,消耗溶液体29.00mL。测定过程的反应方程式为:
,消耗溶液体29.00mL。测定过程的反应方程式为: ;
; ;
;
试样中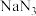 的质量分数为
的质量分数为_______ (保留小数点后一位)。
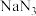 )常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入
 。
。④冷却,向产物中加入乙醇(降低
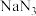 的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
已知:Ⅰ.
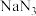 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;Ⅱ.
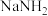 熔点210℃,沸点400℃,在水溶液中易水解。
熔点210℃,沸点400℃,在水溶液中易水解。请回答下列问题:
(1)实验室若采用固体加热方式制取氨气的化学方程式为
(2)步骤①中先加热通氨气的目的是
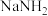 的化学方程式为
的化学方程式为(3)图中仪器a用的材料是铁质而不用玻璃,其主要原因是
(4)汽车经撞击后30毫秒内,会引发叠氮化钠迅速分解为两种单质,其中氧化产物和还原产物的质量之比为
(5)步骤④中用乙醚洗涤的主要原因除因其易挥发,有利于产品快速干燥外,还因为
(6)实验室用滴定法测定叠氮化钠样品中
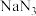 的质量分数:
的质量分数:①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL
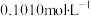
 溶液。
溶液。③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用
 标准溶液滴定过量的
标准溶液滴定过量的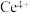 ,消耗溶液体29.00mL。测定过程的反应方程式为:
,消耗溶液体29.00mL。测定过程的反应方程式为: ;
; ;
;试样中
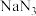 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
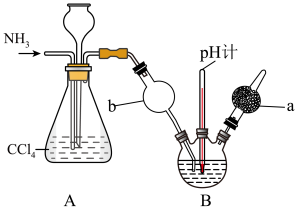
7 . 重铬酸铵[(NH4)2Cr2O7]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室将NH3通入重铬酸(H2Cr2O7)溶液中制备[(NH4)2Cr2O7]的装置如图所示(夹持装置略)。回答下列问题:
已知: (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。
(1)仪器a的名称是_______ ,A装置的作用为_______ 。
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是_______ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为_______ 。
②用_______ (填“酸式”或“碱式”)滴定管量取25.00mL样品溶液于250mL锥形瓶中。
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是_______ 。
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为_______ %。
⑤若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”、“偏小”或“不变”)。

已知:
 (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。(1)仪器a的名称是
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++
 +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为
②用
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为
⑤若滴定终点时仰视读数,则测定的质量分数将
您最近一年使用:0次
名校
解题方法
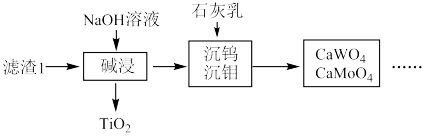
8 . 从烟气脱硝催化剂(含 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。
(1)粉碎的目的是_______ ,滤渣1的成分为_______ 。
(2)若酸浸还原产物为 ,其中V的化合价是
,其中V的化合价是_______ 。用 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式_______ 。
(3)写出“富集氧化”过程的化学方程式_______ ,若用 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
_______ mol。
(4)可用 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为_______ %。(保留1位小数)
(5) 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。________ 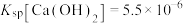 ,
,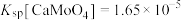 ,且
,且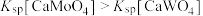 。
。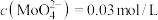 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为_______ 时开始产生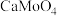 沉淀。
沉淀。
 、
、 、
、 、
、 等)回收
等)回收 的工艺流程如下(已知
的工艺流程如下(已知 、
、 、
、 不溶于稀硫酸)。
不溶于稀硫酸)。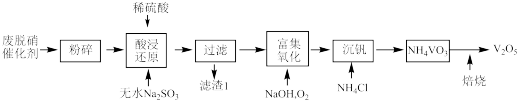
(1)粉碎的目的是
(2)若酸浸还原产物为
 ,其中V的化合价是
,其中V的化合价是 代替无水
代替无水 做还原剂,写出“酸浸还原”的离子反应方程式
做还原剂,写出“酸浸还原”的离子反应方程式(3)写出“富集氧化”过程的化学方程式
 代替
代替 ,要使3mol
,要使3mol  变为
变为 ,至少需要
,至少需要
(4)可用
 滴定法测定
滴定法测定 的浸出率,对含4.95g
的浸出率,对含4.95g  的废脱硝催化剂进行浸出,浸出后的
的废脱硝催化剂进行浸出,浸出后的 溶液用0.1000mol/L的
溶液用0.1000mol/L的 溶液滴定,消耗
溶液滴定,消耗 溶液100mL,则
溶液100mL,则 的浸出率为
的浸出率为(5)
 焙烧过程发生反应(ⅰ)
焙烧过程发生反应(ⅰ) ,(ⅱ)
,(ⅱ) ,现对234g
,现对234g 样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。
样品进行焙烧,根据上述原理在下图坐标系内画出焙烧过程大致的热重变化曲线,并在纵坐标处标注固体发生的质量变化值,在横坐标标注必要的温度数值。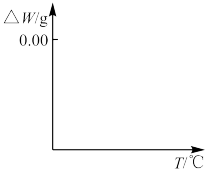
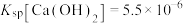 ,
,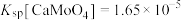 ,且
,且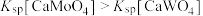 。
。
 的浸出液中加入石灰乳,需溶液pH为
的浸出液中加入石灰乳,需溶液pH为 沉淀。
沉淀。
您最近一年使用:0次
2023-02-24更新
|
822次组卷
|
4卷引用:辽宁省大连市第二十四中学2023届高三下学期第六次模拟考试化学试题
名校
9 . 锡(Sn)是第ⅣA族元素,其常见的氯化物有SnCl4和SnCl2。SnCl4常温下为液体,遇水极易发生水解反应;SnCl2常温下为固体,具有还原性,可被空气中的氧气氧化。某化学实验小组制备SnCl4的装置如图(加热与夹持装置省略)。
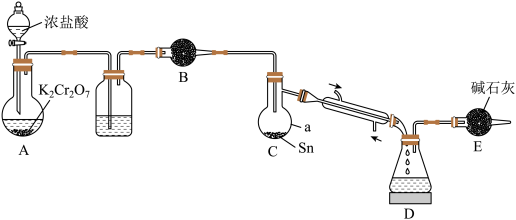
回答下列问题:
(1)仪器a的名称是_______ ;装置B中盛放的试剂是________ 。
(2)制取SnCl4的操作步骤为:
①连接好装置
②检查装置的气密性
③添加药品、滴加浓盐酸
④待装置D________ 后,加热装置C
⑤收集SnCl4
请补充上述实验步骤。已知装置A中反应的还原产物为Cr3+,写出该反应的离子方程式:________ 。
(3)经测定发现实验所得SnCl4样品中含有少量的SnCl2,测定样品纯度的方案如下:
取ag样品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液VmL。滴定过程中先后发生的反应为:
ⅰ.
ⅱ. (均未配平)
(均未配平)
则SnCl4样品的纯度为______ %;若滴定时间过长,会使测量结果______ (填“偏大”“偏小”或“无影响”)。

回答下列问题:
(1)仪器a的名称是
(2)制取SnCl4的操作步骤为:
①连接好装置
②检查装置的气密性
③添加药品、滴加浓盐酸
④待装置D
⑤收集SnCl4
请补充上述实验步骤。已知装置A中反应的还原产物为Cr3+,写出该反应的离子方程式:
(3)经测定发现实验所得SnCl4样品中含有少量的SnCl2,测定样品纯度的方案如下:
取ag样品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液VmL。滴定过程中先后发生的反应为:
ⅰ.

ⅱ.
 (均未配平)
(均未配平)则SnCl4样品的纯度为
您最近一年使用:0次
2022-09-05更新
|
326次组卷
|
3卷引用:辽宁省名校联盟2022-2023学年高三上学期9月联合考试化学试题
名校
解题方法
10 . 下列实验能达到目的的是
| 目的 | 实验方法或方案 | |
| A | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的 溶液,分别加入等体积等浓度的 溶液,分别加入等体积等浓度的 溶液,对比现象 溶液,对比现象 |
| B | 比较 和 和 元素的非金属性强弱 元素的非金属性强弱 | 将碳单质和二氧化硅固体混合置于硬质玻璃管内高温加热,并检验反应后产物 |
| C | 判断固体样品是否是铵盐 | 用试管取少量样品,加水溶解,加足量氢氧化钠溶液后加热,试管口放一张湿润的红色石蕊试纸,观察现象 |
| D | 验证 溶液中含有的含碘微粒 溶液中含有的含碘微粒 | 向两支盛有 溶液的试管中,分别滴加淀粉溶液和 溶液的试管中,分别滴加淀粉溶液和 溶液,观察现象 溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



