名校
1 . A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)B的最高价氧化物的电子式是___________ 。
(2)用电子式表示E2F的形成过程___________ 。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是___________ 。(用离子符号表示)
(4)下列实验操作对应的实验现象中,不正确的是___________ (填字母)。
(5)写出A与C形成的10电子分子中的化学键有___________ ,该物质的水溶液常用于检验输送G的单质的管道是否漏气,若漏气就会产生白烟,发生反应的化学方程式为___________ 。
请用化学用语回答:
(1)B的最高价氧化物的电子式是
(2)用电子式表示E2F的形成过程
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是
(4)下列实验操作对应的实验现象中,不正确的是
| 选项 | 实验操作 | 实验现象 |
| a | 将E单质投入到CuSO4溶液中 | 生成大量红色固体 |
| b | 向AlCl3溶液中通入过量C的气态氢化物 | 先生成白色沉淀,然后沉淀溶解 |
| c | 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 | 分两层,下层溶液变为橙红色 |
| d | 将B的最高价氧化物通入到Na2SiO3溶液中 | 生成白色沉淀 |
您最近一年使用:0次
名校
解题方法
2 . 现有部分元素的性质与原子(或分子)结构如下表(T、X、Y、Z都为前20号元素),请回答:
(1)画出元素T的二价阴离子的结构示意图______
(2)上述元素中,非金属性最强的元素在元素周期表中的位置______ ;表中T、X、Y元素的简单氢化物的稳定性由强到弱的顺序为______ (用化学式表示)。
(3)写出X单质与Z的最高价氧化物对应的水化物反应的化学方程式______
(4)镓(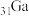 )的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
)的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 。写出该反应的化学方程式
。写出该反应的化学方程式______ 。
元素编号 | 元素性质与原子(或分子)结构 |
T | 其二价阴离子核外电子数为18 |
X | 第三周期非金属性最强的元素 |
Y | L层比K层多5个电子 |
Z | 位于第4周期,内层电子数是最外层电子数的9倍 |
(2)上述元素中,非金属性最强的元素在元素周期表中的位置
(3)写出X单质与Z的最高价氧化物对应的水化物反应的化学方程式
(4)镓(
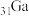 )的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
)的化合物砷化镓(GaAs)具有耐高温、耐高电压等特性,可作为第三代半导体材料。废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 。写出该反应的化学方程式
。写出该反应的化学方程式
您最近一年使用:0次
名校
3 . A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,E和F都是金属元素,且F的单质能与E的最高价氧化物对应的水化物发生反应,其他元素可组成半胱氨酸,结构如图所示。
(1)A有三种核素,最重的一种核素可用化学符号表示为______ 。
(2)G在周期表中的位置是______ 。
(3)A和D的原子按个数比1:1形成的化合物的结构式为______ 。D和E的原子也可按个数比1:1形成化合物,该化合物的电子式为______ 。
(4)C、D、E、F的简单离子的半径由大到小的顺序为______ (用离子符号表示)。
(5)F的单质与E的最高价氧化物对应的水化物发生反应的离子方程式为______ 。
(6)C的简单氢化物与C的最高价氧化物对应的水化物能化合生成一种盐,该盐中含有的化学键类型有______ 。

(1)A有三种核素,最重的一种核素可用化学符号表示为
(2)G在周期表中的位置是
(3)A和D的原子按个数比1:1形成的化合物的结构式为
(4)C、D、E、F的简单离子的半径由大到小的顺序为
(5)F的单质与E的最高价氧化物对应的水化物发生反应的离子方程式为
(6)C的简单氢化物与C的最高价氧化物对应的水化物能化合生成一种盐,该盐中含有的化学键类型有
您最近一年使用:0次
名校
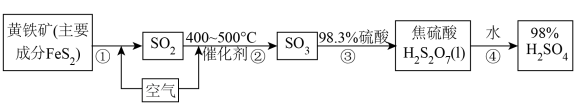
4 . 工业上用黄铁矿为原料制备硫酸的流程如图所示:
(1)已知FeS2的阴离子达到稳定结构,则FeS2的电子式为___________ 。
(2)已知: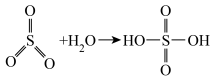 ,请写出焦硫酸的结构式
,请写出焦硫酸的结构式___________ 。
(3)写出步骤①的化学方程式___________ 。
(4)室温下,SO3为液体,SO2为气体。SO3熔点高于SO2的原因___________ 。
(5)下列说法正确的是___________ 。
A.步骤①,产生的气体进入接触室之前无需净化处理
B.步骤②,使用催化剂能使SO2的转化率达到100%
C.步骤③,吸收设备中填充瓷环可提高SO3吸收率
D.可以预测:Na2S2O7的水溶液呈酸性,H2S2能将Fe2+氧化成Fe3+
E.17.8g H2S2O7与2.2g水充分混合后,可获得98%浓硫酸
(6)若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之。简述实验操作和有关的实验现象___________ 。(供选择的试剂:KSCN溶液、稀硫酸、稀盐酸、KMnO4溶液、品红溶液、NaOH溶液)
(1)已知FeS2的阴离子达到稳定结构,则FeS2的电子式为
(2)已知:
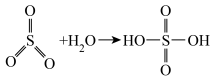 ,请写出焦硫酸的结构式
,请写出焦硫酸的结构式(3)写出步骤①的化学方程式
(4)室温下,SO3为液体,SO2为气体。SO3熔点高于SO2的原因
(5)下列说法正确的是
A.步骤①,产生的气体进入接触室之前无需净化处理
B.步骤②,使用催化剂能使SO2的转化率达到100%
C.步骤③,吸收设备中填充瓷环可提高SO3吸收率
D.可以预测:Na2S2O7的水溶液呈酸性,H2S2能将Fe2+氧化成Fe3+
E.17.8g H2S2O7与2.2g水充分混合后,可获得98%浓硫酸
(6)若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之。简述实验操作和有关的实验现象
您最近一年使用:0次
名校
5 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: 是粉红色固体,难溶于水。
是粉红色固体,难溶于水。
(1)Si在元素周期表的位置是___________ 。 的电子式为
的电子式为___________ 。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”的化学方程式为
的混合物,“500℃焙烧”的化学方程式为___________ 。
(3)鉴别洗净的“滤饼3”和 中阳离子的常用方法是
中阳离子的常用方法是___________ 。
(4)实验室过滤操作时使用的玻璃仪器除玻璃棒还有___________ 。
(5)实验室检验 是否沉淀完全的操作是
是否沉淀完全的操作是___________ 。
(6)“850℃煅烧”时的化学方程式为___________ 。
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: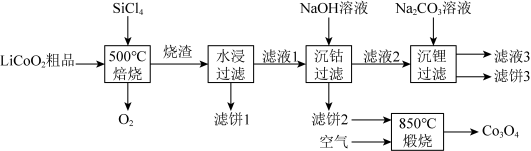
 是粉红色固体,难溶于水。
是粉红色固体,难溶于水。(1)Si在元素周期表的位置是
 的电子式为
的电子式为(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”的化学方程式为
的混合物,“500℃焙烧”的化学方程式为(3)鉴别洗净的“滤饼3”和
 中阳离子的常用方法是
中阳离子的常用方法是(4)实验室过滤操作时使用的玻璃仪器除玻璃棒还有
(5)实验室检验
 是否沉淀完全的操作是
是否沉淀完全的操作是(6)“850℃煅烧”时的化学方程式为
您最近一年使用:0次
6 . X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
回答下列问题:
(1)元素X的一种核素,可测定文物年代,这种核素的符号为__________ 。
(2)Y元素的原子结构示意图为______________ ;Z元素在周期表中的位置是____________ 。
(3)上述六种元素中有两种元素能形成一种淡黄色的固体化合物,该化合物的电子式是____________ ,所含化学键的类型有_____________ 。
(4)Q、R两种元素的简单氢化物的稳定性由强到弱的顺序为________________ 。
(5)Z、Q、W三种元素的原子半径由大到小的顺序为____________________ 。
(6)Z元素的最高价氧化物对应的水化物与W的单质发生反应的化学方程式为__________________ 。
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中失电子能力最强的元素 |
Q | 原子最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | R与Q同族,R的一种氧化物是造成酸雨的物质之一 |
(1)元素X的一种核素,可测定文物年代,这种核素的符号为
(2)Y元素的原子结构示意图为
(3)上述六种元素中有两种元素能形成一种淡黄色的固体化合物,该化合物的电子式是
(4)Q、R两种元素的简单氢化物的稳定性由强到弱的顺序为
(5)Z、Q、W三种元素的原子半径由大到小的顺序为
(6)Z元素的最高价氧化物对应的水化物与W的单质发生反应的化学方程式为
您最近一年使用:0次
名校
7 . 氯化钠是一种重要的化工原料,用它可以制取日常生活中常使的消毒剂、清洁剂等多种物质,如下图所示(X和Y都是单质)。___________ ;NaCl的电子式为___________ 。
(2)漂白粉的有效成分是___________ (填化学式);漂白粉在空气中的漂白原理的化学方程式为___________ 。
(3)曾有报道,因“洁厕灵”(酸性洗涤剂)与“84”消毒液(主要成分是NaClO)混合使用而发生中毒事件,用离子方程式分析其原因:___________ 。
(4)写出NaCl水溶液通电后发生反应的离子方程式___________ 。
(5)工业上甲醇(CH3OH)在NaOH(aq)下可做燃料电池,则氧气作电池的___________ 极;负极发生的电极反应式为___________ 。

(2)漂白粉的有效成分是
(3)曾有报道,因“洁厕灵”(酸性洗涤剂)与“84”消毒液(主要成分是NaClO)混合使用而发生中毒事件,用离子方程式分析其原因:
(4)写出NaCl水溶液通电后发生反应的离子方程式
(5)工业上甲醇(CH3OH)在NaOH(aq)下可做燃料电池,则氧气作电池的
您最近一年使用:0次
名校
8 . 甲是日常生活中是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟,D是食盐的主要成分(部分反应物和生成物及溶剂水已略去)。___________ ;甲在元素周期表的位置为___________ 。
(2)A的电子式为___________ 。
(3)实验室常用加热固体混合物制备B,其化学方程式为___________ 。
(4)物质B的催化氧化是工业制硝酸的基础,其化学方程式___________ 。
(5)丙在丁中点燃,其现象为___________ 。
(6)检验E溶液中阳离子的方法是___________ 。
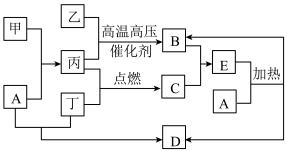
(2)A的电子式为
(3)实验室常用加热固体混合物制备B,其化学方程式为
(4)物质B的催化氧化是工业制硝酸的基础,其化学方程式
(5)丙在丁中点燃,其现象为
(6)检验E溶液中阳离子的方法是
您最近一年使用:0次
解题方法
9 . 利用零价铁(Fe)耦合过硫酸盐( )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。 的结构式是
的结构式是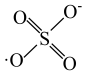 ,则
,则 的结构式是
的结构式是___________ 。
(2)过程ⅰ中反应的离子方程式是___________ 。
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)___________ 。
(4)探究零价铁和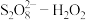 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。
Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·
a.X中加入的是___________ (填“甲醇”或“叔丁醇")。
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是___________ 。
Ⅱ.探究混合氧化剂中 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的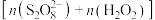 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。
a.从①到④,TOC去除率升高的原因是___________ 。
b.从④到⑦,TOC去除率下降的原因是___________ 。
 )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。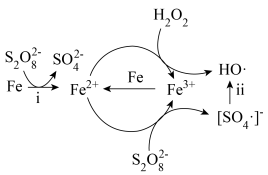
 的结构式是
的结构式是 ,则
,则 的结构式是
的结构式是(2)过程ⅰ中反应的离子方程式是
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)
(4)探究零价铁和
 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。
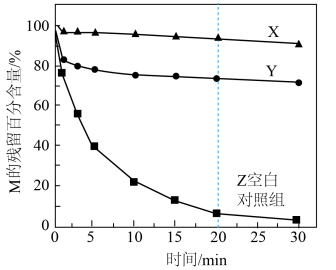
 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·a.X中加入的是
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是
Ⅱ.探究混合氧化剂中
 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的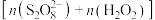 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。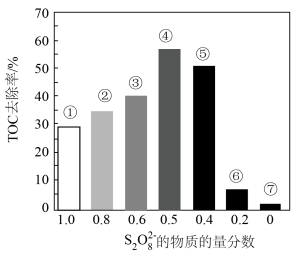
a.从①到④,TOC去除率升高的原因是
b.从④到⑦,TOC去除率下降的原因是
您最近一年使用:0次
名校
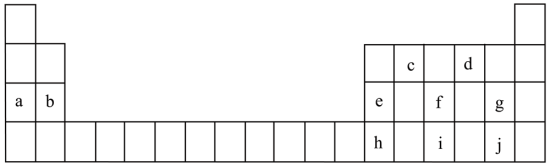
10 . 下表为元素周期表的一部分,表中所列的每个字母分别代表某一元素。
(1)元素 的原子结构示意图为
的原子结构示意图为______ ,a、b、e、g简单离子半径的大小顺序______ (用离子符号表示)。
(2)化合物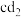 的电子式为
的电子式为______ ,化合物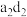 中含有的化学键为
中含有的化学键为______ 。
(3)写出e和g的最高价氧化物对应水化物相互反应的化学方程式______ 。
(4)由元素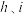 组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是
组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是______ (填元素符号)。元素 与
与 的最高价氧化物水化物的酸性更强的是
的最高价氧化物水化物的酸性更强的是______ (填化合物化学式,下同),元素 与
与 的简单气态氢化物还原性更强的是
的简单气态氢化物还原性更强的是______ 。
(5)设计实验证明 的得电子能力大于
的得电子能力大于 ,简述操作步骤和现象(可选用试剂:固体
,简述操作步骤和现象(可选用试剂:固体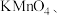 、稀盐酸、浓盐酸、溴水、
、稀盐酸、浓盐酸、溴水、 溶液、
溶液、 溶液):
溶液):______ 。
(1)元素
 的原子结构示意图为
的原子结构示意图为(2)化合物
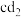 的电子式为
的电子式为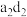 中含有的化学键为
中含有的化学键为(3)写出e和g的最高价氧化物对应水化物相互反应的化学方程式
(4)由元素
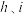 组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是
组成的化合物砷化镓(GaAs)是一种重要的半导体材料,其中元素h、i中失电子能力更强的是 与
与 的最高价氧化物水化物的酸性更强的是
的最高价氧化物水化物的酸性更强的是 与
与 的简单气态氢化物还原性更强的是
的简单气态氢化物还原性更强的是(5)设计实验证明
 的得电子能力大于
的得电子能力大于 ,简述操作步骤和现象(可选用试剂:固体
,简述操作步骤和现象(可选用试剂:固体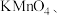 、稀盐酸、浓盐酸、溴水、
、稀盐酸、浓盐酸、溴水、 溶液、
溶液、 溶液):
溶液):
您最近一年使用:0次



