名校
1 . 请按要求回答:
(1)处于金属和非金属交界处的元素往往兼具金属元素和非金属元素的性质,根据周期律知识和以下信息推测元素A最可能的位置是第___________ 周期,第___________ 族。
①元素A的最高价氧化物及对应的水化物既能和酸反应又能和碱反应;
②1mol该元素最高价氧化物对应水化物在与盐酸反应时最多消耗4mol HCl;
(2)W、X、Y、Z、Q是五种短周期元素,其中W、X、Y、Q同周期,Y和Z同主族,X、Y、Z三种元素相邻且其原子的最外层电子数之和为17,核内质子数之和为31,W的核外电子数与X的最外层电子数相同,Q2是氧化性最强的单质。请回答下列问题:
①X的一种核素质子数和中子数相同,其原子符号为___________ ;
②Y、Z、Q离子半径从大到小为___________ (填离子符号);
③用一个反应比较Y和Z的非金属性,请写出其化学方程式:___________ ;
④将Q2通入水中可得到Y的单质,其化学方程式为:___________ ;
⑤离子化合物(XY)+(WQ4)-常用于合成有机物,其阴离子的电子式为___________ 。
(1)处于金属和非金属交界处的元素往往兼具金属元素和非金属元素的性质,根据周期律知识和以下信息推测元素A最可能的位置是第
①元素A的最高价氧化物及对应的水化物既能和酸反应又能和碱反应;
②1mol该元素最高价氧化物对应水化物在与盐酸反应时最多消耗4mol HCl;
(2)W、X、Y、Z、Q是五种短周期元素,其中W、X、Y、Q同周期,Y和Z同主族,X、Y、Z三种元素相邻且其原子的最外层电子数之和为17,核内质子数之和为31,W的核外电子数与X的最外层电子数相同,Q2是氧化性最强的单质。请回答下列问题:
①X的一种核素质子数和中子数相同,其原子符号为
②Y、Z、Q离子半径从大到小为
③用一个反应比较Y和Z的非金属性,请写出其化学方程式:
④将Q2通入水中可得到Y的单质,其化学方程式为:
⑤离子化合物(XY)+(WQ4)-常用于合成有机物,其阴离子的电子式为
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)分子式为 的配合物有两种不同的颜色,其中呈橙黄色的物质较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图所示的结构示意图中呈亮黄色的是
的配合物有两种不同的颜色,其中呈橙黄色的物质较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图所示的结构示意图中呈亮黄色的是_____ (填“A”或“B”)。

(2)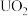 可用于制备
可用于制备 发生反应:
发生反应: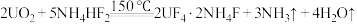 ,其中
,其中 的结构可表示为
的结构可表示为 ,反应中断裂的化学键有
,反应中断裂的化学键有_____ (填序号)。
A.氢键 B.极性键 C.离子键 D.金属键 E.非极性键
(3)依据VSEPR模型推测 的空间结构为
的空间结构为______ 。分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为_____ 。
(4)Xe是第五周期的稀有气体元素,与F形成的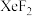 室温下易升华。
室温下易升华。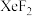 中心原子的价层电子对数为
中心原子的价层电子对数为_____ ,下列对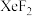 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是_____ (填标号)。
A.sp B. C.
C. D.
D.
(1)分子式为
 的配合物有两种不同的颜色,其中呈橙黄色的物质较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图所示的结构示意图中呈亮黄色的是
的配合物有两种不同的颜色,其中呈橙黄色的物质较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图所示的结构示意图中呈亮黄色的是
(2)
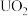 可用于制备
可用于制备 发生反应:
发生反应: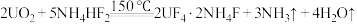 ,其中
,其中 的结构可表示为
的结构可表示为 ,反应中断裂的化学键有
,反应中断裂的化学键有A.氢键 B.极性键 C.离子键 D.金属键 E.非极性键
(3)依据VSEPR模型推测
 的空间结构为
的空间结构为 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为(4)Xe是第五周期的稀有气体元素,与F形成的
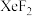 室温下易升华。
室温下易升华。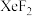 中心原子的价层电子对数为
中心原子的价层电子对数为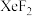 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是A.sp B.
 C.
C. D.
D.
您最近一年使用:0次
名校
3 . 短周期主族元素X、Y、Z、W、M的原子半径依次增大,与元素有关的信息如表所示:
回答下列问题:
(1) 的一种核素含有8个中子,其核素符号为
的一种核素含有8个中子,其核素符号为___________ ,写出其简单氢化物的一种用途:___________ 。
(2)由 与
与 组成的化合物含有的化学键类型为
组成的化合物含有的化学键类型为___________ 。
(3)上述元素对应的简单离子中半径最大的为___________ (填离子符号)。
(4) 单质与
单质与 的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为
的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为___________ 。
(5) 与
与 形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程
形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程___________ 。
(6) 的简单氢化物的沸点比
的简单氢化物的沸点比 的简单氢化物的沸点高,从结构角度分析其原因为
的简单氢化物的沸点高,从结构角度分析其原因为___________ 。
(7)下列关于 及
及 同主族元素的说法错误的是___________。
同主族元素的说法错误的是___________。
| 元素 | 相关信息 |
 | 简单氢化物的水溶液可以刻蚀玻璃 |
 | 最外层电子数比次外层多3 |
 | 最高正价和最低负价的代数和为4 |
 | 地壳中含量最高的金属元素 |
 | 最高价氧化物对应水化物属于强碱 |
(1)
 的一种核素含有8个中子,其核素符号为
的一种核素含有8个中子,其核素符号为(2)由
 与
与 组成的化合物含有的化学键类型为
组成的化合物含有的化学键类型为(3)上述元素对应的简单离子中半径最大的为
(4)
 单质与
单质与 的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为
的最高价氧化物对应水化物混合使用,可用于疏通地下管道,其发生反应的离子方程式为(5)
 与
与 形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程
形成的一种化合物中,所有原子均满足8电子稳定结构,用电子式表示该化合物的形成过程(6)
 的简单氢化物的沸点比
的简单氢化物的沸点比 的简单氢化物的沸点高,从结构角度分析其原因为
的简单氢化物的沸点高,从结构角度分析其原因为(7)下列关于
 及
及 同主族元素的说法错误的是___________。
同主族元素的说法错误的是___________。A.将 的单质通入其同族元素与钠形成的钠盐溶液中,可置换出同族元素的单质 的单质通入其同族元素与钠形成的钠盐溶液中,可置换出同族元素的单质 |
| B.随着原子序数递增,该主族元素对应单质的沸点逐渐升高 |
C.该主族元素中最高价氧化物对应水化物酸性最强的元素为 |
D. 的简单氢化物可与强碱溶液反应 的简单氢化物可与强碱溶液反应 |
您最近一年使用:0次
名校
4 . 如图是氮元素的几种价态与物质类别的对应关系。回答下列问题:
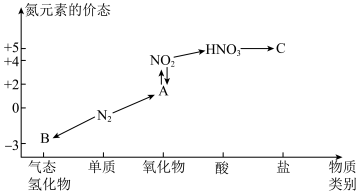
(1)B物质的电子式为:_______ 。
(2)实验室制取物质B的化学方程式为_______ 。
(3)浓硝酸与木炭在加热条件下反应的化学方程式为_______ 。
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入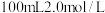 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为_______  。
。

(1)B物质的电子式为:
(2)实验室制取物质B的化学方程式为
(3)浓硝酸与木炭在加热条件下反应的化学方程式为
(4)将3.2g铜与60.0mL一定浓度的硝酸发生反应,铜完全溶解,产生
 和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入
和NO混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入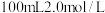 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为 。
。
您最近一年使用:0次
解题方法
5 . X 、Y 、Z 、W 、Q 、R为原子序数依次增大的短周期元素,在周期表中,X的原子半径最小,Z的主族序数是其周期数的三倍,Z与R的最外层电子数相等;Z与R的质子数之和是X与W的质子数之和两倍;Y元素的一种同位素可以用来测定文物年代;Q简单离子的半径是其所在周期中最小。请回答下列问题:
(1)Q元素在周期表中的位置是___________ ,W与R形成的化合物W2R的电子式是___________ 。
(2)Z、R的简单氢化物的沸点较高的是:___________ (填氢化物的化学式),解释原因是:___________ 。
(3)下列有关说法不正确 的是___________。
(1)Q元素在周期表中的位置是
(2)Z、R的简单氢化物的沸点较高的是:
(3)下列有关说法
| A.X与W形成的化合物属于共价化合物 |
| B.与Y同一主族的第四周期元素的原子序数为32 |
| C.X与Y形成的化合物中不可能含非极性键 |
| D.最高价氧化物对应的水化物碱性:Q<W |
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题
(1)工业以煤为燃料时,会产生大量的羰基硫 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
i氢解反应:
ii水解反应: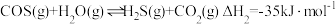
请回答下列问题:
① 的电子式为
的电子式为_________ ,分子中碳元素的化合价为_________ 。
②已知: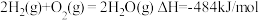
写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________________________ 。
(2)①常温下,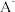 水解常数
水解常数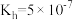 ,若
,若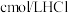 与
与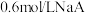 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
_________ 。
②已知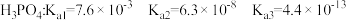 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在_________ 土壤中(填“酸性”、“中性”或“碱性”)。通过计算说明判断的依据是__________________ 。
(3)用间接电解法对 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。

①电极I的电极反应式为__________________ 。
②每处理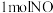 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为_________ g。
(1)工业以煤为燃料时,会产生大量的羰基硫
 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:i氢解反应:

ii水解反应:
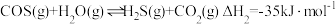
请回答下列问题:
①
 的电子式为
的电子式为②已知:
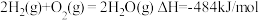
写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:(2)①常温下,
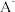 水解常数
水解常数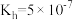 ,若
,若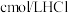 与
与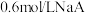 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
②已知
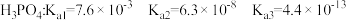 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在(3)用间接电解法对
 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。
①电极I的电极反应式为
②每处理
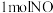 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为
您最近一年使用:0次
名校
7 . 到目前为止,我们学习了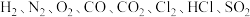 、
、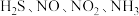 等气体.
等气体.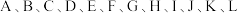 各代表以上气体中一种气体,它们具有如下性质:
各代表以上气体中一种气体,它们具有如下性质:
①A能使湿润的红色石蕊试纸变蓝,A和B相遇时,会产生大量白烟;
②将C和D分别通入品红溶液时,品红溶液都会褪色,但给褪色后的溶液加热时,通入D的溶液会重新变红,通入C的溶液不会重新变红;
③E和F相遇生成红棕色气体K;
④G有臭鸡蛋气味,G在足量F中燃烧生成D和 ;
;
⑤H在C中燃烧时,生成B,同时在集气瓶口会有白雾出现;
⑥D和I都能使澄清石灰水变浑浊;
⑦J在F中燃烧生成I.
⑧在加热及催化剂催化下,J和E反应生成I和L.
(1)实验室收集气体E的方法为_________ ,收集气体K的方法为_________ 。
(2)A的电子式为_________ 。
(3)①中生成白烟的成分为_______ (填名称)。
(4)④中发生反应的化学方程式为_________________ 。
(5)⑤中火焰颜色为________ .白雾成分为_________ (选填“ ”或“盐酸”)。
”或“盐酸”)。
(6)⑧中发生反应的化学方程式为_________________ 。
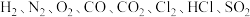 、
、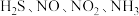 等气体.
等气体.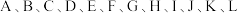 各代表以上气体中一种气体,它们具有如下性质:
各代表以上气体中一种气体,它们具有如下性质:①A能使湿润的红色石蕊试纸变蓝,A和B相遇时,会产生大量白烟;
②将C和D分别通入品红溶液时,品红溶液都会褪色,但给褪色后的溶液加热时,通入D的溶液会重新变红,通入C的溶液不会重新变红;
③E和F相遇生成红棕色气体K;
④G有臭鸡蛋气味,G在足量F中燃烧生成D和
 ;
;⑤H在C中燃烧时,生成B,同时在集气瓶口会有白雾出现;
⑥D和I都能使澄清石灰水变浑浊;
⑦J在F中燃烧生成I.
⑧在加热及催化剂催化下,J和E反应生成I和L.
(1)实验室收集气体E的方法为
(2)A的电子式为
(3)①中生成白烟的成分为
(4)④中发生反应的化学方程式为
(5)⑤中火焰颜色为
 ”或“盐酸”)。
”或“盐酸”)。(6)⑧中发生反应的化学方程式为
您最近一年使用:0次
名校
8 . Ⅰ.金属家(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是__________ 。
Ⅱ.GaAs是共价化合物,一种重要的半导体材料。As与Ga同周期,As与N同主族。
(2)下列事实不能用元素周期律解释的是_________ (填字母)。
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
(3)废弃含GaAs半导体材料可以用浓硝酸溶解GaAs,生成H3AsO4和Ga3+和NO2,写出该反应的化学方程式_____________________ 。
Ⅲ.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:_________ 。
(5)简单离子A+、B2-、F3+中,离子半径由大到小的顺序是_________ (填离子符号)。
(6)电子式表示A2B的形成过程__________________ 。
(7)含F3+的溶液中通入过量D,反应的离子方程式是__________________ 。
(8)A单质与E反应的生成的化合物中化学键的类型是_________ 。
(1)铝在元素周期表中的位置是
Ⅱ.GaAs是共价化合物,一种重要的半导体材料。As与Ga同周期,As与N同主族。
(2)下列事实不能用元素周期律解释的是
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
(3)废弃含GaAs半导体材料可以用浓硝酸溶解GaAs,生成H3AsO4和Ga3+和NO2,写出该反应的化学方程式
Ⅲ.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:
(5)简单离子A+、B2-、F3+中,离子半径由大到小的顺序是
(6)电子式表示A2B的形成过程
(7)含F3+的溶液中通入过量D,反应的离子方程式是
(8)A单质与E反应的生成的化合物中化学键的类型是
您最近一年使用:0次
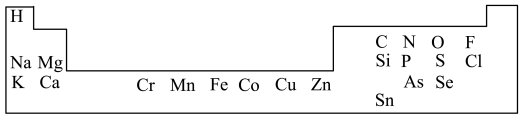
9 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。人体必需的一些元素在周期表中的分布情况如下:
(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为______ 。
(2)第三周期半径最小的简单离子为______ 。
(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石 属于
属于______ (填“酸”、“碱”、“盐”或“氧化物”)。Ca与Mg在元素周期表同一族,化学性质相似同时也有递变性,试写出Ca与 反应的化学方程式:
反应的化学方程式:____________ 。
(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是______ ,原子序数为______ 。
(5)由元素C和O形成的三核直线形分子的结构式为______ 。
(6)用电子式表示元素Na和S的原子形成的化合物(该化合物含有三个原子核)的形成过程:____________ 。
(7)能比较元素S和Cl非金属性强弱的实验事实是______ (填字母)。
a. 的酸性比HCl的酸性弱
的酸性比HCl的酸性弱
b.单质 与
与 化合比单质S与
化合比单质S与 化合容易,且HCl的稳定性比
化合容易,且HCl的稳定性比 的强
的强
c.向 的水溶液中通入少量
的水溶液中通入少量 可置换出单质S
可置换出单质S

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)第三周期半径最小的简单离子为
(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石
 属于
属于 反应的化学方程式:
反应的化学方程式:(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(5)由元素C和O形成的三核直线形分子的结构式为
(6)用电子式表示元素Na和S的原子形成的化合物(该化合物含有三个原子核)的形成过程:
(7)能比较元素S和Cl非金属性强弱的实验事实是
a.
 的酸性比HCl的酸性弱
的酸性比HCl的酸性弱b.单质
 与
与 化合比单质S与
化合比单质S与 化合容易,且HCl的稳定性比
化合容易,且HCl的稳定性比 的强
的强c.向
 的水溶液中通入少量
的水溶液中通入少量 可置换出单质S
可置换出单质S
您最近一年使用:0次
解题方法
10 . 已知有如图所示物质间的相互转化,已知A是一种金属单质。
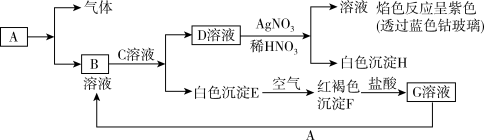
试回答:
(1)按要求作答:B物质的化学式:___________ ,C物质的电子式___________ 。
(2)写出由E转变成F的化学方程式:___________ 。
(3)写出下列反应的离子方程式:D溶液与AgNO3反应:___________ ;向G溶液中加入A:___________ 。
(4)焰色试验是___________ 变化。填(“物理”或“化学”)

试回答:
(1)按要求作答:B物质的化学式:
(2)写出由E转变成F的化学方程式:
(3)写出下列反应的离子方程式:D溶液与AgNO3反应:
(4)焰色试验是
您最近一年使用:0次



