1 . I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________ >________ >________ ;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________ ;
__________________________________________ ;
__________________________________________ 。
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________ 。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:
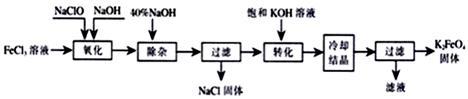
(1)写出“氧化”过程中生成Na2FeO4的化学方程式________________________ 。
(2)“转化”过程中发生的化学反应方程式为__________________________ 。

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:

(1)写出“氧化”过程中生成Na2FeO4的化学方程式
(2)“转化”过程中发生的化学反应方程式为
您最近一年使用:0次
名校
2 . 在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,恰好完全反应,得到沉淀质量为n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n−m)克 ②恰好溶解后溶液中 的物质的量为bV mol
的物质的量为bV mol
③反应过程中转移的电子数为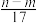 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L
⑤与合金反应的硝酸的物质的量为 mol
mol
①沉淀中氢氧根的质量为(n−m)克 ②恰好溶解后溶液中
 的物质的量为bV mol
的物质的量为bV mol③反应过程中转移的电子数为
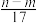 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L⑤与合金反应的硝酸的物质的量为
 mol
mol| A.①②③④⑤ | B.①③④⑤ |
| C.①③⑤ | D.①②③⑤ |
您最近一年使用:0次
2016-12-09更新
|
2383次组卷
|
4卷引用:2016届山东省济宁市第一中学高三上学期期中考试化学试卷
2016届山东省济宁市第一中学高三上学期期中考试化学试卷(已下线)《2018,我的高考我的教师君》-【考前基础篇】高考化学必会知识大盘点江西师范大学附属中学2020-2021学年高一下学期4月月考化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题
名校
3 . 8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
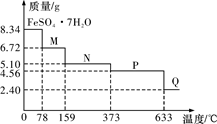

| A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O |
| B.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4 |
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O FeSO4+H2O FeSO4+H2O |
| D.温度为159 ℃时固体N的化学式为FeSO4·2H2O |
您最近一年使用:0次
2016-12-09更新
|
3470次组卷
|
10卷引用:2016届山东省济宁市第一中学高三上学期期中考试化学试卷
4 . 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是
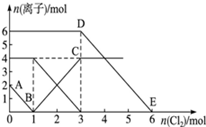

| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为3mol |
| C.线段AB表示Fe2+被氯气氧化 |
| D.原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
您最近一年使用:0次
2016-12-09更新
|
2290次组卷
|
3卷引用:2016届山东省淄博实验中学高三上学期第一次诊断测试化学试卷
解题方法
5 . 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要____________________ 。
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________ 。此液体具有的性质是 _______ (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是_________ (填化学式)。写出以上过程中涉及到的化学反应方程式,如果是离子反应,用离子反应方程式表示_________ 。
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为______________________ 。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
______ Cu2S+______ Fe3++____ H2O
_____ Cu2++______ Fe2++______ ( ) +______ SO42- 。
(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是_____________________ 。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:

(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是
您最近一年使用:0次
2016-12-09更新
|
813次组卷
|
2卷引用:2016届山东省邹城市第一中学高三上学期10月月考化学试卷
6 . 研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2 N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____ ,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____ molNO2。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为______________ .
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子。分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀。
Ⅲ.取100 mL废水,逐滴加入1.0 mol/L的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。
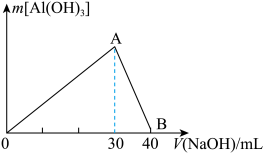
请根据上述信息回答下列问题:、
①该废水中一定不含有的离子是__________ .
②实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______ 。
③写出图中A→B反应的离子方程式:_________________ 。
④通过计算,该废水中______ Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=________ (若不含有,此问不必作答)。
(1)利用反应CH4+2NO2
 N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子。分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀。
Ⅲ.取100 mL废水,逐滴加入1.0 mol/L的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。

请根据上述信息回答下列问题:、
①该废水中一定不含有的离子是
②实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有
③写出图中A→B反应的离子方程式:
④通过计算,该废水中
您最近一年使用:0次
2016-12-09更新
|
915次组卷
|
2卷引用:2014-2015山东省临沂市高一上学期期期末统考化学试卷
名校
7 . 钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
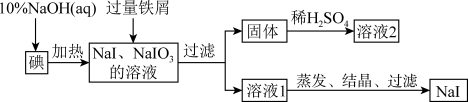
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________ 。
(2)生产流程中加入过量铁屑的目的是___________________ ,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________ 。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________ ;试设计实验证实该金属阳离子的存在:____________________________ 。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________ ;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:________________ 。

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为
(2)生产流程中加入过量铁屑的目的是
(3)溶液2中除含有H+外,一定含有的阳离子是
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:
您最近一年使用:0次
2016-12-09更新
|
921次组卷
|
6卷引用:山东省泰安市2018届高三上学期期中考试化学试题
8 . 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用下图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,___________ 。则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是___________(填选项)
(3)从下列实验步骤中,选择正确的操作顺序:①___________ ③(填序号)
① 打开止水夹
② 熄灭C处的酒精喷灯
③ C处冷却至室温后,关闭止水夹
④ 点燃C处的酒精喷灯
⑤ 收集氢气并验纯
⑥ 通入气体一段时间,排尽装置内的空气
(4)收集氢气验纯时,最好采用___________ 方法收集氢气。
探究二:
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确___________ 。(填“是”或“否”)若填“否”,则原因是___________ (用离子方程式说明);另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体。
证明样品中一定含有___________ ,取少量反应后的溶液,加适量蒸馏水稀释后,滴加___________ (填试剂和实验现象),则可证明另一成分存在,反之,说明样品中不含该成分。
探究三:
(6)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=___________ mol。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用下图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,
(2)装置A是氢气的发生装置,可以选用的药品是___________(填选项)
| A.稀硫酸和锌片 | B.稀硝酸和铁片 | C.氢氧化钠溶液和铝片D.浓硫酸和镁片 |
① 打开止水夹
② 熄灭C处的酒精喷灯
③ C处冷却至室温后,关闭止水夹
④ 点燃C处的酒精喷灯
⑤ 收集氢气并验纯
⑥ 通入气体一段时间,排尽装置内的空气
(4)收集氢气验纯时,最好采用
探究二:
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确
证明样品中一定含有
探究三:
(6)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=
您最近一年使用:0次
13-14高三下·浙江·阶段练习
解题方法
9 . 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置_______ 。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为_________ 。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______________ 。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器_____ (填“能”或“不能”)用来腌制咸菜,原因是__________ 。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________ 。关于该电池的下列说法,正确的是_______

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:_________________

X | Y | Z | |
W |
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:

您最近一年使用:0次
10 . (I)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:
(1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。写出该反应的化学方程式:___________________ 。
(2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
__ Na2SO3+__ KIO3+__ H2SO4 =__ Na2SO4+__ K2SO4+ __ I2+ __ H2O。
①配平上面的氧化还原反应方程式。
②其中氧化剂是________ ,若反应中有5 mol电子转移,则生成的碘单质是________ mol。
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是______ 。
A.BaSO4 B.FeS C.BaSO3 D.S
(4)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面________________ ,则发生了钝化。
(II)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4,1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子.试回答:
(1)A是____ 元素,C是______ 元素.
(2)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:______________ 、_____________ 。
(1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。写出该反应的化学方程式:
(2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
①配平上面的氧化还原反应方程式。
②其中氧化剂是
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是
A.BaSO4 B.FeS C.BaSO3 D.S
(4)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(II)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4,1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子.试回答:
(1)A是
(2)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:
您最近一年使用:0次



