解题方法
1 . 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
(1)下列四种化合物中含铜量最高的是________ (填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为__________ 万吨.(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂﹣﹣肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).
①该制备过程的反应方程式为_________________ .
②工业上常用的固液分离设备有_______ (填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:
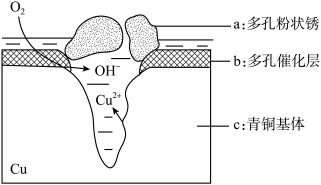
①腐蚀过程中,负极是_________ (填“a”“b”或“c”),正极反应方程式为_______________ .
②环境中的Cl﹣扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________________ .
(1)下列四种化合物中含铜量最高的是
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂﹣﹣肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).
①该制备过程的反应方程式为
②工业上常用的固液分离设备有
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:

①腐蚀过程中,负极是
②环境中的Cl﹣扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
您最近一年使用:0次
2 . 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_________ (填序号).
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成 I中反应的总化学方程式:_____ NaCl+_____ H2O=_____ NaClO3+______ ;
②Ⅱ中转化的基本反应类型是复分解反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是_________ ;
(3)一定条件,在水溶液中1mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

B→A+C反应的离子方程式为_________ ,生成1molC时,_________ kJ的热量(填吸收或放出以及具体数值)。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体 ①完成 I中反应的总化学方程式:
②Ⅱ中转化的基本反应类型是复分解反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是
(3)一定条件,在水溶液中1mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

B→A+C反应的离子方程式为
您最近一年使用:0次
解题方法
3 . 某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
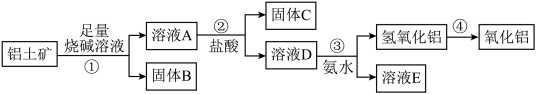
(1)固体B的主要用途有(写出1条即可)_________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:_______________ ;________________ 。
(3)第③步中,生成氢氧化铝的离子方程式是_________________ 。 若往A溶液中通入足量CO2,请写出可能发生反应的离子方程式______________ 。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_____________________ 。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)

(1)固体B的主要用途有(写出1条即可)
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:
(3)第③步中,生成氢氧化铝的离子方程式是
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)
您最近一年使用:0次
解题方法
4 . 元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_______________ 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________ ,氧化性最弱的简单阳离子是_________ 。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
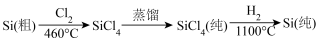
写出SiCl4的电子式:____________ ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为___________
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___________________________ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式:
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:
您最近一年使用:0次
解题方法
5 . 下图是某科技小组,以废旧锌锰干电池为原料,回收及制备多种用途的碳酸锰和相关物质的主要流程:
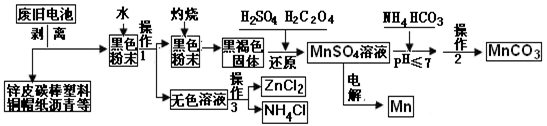
(1)灼烧黑色粉末变成黑褐色是因为有部分MnO2发生了反应生成了MnO,其可能的反应方程式为:____________ 。
(2)还原过程是先加入稀硫酸再加入草酸,写出反应化学方程式:________________ ;在该过程中甲同学发现加入硫酸,部分固体溶解只剩余黑色固体,接着他没有加入草酸而是加入一定量的双氧水,发现固体也完全溶解了;乙同学在加硫酸后也没有加草酸,他又加入了一定量氨水,无明显变化,测得这时溶液的pH值为9,他接着又加入双氧水,发现黑色固体不减反增,写出导致固体增加的离子方程式:____________________ ;比较甲、乙两位同学的实验,针对MnO2和H2O2氧化性的强弱,你得出的结论是:___________________________ 。
(3)操作1和操作2相同,其名称是______________ 。
(4)硫酸锰转化为碳酸锰的操作是,在60℃下调节pH值后加入碳酸氢铵溶液,直到不再有气泡产生后再加热反应1小时,写出反应的离子方程式:_______________________ 。
(5)已知锌锰干电池的总反应为Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2 +2MnOOH ,写出电池的正极反应式_____________ ;电解MnSO4溶液回收锰的阳极的电极反应式:________________ 。
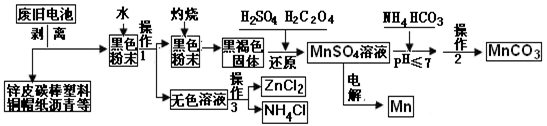

(1)灼烧黑色粉末变成黑褐色是因为有部分MnO2发生了反应生成了MnO,其可能的反应方程式为:
(2)还原过程是先加入稀硫酸再加入草酸,写出反应化学方程式:
(3)操作1和操作2相同,其名称是
(4)硫酸锰转化为碳酸锰的操作是,在60℃下调节pH值后加入碳酸氢铵溶液,直到不再有气泡产生后再加热反应1小时,写出反应的离子方程式:
(5)已知锌锰干电池的总反应为Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2 +2MnOOH ,写出电池的正极反应式
您最近一年使用:0次
13-14高三下·浙江·阶段练习
解题方法
6 . 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置_______ 。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为_________ 。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______________ 。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器_____ (填“能”或“不能”)用来腌制咸菜,原因是__________ 。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________ 。关于该电池的下列说法,正确的是_______

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:_________________

X | Y | Z | |
W |
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:

您最近一年使用:0次
7 . 铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式______________ ;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因____________________ 。
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式_________________ 。
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
______ Cu2S + ______ HNO3
______ CuSO4 + ______ Cu(NO3)2+ ______ NO↑+ ____ _______
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为____________ (填化学式)。
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:

(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为
您最近一年使用:0次
10-11高三上·四川成都·阶段练习
解题方法
8 . (Ⅰ)近年来我国对碳纳米管的研究也有了较大突破,即用电弧合成法来制碳纳米管,但往往有大量的碳纳米颗粒,需用氧化法来提纯这些颗粒,化学方程式为:

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为_______ ,被氧化的元素为________ 。
(3)H2SO4在上述反应中表现出来的性质是___ (填字母)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为__________ 。
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
_______________________________________________________
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是____ 。
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是____ 。

试回答下列问题:
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂为
(3)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若生成11 g CO2,则转移电子的数目为
(Ⅱ)2009年3月底至4月中旬,墨西哥、美国等多国接连暴发甲型H1N1型流感(或称H1N1型猪流感)疫情,随后也不断蔓延我国各地.防控专家表示,含氯消毒剂和过氧化物消毒可防甲型H1N1流感.
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在H2SO4存在下与Na2SO3溶液反应制得。请写出该反应的离子方程式:
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只被还原的是
A. MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(7)漂白剂亚氯酸钠(NaClO2)在常温于黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是
您最近一年使用:0次
2010·江苏盐城·一模
9 . 空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是___________ 。
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:
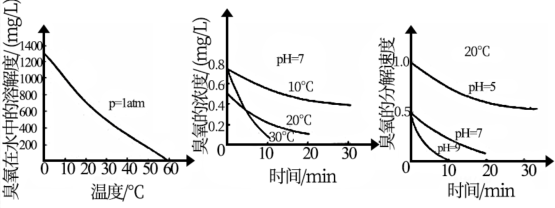
用臭氧消毒自来水,适宜的条件是_______________________ 。
(3)2O3(g)=3O2(g) △H=-285kJ/mol,2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为:_________________________ 。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式:__________________________ 。
(1)下列有关说法正确的是
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:

用臭氧消毒自来水,适宜的条件是
(3)2O3(g)=3O2(g) △H=-285kJ/mol,2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为:
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式:
您最近一年使用:0次
10 . 碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛.完成下列填空.
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.请完成并配平下述反应:
______ KI+________ CuSO4→______ I2+_______ Cu2I2↓+_______
该反应中氧化剂与还原剂的物质的量之比为__________ .
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是_______________ .
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg→Cu2HgI4(玫瑰红)+2Cu产物Cu2HgI4中,Cu元素显________ 价.当有1molCu2I2参与反应时,转移电子_________ mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是_________ (选填编号)
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.请完成并配平下述反应:
该反应中氧化剂与还原剂的物质的量之比为
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg→Cu2HgI4(玫瑰红)+2Cu产物Cu2HgI4中,Cu元素显
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
您最近一年使用:0次



