1 . 下列叙述正确的是
| A.在标准状况下,22.4L水中含有1mol H2O分子 |
| B.0.1mol Cl2被NaOH溶液充分吸收,转移电子数为0.2NA |
| C.在标准状况下,2.24L O2和CO的混合气体中含C、O原子共0.2mol |
D.0.1mol FeCl3形成Fe(OH)3胶体,Fe(OH)3胶粒的数目为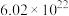 |
您最近半年使用:0次
2024-01-20更新
|
95次组卷
|
2卷引用:四川省泸州市合江县马街中学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
2 . 氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀,可用于向瓶中鼓入空气的仪器)。资料:已知常温下 固体与浓盐酸反应产生氯气。
固体与浓盐酸反应产生氯气。
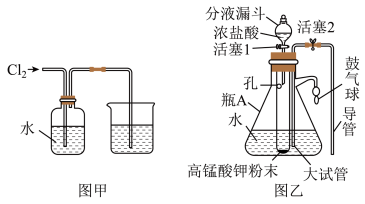
(1)写出氯气与水反应的离子方程式:___________ ;氯水中含有多种粒子,其中的分子除了水分子还有___________ (填化学式);需临时配制的原因是___________ (用化学方程式表示)。
(2)图甲所示装置中,烧杯中发生反应的离子方程式是___________ 。
(3)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞,浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水,除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是___________ 。
(4)配制氯水完成后,不必拆缷装置即可从瓶A中取用少量氯水,方法是___________ 。
(5)写出该装置制备氯气的化学方程式,并用单线桥表明电子转移情况___________ 。
 固体与浓盐酸反应产生氯气。
固体与浓盐酸反应产生氯气。
(1)写出氯气与水反应的离子方程式:
(2)图甲所示装置中,烧杯中发生反应的离子方程式是
(3)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞,浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水,除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是
(4)配制氯水完成后,不必拆缷装置即可从瓶A中取用少量氯水,方法是
(5)写出该装置制备氯气的化学方程式,并用单线桥表明电子转移情况
您最近半年使用:0次
名校
解题方法
3 . 次氯酸盐具有强氧化性。在碱性条件下,利用KClO氧化Fe(NO3)3生成高铁酸钾K2FeO4的工艺流程如下:
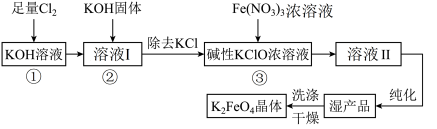
已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在___________ (填“温度较高”或“温度较低”)的情况下进行,该反应的离子方程式为___________ 。
(2)在溶液I中加入KOH固体的目的是___________ 。
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________ 。
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是___________ ;K2FeO4可用于杀菌消毒的原因是___________ 。
(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为___________ mol。

已知:6KOH+3Cl2=5KCl+KClO3+3H2O
回答下列问题:
(1)反应①应在
(2)在溶液I中加入KOH固体的目的是
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为
(4)K2FeO4可作饮用水处理剂,该反应的离子方程式:4FeO
 +10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是
+10H2O=4Fe(OH)3(体)+3O2↑+8OH-,K2FeO4处理水中悬浮颗粒物的原理是(5)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2物质的量为
您最近半年使用:0次
2024-01-19更新
|
250次组卷
|
3卷引用:四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题
解题方法
4 . 能正确表示下列反应的离子方程式为
A.硫氢化钠溶液与稀硫酸混合有气泡产生: |
B.工业生产漂白粉: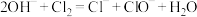 |
C. 溶液与等体积等浓度 溶液与等体积等浓度 混合: 混合: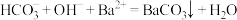 |
D.将少量 滴入 滴入 溶液中: 溶液中: |
您最近半年使用:0次
解题方法
5 . 下列反应的离子方程式正确的是
A.将铁溶于稀盐酸: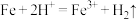 |
B.草酸钠溶液呈碱性: |
C.酸性 溶液与少量 溶液与少量 溶液混合: 溶液混合: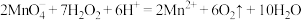 |
D.将氯气通入足量氢氧化钠溶液: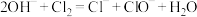 |
您最近半年使用:0次
6 . 某兴趣小组在实验室制备纯净氯气并研究氯气的漂白性,设计的装置如图:
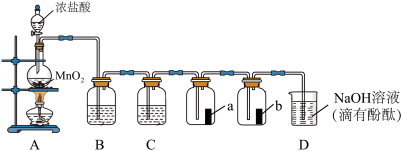
(1)盛装浓盐酸的仪器名称为_______ ,A装置中发生反应的离子方程式为_______ ,装置B的作用是_______ 。
(2)a,b均为红色布条,其中a布条为_______ 的(填“干燥”或“湿润”)。与实验目的直接相关的实验现象是_______ 。
(3)NaOH溶液的作用:_______ (用离子方程式 进行表达)
(4)化学实验中常用湿润的淀粉-碘化钾试纸检验是否有氯气产生,如果有氯气产生,可观察到的现象是_______ ,反应的化学方程式为_______ 。

(1)盛装浓盐酸的仪器名称为
(2)a,b均为红色布条,其中a布条为
(3)NaOH溶液的作用:
(4)化学实验中常用湿润的淀粉-碘化钾试纸检验是否有氯气产生,如果有氯气产生,可观察到的现象是
您最近半年使用:0次
名校
解题方法
7 . 高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂。其溶于水与水结合放出氧气并有絮状沉淀产生,常用作净水剂。其生产工艺如下:
)是一种高效多功能的新型非氯绿色消毒剂。其溶于水与水结合放出氧气并有絮状沉淀产生,常用作净水剂。其生产工艺如下:
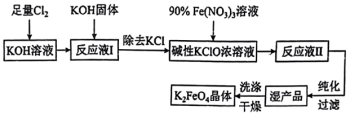
(1)高铁酸钾( )中铁元素的化合价为
)中铁元素的化合价为_______ 。
(2)写出 与KOH溶液反应的化学方程式
与KOH溶液反应的化学方程式_______ 。
(3)写出 溶液与碱性KClO溶液反应的离子方程式
溶液与碱性KClO溶液反应的离子方程式_______ 。
(4) 可作为新型多功能水处理剂的原因是
可作为新型多功能水处理剂的原因是_______ 。
(5)从“反应液Ⅱ”中分离出 后,副产品有
后,副产品有_______ (写化学式)。
(6)该工艺每得到1.98kg ,理论上消耗
,理论上消耗 的物质的量为
的物质的量为_______ mol。
 )是一种高效多功能的新型非氯绿色消毒剂。其溶于水与水结合放出氧气并有絮状沉淀产生,常用作净水剂。其生产工艺如下:
)是一种高效多功能的新型非氯绿色消毒剂。其溶于水与水结合放出氧气并有絮状沉淀产生,常用作净水剂。其生产工艺如下:
(1)高铁酸钾(
 )中铁元素的化合价为
)中铁元素的化合价为(2)写出
 与KOH溶液反应的化学方程式
与KOH溶液反应的化学方程式(3)写出
 溶液与碱性KClO溶液反应的离子方程式
溶液与碱性KClO溶液反应的离子方程式(4)
 可作为新型多功能水处理剂的原因是
可作为新型多功能水处理剂的原因是(5)从“反应液Ⅱ”中分离出
 后,副产品有
后,副产品有(6)该工艺每得到1.98kg
 ,理论上消耗
,理论上消耗 的物质的量为
的物质的量为
您最近半年使用:0次
名校
解题方法
8 . 实验室使用浓盐酸、二氧化锰共热制氯气,并用氯气和氢氧化钙反应制取少量漂白粉(该反应放热)。氯气和氢氧化钙在温度较高时会生成副产物氯酸钙,甲、乙、丙三位同学分别设计了三个实验装置如下图所示:
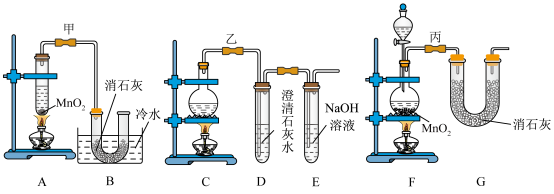
(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:___________ 。
(2)哪位同学的装置能够有效地防止副反应的发生?___________ 。
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:___________ 。
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)___________ 。
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是___________ (假定各步反应均无反应损耗且无副反应发生)。

(1)请写出实验室使用浓盐酸、二氧化锰共热制氯气的离子方程式:
(2)哪位同学的装置能够有效地防止副反应的发生?
(3)请写出氯气和氢氧化钙制备漂白粉的化学方程式:
(4)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左至右的流向)组装一套较完善的实验装置(填所选部分的字母)
(5)实验中若用12mol·L-1的浓盐酸200mL与足量二氧化锰反应,最终生成的次氯酸钙的物质的量总小于0.3mol,其可能的主要原因是
您最近半年使用:0次
2024-01-02更新
|
23次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高一上学期1月期末化学试题
9 . 氯及其化合物既是重要化工原料,又是高效、广谱消毒剂。回答下列问题:

(1)仪器Ⅰ中发生的化学反应方程式为___________ ,仪器中橡皮管的作用为___________
(2)若要利用装置Ⅱ收集纯净的 ,则需要先将装置Ⅰ中产生的气体依次通过盛装
,则需要先将装置Ⅰ中产生的气体依次通过盛装___________ (填试剂名称)、浓硫酸的洗气瓶除杂;收集 时,气体从集气瓶的
时,气体从集气瓶的___________ (选“m”或“n”)导管口进入。
(3)制得的 按照装置Ⅲ中箭头方向通入。
按照装置Ⅲ中箭头方向通入。
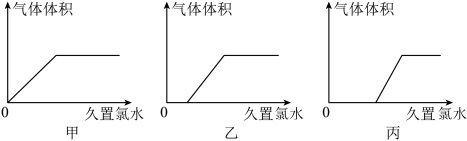
①若试剂X为水,则可制得氯水。将久置氯水滴入Na2CO3与NaHCO3的混合溶液中,以下图像能正确表示产生的气体体积与加入久置氯水的量之间的关系的是___________ (选填“甲”或“乙”或“丙”)
②若试剂X为 ,则可制得
,则可制得 的
的 溶液(
溶液( 可溶于
可溶于 ,且不与
,且不与 反应)。取稀盐酸、新制氯水、
反应)。取稀盐酸、新制氯水、 的
的 溶液,分别滴在三张红色纸条上,可观察到
溶液,分别滴在三张红色纸条上,可观察到___________ 现象,证明氯水中HClO具有漂白作用。
③若试剂X为石灰乳,则可制得漂白粉。漂白粉的有效成分为___________ ,漂白粉久置在空气中会发生变质,该过程发生反应的化学方程式为___________ 、___________ 。

(1)仪器Ⅰ中发生的化学反应方程式为
(2)若要利用装置Ⅱ收集纯净的
 ,则需要先将装置Ⅰ中产生的气体依次通过盛装
,则需要先将装置Ⅰ中产生的气体依次通过盛装 时,气体从集气瓶的
时,气体从集气瓶的(3)制得的
 按照装置Ⅲ中箭头方向通入。
按照装置Ⅲ中箭头方向通入。①若试剂X为水,则可制得氯水。将久置氯水滴入Na2CO3与NaHCO3的混合溶液中,以下图像能正确表示产生的气体体积与加入久置氯水的量之间的关系的是

②若试剂X为
 ,则可制得
,则可制得 的
的 溶液(
溶液( 可溶于
可溶于 ,且不与
,且不与 反应)。取稀盐酸、新制氯水、
反应)。取稀盐酸、新制氯水、 的
的 溶液,分别滴在三张红色纸条上,可观察到
溶液,分别滴在三张红色纸条上,可观察到③若试剂X为石灰乳,则可制得漂白粉。漂白粉的有效成分为
您最近半年使用:0次
名校
10 . I.海洋约占地球表面积的71%,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如 、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、
、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、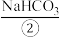 、
、 、
、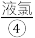 、
、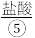 等,苦卤经过氯气氧化,热空气吹出
等,苦卤经过氯气氧化,热空气吹出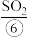 吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼
吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼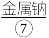 ;海底埋藏大量可燃冰
;海底埋藏大量可燃冰 是一种清洁能源。
是一种清洁能源。
(1)上述标有序号的物质中属于电解质的是___________ (填序号,下同),既不属于电解质也不属于非电解质的是___________ 。
(2)写出③溶于水的电离方程式:___________ 。
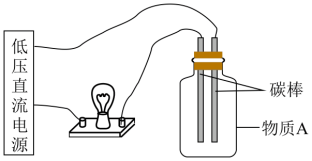
(3)在下图所示的装置里,若灯泡亮,广口瓶内的物质A可以是___________ 。(填序号)
(4) 能被水吸收制备次氯酸(HClO),从物质分类的角度看,
能被水吸收制备次氯酸(HClO),从物质分类的角度看, 属于
属于___________ (填“酸性氧化物”、“碱性氧化物”或“不成盐氧化物”)
Ⅱ.海水中的有丰富的卤素资源。地球是一颗蓝色星球,浩瀚的海洋覆盖了70%以上的地球表面,是蕴藏着极为丰富化学资源的“聚宝盆”,其中氯化物含量很高,氯和同族的氟、溴、碘、砹总称为卤素。
(5)将氯气分别通入含下列离子的溶液中,离子浓度减小的是___________。
(6)氯气的水溶液即氯水,某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是___________。
(7)将氯气通入热的NaOH溶液中,反应得到NaCl, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的个数之比为4∶1,写出该反应总的离子方程式:
的个数之比为4∶1,写出该反应总的离子方程式:___________ 。
 、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、
、MgSO4等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和食盐水用以生产NaOH、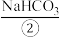 、
、 、
、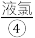 、
、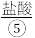 等,苦卤经过氯气氧化,热空气吹出
等,苦卤经过氯气氧化,热空气吹出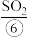 吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼
吸收等一系列操作可获得Br2.电解熔融氯化钠可冶炼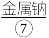 ;海底埋藏大量可燃冰
;海底埋藏大量可燃冰 是一种清洁能源。
是一种清洁能源。(1)上述标有序号的物质中属于电解质的是
(2)写出③溶于水的电离方程式:
(3)在下图所示的装置里,若灯泡亮,广口瓶内的物质A可以是

(4)
 能被水吸收制备次氯酸(HClO),从物质分类的角度看,
能被水吸收制备次氯酸(HClO),从物质分类的角度看, 属于
属于Ⅱ.海水中的有丰富的卤素资源。地球是一颗蓝色星球,浩瀚的海洋覆盖了70%以上的地球表面,是蕴藏着极为丰富化学资源的“聚宝盆”,其中氯化物含量很高,氯和同族的氟、溴、碘、砹总称为卤素。
(5)将氯气分别通入含下列离子的溶液中,离子浓度减小的是___________。
A. | B. | C.Mg2+ | D. |
(6)氯气的水溶液即氯水,某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是___________。

| A.图1表示氯水pH随时间的变化 |
| B.图2表示溶液中氯离子浓度随时间的变化 |
| C.图3表示氯水的电导率随时间的变化 |
| D.图4表示液面上方氧气体积分数随时间的变化 |
(7)将氯气通入热的NaOH溶液中,反应得到NaCl,
 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的个数之比为4∶1,写出该反应总的离子方程式:
的个数之比为4∶1,写出该反应总的离子方程式:
您最近半年使用:0次



