19-20高一下·江苏南通·阶段练习
名校
1 . 某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:
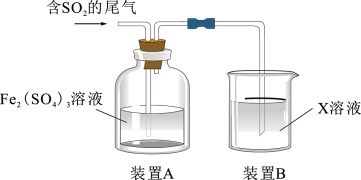
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的离子反应方程式:_______ 。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为_______ ;若要检验SO2是否过量,可用试剂为_______ 。
(3)装置B中所用X溶液为_______ ,作用是_______ 。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00mL装置A中溶液,向其中逐滴加入0.1000mol·L-1Ce(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00mL。请通过计算确定FeSO4的物质的量浓度____ 。

(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的离子反应方程式:
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为
(3)装置B中所用X溶液为
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00mL装置A中溶液,向其中逐滴加入0.1000mol·L-1Ce(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00mL。请通过计算确定FeSO4的物质的量浓度
您最近一年使用:0次
2021-05-29更新
|
198次组卷
|
6卷引用:北京市第八中学2022-2023学年高一下学期期中考试(选考班)化学试题
北京市第八中学2022-2023学年高一下学期期中考试(选考班)化学试题(已下线)江苏省如皋市2019-2020学年高一下学期教学质量调研(二)化学(必修)试题北京市首都师范大学附属中学2019-2020学年高一下学期结业考试(期末)化学试题人教版2019必修第二册 第五章 第一节 第3课时 不同价态含硫物质的转化云南省梁河县第一中学2020-2021学年高一下学期第一次月考化学试题(已下线)江苏省如皋市2020-2021学年高一下学期第三次调研考试化学(必)试题
2 . 现有下列4种物质:①SiO2、②NH3、③Na2CO3、④FeCl3溶液。其中,遇到KSCN溶液时变成红色的是_______ (填序号,下同);可用于制光导纤维的是_______ ;可用作制冷剂的是_______ ;可用作食用碱的是_______ 。
您最近一年使用:0次
名校
解题方法
3 . 下列实验中,现象或结论都正确的是
| 实验 | 现象 | 结论 | |
| A | 向2 mL 0.01mol/L的 FeCl3溶液中加入1滴KSCN溶液,再加入足量铁粉,充分振荡 | 溶液变为红色,加入铁粉后红色褪去,变为浅绿色 | Fe3+比Fe2+的氧化性强 |
| B | 将一小块金属钠放置在空气中,一段时间后,将其放置在坩埚中加热 | 钠表面变暗,加热时,钠燃烧,发出黄色火焰 | 钠易与氧气反应生成Na2O,加热时速率加快 |
| C | 加热盛有少量NH4Cl固体的试管,并在试管口放置湿润的红色石蕊试纸 | 湿润的红色石蕊试纸逐渐变蓝 | NH4Cl分解产生氨气 |
| D | 将碳与浓硫酸反应后的气体先通入到品红,再通入澄清石灰水中 | 品红褪色,澄清石灰水变浑浊 | 碳与浓硫酸反应生成SO2和CO2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 下列除杂试剂选用正确且除杂过程不涉及 氧化还原反应的是
| 物质(括号内为杂质) | 除杂试剂 | |
| A |  ( ( ) ) | 铁粉 |
| B | SiO2(Al2O3) | 盐酸 |
| C | CO2(SO2) | 饱和碳酸钠溶液 |
| D | NO ( ) ) | 水、无水氯化钙 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10-11高三上·吉林长春·期中
名校
解题方法
5 . 把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的溶度恰好相等,则未反应的Fe3+和已反应的Fe3+的物质的量的比为
| A.1∶1 | B.1∶2 | C.3∶2 | D.2∶3 |
您最近一年使用:0次
2021-04-15更新
|
1217次组卷
|
85卷引用:2013-2014学年北京市西城区高一上学期期末考试化学试卷
(已下线)2013-2014学年北京市西城区高一上学期期末考试化学试卷(已下线)吉林省长春市十一高中2010-2011学年度高三上学期期中考(已下线)2011届陕西省西安交大阳光中学高三上学期期中考试化学卷(已下线)2010年福建省三明一中高一上学期期中考试化学卷(已下线)2010年上海市吴淞中学高二上学期期中考试化学试卷(已下线)2010—2011学年海南省洋浦中学高一上学期期末考试化学试卷(已下线)2011-2012学年甘肃省武威第五中学高一期末考试化学试卷(已下线)2011-2012学年江西省赣州市信丰县信丰中学高一第二次月考化学试卷(已下线)2011-2012学年甘肃省白银市平川中恒学校高一上学期期末考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高一上学期期末考试文科化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一上学期期末考试化学试卷(已下线)2011—2012学年海南省洋浦中学高一第一学期期末考试化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2012-2013学年福建省福清东张中学高一上学期期末考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高一上学期期末考试化学试卷(已下线)2013-2014学年福建省厦门市高一上学期期末质量检测模拟化学试卷(已下线)2012-2013湖北省孝感高中高一上学期期末考试化学试卷(已下线)2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷2014-2015辽宁省大连市第二十高中高一上学期期末化学试卷2014-2015江苏省涟水中学高一12月月考化学试卷2014-2015陕西省西安市一中高一上学期期末化学试卷2014-2015四川省乐山市高一年级上学期期末考试化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2015-2016学年河北省永年二中高一上学期12月月考化学试卷2015-2016学年四川阆中中学校高一上第二次段考化学试卷2015-2016学年陕西省西安一中高一上12月月考化学试卷2015-2016学年湖北省宜昌市部分示范高中高一上期末联考化学试卷2016-2017学年浙江省余姚中学高一上期中化学试卷2016-2017学年山东省枣庄八中高一12月月考化学卷重庆市第一中学2016-2017学年高一上学期期末考试化学试题2016-2017学年江西省南昌市第十中学高一上学期期末考试化学试卷云南省峨山彝族自治县第一中学2016-2017学年高二下学期期末考试化学试题山西省忻州市第一中学2016-2017学年高一必修一:3.2.3几种重要的金属化合物同步练习化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二10月月考(文)化学试题江苏省东台市创新学校2018届高三10月月考化学试题甘肃省甘谷县第一中学2017-2018学年高一上学期第二次月考化学试题上海杨浦高级中学2017-2018学年高二上学期12月月考化学试题湖北省宜昌市长阳县第一高级中学2017-2018学年高一12月月考化学试题山西省太原市成成中学校2017-2018学年高一12月月考化学试题宁夏育才中学2017-2018学年高一上学期期末考试化学试题新疆昌吉市2017-2018学年高一上学期期末考试化学试题天津市和平区2017-2018学年高一上学期期末考试化学试题江西省临川实验学校2017-2018学年高一上学期期末质量检测化学试题云南省玉溪第一中学2017-2018学年高一上学期期末考试化学试题河南省开封市兰考县第三高级中学2017-2018学年高一上学期期末考试化学试卷陕西省黄陵中学2017-2018学年高一(普通班)下学期开学考试化学试题2018-2019学年苏教版高中化学必修一 专题综合测评3【全国百强校】山东省泰安市第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题山西省忻州市实验中学2018-2019学年高一上学期第三次教学质量检测化学试题河南省封丘县一中2018-2019学年高一上学期12月月考化学试题山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题山西省晋中市平遥县第二中学2018-2019学年高一上学期12月月考化学试题河南省永城市实验高级中学2019届高三上学期期中考试化学试题甘肃省白银市会宁县第一中学2018届高三上学期期中考试化学试题吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高一12月月考化学试题四川省三台中学2019-2020学年高一上学期第三次月考化学试题云南省兰坪县第一中学2019-2020学年高一上学期期末考试化学试题陕西省西安中学2019-2020学年高一上学期期末考试化学试题鲁科版高中化学必修1第二章《元素与物质世界》测试卷广东省梅州市蕉岭县蕉岭中学2019—2020学年高一上学期期末考试化学试题四川省眉山市2019-2020学年高一上学期期末教学质量检测化学试题湖北省荆州市2019-2020学年高一上学期期末考试化学试题上海市闵行区向明世博中学2018-2019学年高二上学期期中考试化学试题河南省焦作市沁阳市第一中学2019-2020学年高一上学期12月月考化学试题陕西省咸阳市实验中学2019-2020学年高一上学期第三次月考化学试题山东省枣庄市2019-2020学年高一下学期期末考试化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第03章 铁 金属材料(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性重庆市铜梁中学校等七校2019-2020学年高一上学期期末联考化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮(已下线)3.1.1 铁的单质-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)宁夏石嘴山市平罗中学2020-2021学年高一上学期第三次月考化学试题甘肃省兰州市第一中学2020-2021学年高一上学期期末考试化学(文)试题湖南省常德市石门县第六中学2019-2020学年高一下学期第三次月考化学试题云南省梁河县第一中学2020-2021学年高一上学期第二次月考化学试题宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题广西南宁市邕宁高中2020-2021学年高一上学期期末考试化学试题江西省抚州市金溪县第一中学2020-2021学年高一上学期第二次月考化学试题云南省楚雄中学2020-2021学年高一下学期4月月考化学试题甘肃省武威市民勤县第四中学2020-2021学年高一下学期第一次月考化学(实验班)试题(已下线)专题08 铁及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练
名校
6 . 某小组同学根据 、
、 和
和 的氧化性推出溶液中
的氧化性推出溶液中 与
与 可能先后发生两个反应:
可能先后发生两个反应: ,
, ,进行如下实验。
,进行如下实验。
(1)取实验Ⅰ反应后的少量溶液,滴加几滴 溶液,生成
溶液,生成_______ ,证明有 。
。
(2)结合化学用语解释实验Ⅱ中产生红褐色浑浊的原因:_______ 。
(3)实验Ⅲ,用 溶液和
溶液和 溶液替代实验Ⅱ中的
溶液替代实验Ⅱ中的 溶液:
溶液:
资料: ,
, 在溶液中呈棕色。
在溶液中呈棕色。
①a=_______ 。
②有人认为Ⅰ中深棕色溶液中存在 ,设计实验证明。实验的操作和现象是
,设计实验证明。实验的操作和现象是_______ 。
③对照实验Ⅱ和Ⅲ, 溶液与过量锌粉反应没有生成铁的原因是
溶液与过量锌粉反应没有生成铁的原因是_______ 。
(4)实验Ⅳ:将实验Ⅱ中 水溶液换成
水溶液换成 无水乙醇溶液,加入足量锌粉,刻后,反应放热,有大量铁产生。由实验Ⅰ~Ⅳ可知:锌能否与
无水乙醇溶液,加入足量锌粉,刻后,反应放热,有大量铁产生。由实验Ⅰ~Ⅳ可知:锌能否与 反应得到单质铁,与
反应得到单质铁,与 和
和 的物质的量、
的物质的量、 的浓度、
的浓度、_______ 、_______ 等有关。
 、
、 和
和 的氧化性推出溶液中
的氧化性推出溶液中 与
与 可能先后发生两个反应:
可能先后发生两个反应: ,
, ,进行如下实验。
,进行如下实验。| 实验 | 试剂 | 现象 |
| Ⅰ |  溶液、过量锌粉 溶液、过量锌粉 | 黄色溶液很快变浅,接着有无色气泡产生,固体中未检出铁 |
| Ⅱ |  的 的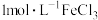 溶液、过量锌粉 溶液、过量锌粉 | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 |
 溶液,生成
溶液,生成 。
。(2)结合化学用语解释实验Ⅱ中产生红褐色浑浊的原因:
(3)实验Ⅲ,用
 溶液和
溶液和 溶液替代实验Ⅱ中的
溶液替代实验Ⅱ中的 溶液:
溶液:| 实验 | 试剂 | 现象 |
| Ⅰ |  的 的 溶液、过量锌粉 溶液、过量锌粉 | 约半小时后,溶液变为深棕色且浑浊,无铁产生 |
| Ⅱ |  的 的 溶液、过量锌粉 溶液、过量锌粉 | 约半小时后,溶液呈浅绿色且浑浊,有少量铁产生 |
 ,
, 在溶液中呈棕色。
在溶液中呈棕色。①a=
②有人认为Ⅰ中深棕色溶液中存在
 ,设计实验证明。实验的操作和现象是
,设计实验证明。实验的操作和现象是③对照实验Ⅱ和Ⅲ,
 溶液与过量锌粉反应没有生成铁的原因是
溶液与过量锌粉反应没有生成铁的原因是(4)实验Ⅳ:将实验Ⅱ中
 水溶液换成
水溶液换成 无水乙醇溶液,加入足量锌粉,刻后,反应放热,有大量铁产生。由实验Ⅰ~Ⅳ可知:锌能否与
无水乙醇溶液,加入足量锌粉,刻后,反应放热,有大量铁产生。由实验Ⅰ~Ⅳ可知:锌能否与 反应得到单质铁,与
反应得到单质铁,与 和
和 的物质的量、
的物质的量、 的浓度、
的浓度、
您最近一年使用:0次
2021-04-09更新
|
682次组卷
|
5卷引用:北京市西城区2021届高三一模化学试题
北京市西城区2021届高三一模化学试题北京市第四十三中学2021-2022学年高三上学期12月月考化学试题(已下线)押全国卷理综第26题 实验综合-备战2021年高考化学临考题号押题(课标全国卷)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)广东省广州市科学城中学2022-2023学年高三第二次(10月)月考化学试题
名校
解题方法
7 . 用覆铜板制作印刷电路板时,常用 FeCl3 溶液作腐蚀液。某化学兴趣小组在实验室进行了模拟。
【模拟实验 I】
向盛有 4mL 0.2mol/L FeCl3 溶液的试管中,加入一块铜片(Cu 过量),反应一段时间后,溶液黄色褪去。
【分析解释】
(1)FeCl3 与 Cu 反应的离子方程式是___________ 。
(2)为检验反应生成的 Fe2+,最宜选择的试剂是___________ (填字母)。
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液
【继续实验 II】
为验证上述实验中 Fe3+是否完全反应,该小组同学取上层清液于另一支试管中, 滴入 3 滴 0.1mol/L KSCN 溶液。结果发现,上层清液中立即产生白色沉淀,同时滴入处局部出现红色,振荡后红色立即消失。
【查阅资料】
为解释该异常现象产生的原因,同学们查阅资料得知:
①2CuCl2+4KSCN=2CuSCN↓+(SCN)2+4KCl;
②CuSCN为白色固体,几乎不溶于水;
③(SCN)2与Cl2 性质相似。
【继续实验 III】
【分析解释】
(3)实验 II 中白色沉淀的成分是___________ (填化学式)。
(4)请结合资料,用离子方程式解释实验II中“滴入 KSCN 溶液处局部出现红色”的原因_______ 。
【模拟实验 I】
向盛有 4mL 0.2mol/L FeCl3 溶液的试管中,加入一块铜片(Cu 过量),反应一段时间后,溶液黄色褪去。
【分析解释】
(1)FeCl3 与 Cu 反应的离子方程式是
(2)为检验反应生成的 Fe2+,最宜选择的试剂是
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液
【继续实验 II】
为验证上述实验中 Fe3+是否完全反应,该小组同学取上层清液于另一支试管中, 滴入 3 滴 0.1mol/L KSCN 溶液。结果发现,上层清液中立即产生白色沉淀,同时滴入处局部出现红色,振荡后红色立即消失。
【查阅资料】
为解释该异常现象产生的原因,同学们查阅资料得知:
①2CuCl2+4KSCN=2CuSCN↓+(SCN)2+4KCl;
②CuSCN为白色固体,几乎不溶于水;
③(SCN)2与Cl2 性质相似。
【继续实验 III】
| 实验方案 | 现象 | |
| 步骤 1 | 取 4mL 0.2mol/L 的 FeCl2 溶液,向其中滴加 3 滴 0.1mol/L 的 KSCN 溶液。 | 无明显现象 |
| 步骤 2 | 取 4mL 0.1mol/L 的 CuCl2 溶液,向其中滴加 3 滴 0.1mol/L 的 KSCN 溶液。 | 产生白色沉淀 |
(3)实验 II 中白色沉淀的成分是
(4)请结合资料,用离子方程式解释实验II中“滴入 KSCN 溶液处局部出现红色”的原因
您最近一年使用:0次
2021-02-01更新
|
795次组卷
|
3卷引用:北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题
8 . 下列溶液中离子检验的方法不正确的是
| 选项 | 离子 | 检验方法及现象 |
| A | H+ | 向溶液中滴加石蕊溶液,溶液变为红色 |
| B | SO | 向溶液中滴加 BaCl2 溶液,出现白色沉淀 |
| C | Fe3+ | 向溶液中滴加 KSCN 溶液,溶液变为红色 |
| D | Cl- | 向溶液中滴加硝酸酸化的AgNO3 溶液,出现白色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-02-01更新
|
511次组卷
|
2卷引用:北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题
名校
解题方法
9 . 下列过程的现象与氧化还原反应有关的是
| A.氨气遇氯化氢气体,产生白烟 |
| B.Cu片投入浓HNO3中,产生红棕色气体 |
| C.FeCl3溶液中滴入KSCN溶液后,溶液变为红色 |
| D.NaCl溶液中滴入HNO3酸化的AgNO3溶液,产生白色沉淀 |
您最近一年使用:0次
2020-09-09更新
|
116次组卷
|
3卷引用:北京市第四十三中学2021届高三上学期12月月考化学试题
名校
解题方法
10 . 某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
下列说法不正确的是( )
| 序号 | I | II | III |
| 实验步骤 | 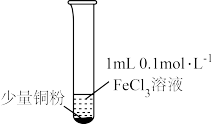 充分振荡,加2mL蒸馏水 |  充分振荡,加入2mL蒸馏水 | 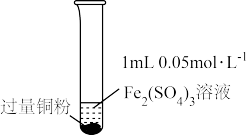 充分振荡,加入2mL蒸馏水 |
| 实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
| A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+ |
| B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关 |
| C.实验I、III中加入蒸馏水后c(Cu2+)相同 |
| D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀 |
您最近一年使用:0次
2020-07-06更新
|
226次组卷
|
7卷引用:北京师范大学附属实验中学 2019-2020 学年高一下学期 AR 层线上测试化学试题



