1 . Ti、Na、Mg、C、N、O、Fe等元素单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式___________ 。
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.原子吸收光谱 B.原子发射光谱
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:___________ 。为防止钢铁输水管的腐蚀,可用导线将其与镁块连接,这种防护方法为___________ 。(电化学保护法中的一种)
(5)基态 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为___________ ,其价电子轨道表示式为___________ 。
(6)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是___________ 。
(1)已知C、CO的燃烧热分别为393.5kJ/mol和283.0kJ/mol,写出碳不完全燃烧生成CO的热化学方程式
(2)Na、Mg、C、N、O的第一电离能由大到小的顺序为
(3)钠在火焰上灼烧产生的黄光是一种
A.原子吸收光谱 B.原子发射光谱
(4)钢铁发生吸氧腐蚀时正极的电极反应式为:
(5)基态
 原子最高能层的原子轨道形状为
原子最高能层的原子轨道形状为(6)用琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是
您最近一年使用:0次
2 . 草酸锰晶体(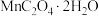 )是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:
)是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:
已知:①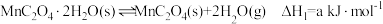
②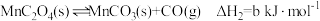
③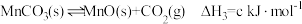
(1)
___________  。(用含a、b、c的代数式表示)
。(用含a、b、c的代数式表示)
(2)在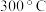 时,向密闭真空容器中加入足量
时,向密闭真空容器中加入足量 粉末,只发生反应③,达到平衡时测得
粉末,只发生反应③,达到平衡时测得 浓度为
浓度为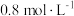 。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得
。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得 ,浓度等于___________(填标号)。
,浓度等于___________(填标号)。
(3)草酸锰在不同催化剂(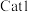 和
和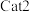 )作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为
)作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为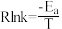 (
( 为活化能)。
为活化能)。___________ (填“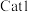 ”或“
”或“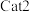 ”),判断的依据是
”),判断的依据是___________ 。
(4)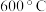 下,向恒容密闭容器中加入足量的
下,向恒容密闭容器中加入足量的 粉末及充入
粉末及充入 氧气,起始压强为
氧气,起始压强为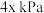 ,发生反应:
,发生反应:  ,经
,经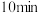 达到平衡,此时测得混合气体平均相对分子质量为41。
达到平衡,此时测得混合气体平均相对分子质量为41。
①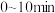 内O2分压变化率为
内O2分压变化率为___________ 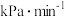 。
。
②此温度下,该反应的压强平衡常数
___________ 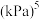 。
。
提示:用分压计算的平衡常数叫压强平衡常数 ,分压=总压×物质的量分数。
,分压=总压×物质的量分数。
(5)研究发现,碳酸盐 分解机理如下:①
分解机理如下:①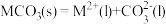 ,②
,②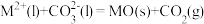 ,
,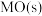 稳定性强弱决定
稳定性强弱决定 分解温度,即
分解温度,即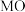 越稳定,越容易发生反应②,
越稳定,越容易发生反应②, 分解温度越低。已知:
分解温度越低。已知: 、
、 的半径依次为
的半径依次为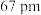 、
、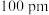 ,
, 、
、 的分解温度依次为
的分解温度依次为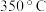 、
、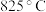 。试用结构理论解释
。试用结构理论解释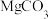 的分解温度远低于
的分解温度远低于 的原因:
的原因:___________ 。
(6)一定质量的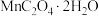 在空气中灼烧,固体质量与温度的关系如图。
在空气中灼烧,固体质量与温度的关系如图。___________ 。
②de段的化学方程式为___________ 。
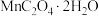 )是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:
)是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:已知:①
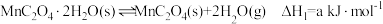
②
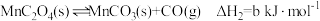
③
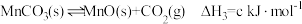
(1)

 。(用含a、b、c的代数式表示)
。(用含a、b、c的代数式表示)(2)在
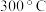 时,向密闭真空容器中加入足量
时,向密闭真空容器中加入足量 粉末,只发生反应③,达到平衡时测得
粉末,只发生反应③,达到平衡时测得 浓度为
浓度为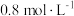 。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得
。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得 ,浓度等于___________(填标号)。
,浓度等于___________(填标号)。A.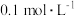 | B.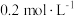 | C.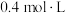 | D.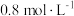 |
(3)草酸锰在不同催化剂(
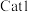 和
和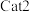 )作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为
)作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为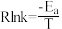 (
( 为活化能)。
为活化能)。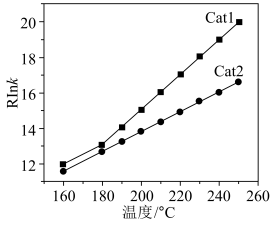
 ”或“
”或“ ”),判断的依据是
”),判断的依据是(4)
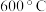 下,向恒容密闭容器中加入足量的
下,向恒容密闭容器中加入足量的 粉末及充入
粉末及充入 氧气,起始压强为
氧气,起始压强为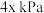 ,发生反应:
,发生反应:  ,经
,经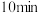 达到平衡,此时测得混合气体平均相对分子质量为41。
达到平衡,此时测得混合气体平均相对分子质量为41。①
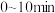 内O2分压变化率为
内O2分压变化率为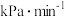 。
。②此温度下,该反应的压强平衡常数

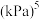 。
。提示:用分压计算的平衡常数叫压强平衡常数
 ,分压=总压×物质的量分数。
,分压=总压×物质的量分数。(5)研究发现,碳酸盐
 分解机理如下:①
分解机理如下:①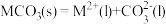 ,②
,②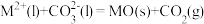 ,
,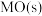 稳定性强弱决定
稳定性强弱决定 分解温度,即
分解温度,即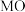 越稳定,越容易发生反应②,
越稳定,越容易发生反应②, 分解温度越低。已知:
分解温度越低。已知: 、
、 的半径依次为
的半径依次为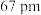 、
、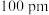 ,
, 、
、 的分解温度依次为
的分解温度依次为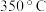 、
、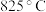 。试用结构理论解释
。试用结构理论解释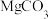 的分解温度远低于
的分解温度远低于 的原因:
的原因:(6)一定质量的
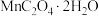 在空气中灼烧,固体质量与温度的关系如图。
在空气中灼烧,固体质量与温度的关系如图。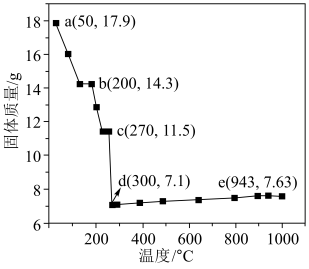
②de段的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.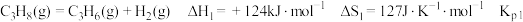
ⅱ.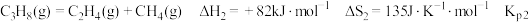
ⅲ.
已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数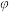 见下表。
见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ_____ 反应 ⅱ(填“>”或“<”)。
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:_____ 。
②平衡体系中检测不到 ,可认为存在反应:
,可认为存在反应: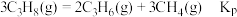 ,下列相关说法正确的是
,下列相关说法正确的是_____ (填标号)。
a.
b.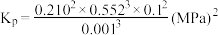
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性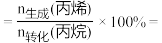
_____ (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:ⅳ.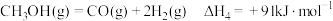 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。 时,体系总反应:
时,体系总反应: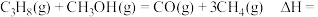
______  。
。
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是______ 。
ⅰ.
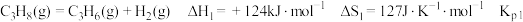
ⅱ.
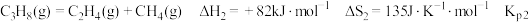
ⅲ.

已知:
 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数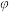 见下表。
见下表。| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:
②平衡体系中检测不到
 ,可认为存在反应:
,可认为存在反应: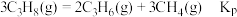 ,下列相关说法正确的是
,下列相关说法正确的是a.

b.
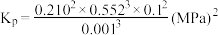
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性
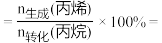
(3)丙烷甲醇共进料时,还发生反应:ⅳ.
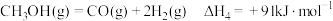 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。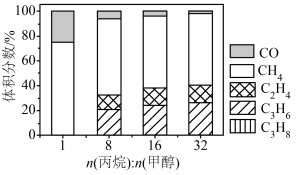
 时,体系总反应:
时,体系总反应: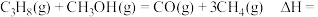
 。
。②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
您最近一年使用:0次
4 . CH3OH是重要的能源物质,CO2转化为甲醇是一种有效减少CO2排放的方法。
(1) 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,
该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ

反应Ⅲ
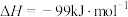
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)向恒温2L容器中充入一定量 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
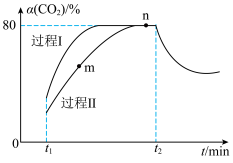
下列说法正确的是___________(填序号)。
(3)在25℃和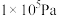 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
①压强从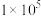 到
到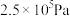 ,平衡
,平衡___________ (填“正向”“逆向”或“不”)移动;
②压强从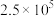 到
到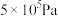 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是___________ 。
(4)在温度 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,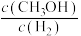
___________  (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)
(5)温度为 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为___________ 。
反应Ⅰ
反应Ⅱ
反应Ⅲ
(1)
 加氢制甲醇过程中发生的主要反应为反应Ⅰ
加氢制甲醇过程中发生的主要反应为反应Ⅰ  ,
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步实现。
反应Ⅱ


反应Ⅲ

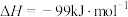
若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A.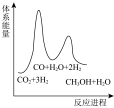 | B.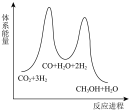 | C. | D. |
(2)向恒温2L容器中充入一定量
 和
和 ,发生反应
,发生反应
 。图中过程Ⅰ、Ⅱ是在不同催化剂作用下
。图中过程Ⅰ、Ⅱ是在不同催化剂作用下 的转化率
的转化率 随时间(t)的变化曲线。
随时间(t)的变化曲线。
下列说法正确的是___________(填序号)。
A.m点: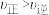 |
B. 时刻改变的反应条件可能是增大水蒸气的浓度 时刻改变的反应条件可能是增大水蒸气的浓度 |
| C.活化能:过程Ⅱ<过程Ⅰ |
D. 时刻改变的反应条件可能是降低温度 时刻改变的反应条件可能是降低温度 |
(3)在25℃和
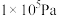 的条件下,发生反应
的条件下,发生反应 ,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。
,反应建立平衡后,再逐步增大体系的压强。表中列出了不同压强下平衡时物质CO的浓度。| 压强(Pa) | 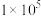 | 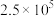 | 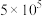 |
浓度( ) ) | 0.08 | 0.20 | 0.44 |
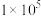 到
到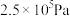 ,平衡
,平衡②压强从
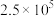 到
到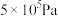 ,浓度从0.20变为
,浓度从0.20变为 的原因是
的原因是(4)在温度
 、容积2L的密闭容器中加入1mol
、容积2L的密闭容器中加入1mol 和3mol
和3mol 发生如下反应:
发生如下反应: ,平衡后
,平衡后 的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol
的体积分数为50%。若在相同温度,相同体积的容器中加入2.4mol 、4.2mol
、4.2mol 、1mol
、1mol 、2mol
、2mol ,平衡后,
,平衡后,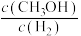
 (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)(5)温度为
 时,在容积为2L的密闭容器中加入1mol
时,在容积为2L的密闭容器中加入1mol 和3mol
和3mol 发生下列反应,平衡时
发生下列反应,平衡时 的物质的量为0.5mol。反应开始时与平衡时压强之比为
的物质的量为0.5mol。反应开始时与平衡时压强之比为反应Ⅰ

反应Ⅱ

反应Ⅲ

您最近一年使用:0次
解题方法
5 . 合成氨工业和硫酸工业在国民经济中占有重要地位。
(1)在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO其反应为:[Cu(NH3)2]++CO+NH3 [Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是
[Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是_______ 。
(2)将等物质的量的H2和N2通入绝热恒容密闭容器中发生反应N2(g)+3H2(g) 2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。
2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。
接触法制硫酸的关键反应为SO2的催化氧化,二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。SO2的催化氧化热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=akJ·mol-1其催化机理分为三步:
2SO3(g) △H=akJ·mol-1其催化机理分为三步:
第1步:SO2(g)+V2O5(s) SO3(g)+V2O4(s) △H=bkJ·mol-1
SO3(g)+V2O4(s) △H=bkJ·mol-1
第2步:V2O4(s)+O2(g)+2SO2(g) 2VOSO4(s) △H=ckJ·mol-1
2VOSO4(s) △H=ckJ·mol-1
第3步:_______。
(3)第3步热化学方程式_______ (△H的值用a、b、c的代数式表示)。
(4)T℃时,将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。3min时反应达到平衡,此时测得O2还剩余0.1mol。则达平衡时SO2的转化率为_______ ;从反应开始至达到平衡,用SO3表示反应速率为_______ 。
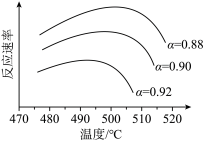
(5)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是_______。
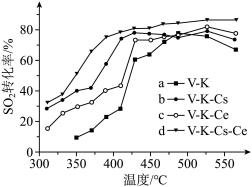
(6)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是_______ (填标号)。
(7)设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=_______ (用平衡分压代替平衡浓度计算)。
(1)在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO其反应为:[Cu(NH3)2]++CO+NH3
 [Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是
[Cu(NH3)3CO]+ △H<0。吸收CO后的铜氨液经过适当处理可再生,恢复其吸收CO的能力,可循环使用。铜氨液再生适宜的生产条件是(2)将等物质的量的H2和N2通入绝热恒容密闭容器中发生反应N2(g)+3H2(g)
 2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。
2NH3(g) △H<0,下列选项表明反应一定已达平衡状态的是_______(填标号,下同)。| A.容器内的压强不再变化 |
| B.相同时间内,断开H-H键的数目和生成N-H键的数目相等 |
| C.容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2 |
| D.N2的体积分数不再发生变化 |
接触法制硫酸的关键反应为SO2的催化氧化,二氧化硫在V2O5作用下的催化氧化是工业上生产硫酸的主要反应。SO2的催化氧化热化学方程式为:2SO2(g)+O2(g)
 2SO3(g) △H=akJ·mol-1其催化机理分为三步:
2SO3(g) △H=akJ·mol-1其催化机理分为三步:第1步:SO2(g)+V2O5(s)
 SO3(g)+V2O4(s) △H=bkJ·mol-1
SO3(g)+V2O4(s) △H=bkJ·mol-1第2步:V2O4(s)+O2(g)+2SO2(g)
 2VOSO4(s) △H=ckJ·mol-1
2VOSO4(s) △H=ckJ·mol-1第3步:_______。
(3)第3步热化学方程式
(4)T℃时,将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。3min时反应达到平衡,此时测得O2还剩余0.1mol。则达平衡时SO2的转化率为
(5)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是_______。

| A.温度越高,反应速率越大 |
| B.可根据不同α下的最大速率,选择最佳生产温度 |
| C.α=0.88的曲线代表平衡转化率 |
| D.α越大,反应速率最大值对应温度越低 |
(6)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如图所示,催化性能最佳的是

(7)设O2的平衡分压为p,SO2的平衡转化率为α,用含p和α的代数式表示上述催化氧化反应的Kp=
您最近一年使用:0次
名校
解题方法
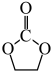
6 . 处理、回收CO是环境科学家研究的热点课题。
(1)环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K= ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:___________ 。
(2)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g) CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
①a=___________ kJ·mol-1,改变下列“量”,一定会引起ΔH发生变化的是___________ (填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:___________ ;(写化学方程式)
第二步:FeO++CO=Fe++CO2。
(3)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g) 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。___________ 。
②在此温度下,该可逆反应的平衡常数K=___________ (用含x的代数式表示)。
(4)工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250 ℃发生反应:CO(g)+2H2(g) CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___________ 。
(1)环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K=
 ,写出此反应的热化学方程式:
,写出此反应的热化学方程式:(2)CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g)
 CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1,几种物质的相对能量如下:| 物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
| 相对能量/kJ·mol-1 | 475.5 | 283 | a | 393.5 |
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:
第二步:FeO++CO=Fe++CO2。
(3)在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g)
 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。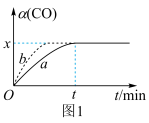
②在此温度下,该可逆反应的平衡常数K=
(4)工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2,在250 ℃发生反应:CO(g)+2H2(g)
 CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是
CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是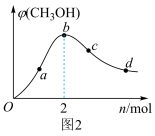
您最近一年使用:0次
2023-10-26更新
|
217次组卷
|
3卷引用:湖北省武汉市第四中学2023-2024学年高二上学期10月月考化学试题
7 . Fe、Co、Cu等金属在回收利用 和污水处理等多个领域都具有应用价值。回答下列问题:
和污水处理等多个领域都具有应用价值。回答下列问题:
(1) 在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
 (g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g)
(g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g) 
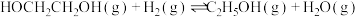
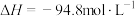
获取乙二醇的反应历程可分为如下2步:
I.
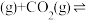
 (g)
(g) 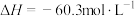
II.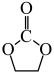 加氢生成乙二醇与甲醇。
加氢生成乙二醇与甲醇。
①步骤II的热化学方程式是:_______ 。
②研究反应温度对EC加氢的影响(反应时间均为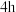 ),实验数据见下表:
),实验数据见下表:
由上表可知,温度越高,EC的转化率越高,原因是_______ 。温度升高到220℃时,乙二醇的产率反而降低,原因是_______ 。
(2)多晶 是目前唯一被实验证实能高效催化
是目前唯一被实验证实能高效催化 还原为烃类(如
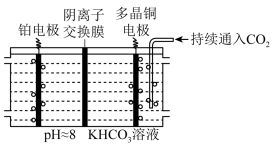
还原为烃类(如 )的金属。如图所示,电解装置中分别以多晶
)的金属。如图所示,电解装置中分别以多晶 和
和 为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后
为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后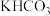 浓度基本保持不变,温度控制在10℃左右,生成
浓度基本保持不变,温度控制在10℃左右,生成 的电极反应式为
的电极反应式为_______ 。
(3) 与
与 反应如果用
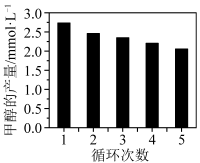
反应如果用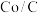 作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将
作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将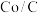 催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因:
催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因:_______ 。(Co的性质与 相似)
相似)
(4)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。
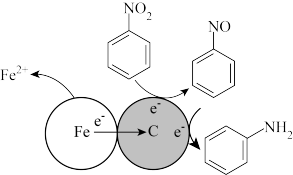
该物质转化示意图可以描述为_______ 。
 和污水处理等多个领域都具有应用价值。回答下列问题:
和污水处理等多个领域都具有应用价值。回答下列问题:(1)
 在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
在金属催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。 (g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g)
(g)+CO2(g)+3H2(g)⇌HOCH2CH2OH(g)+CH3OH(g) 
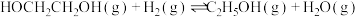
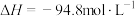
获取乙二醇的反应历程可分为如下2步:
I.

 (g)
(g) 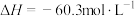
II.
 加氢生成乙二醇与甲醇。
加氢生成乙二醇与甲醇。①步骤II的热化学方程式是:
②研究反应温度对EC加氢的影响(反应时间均为
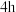 ),实验数据见下表:
),实验数据见下表:| 反应温度/℃ |  的转化率/% 的转化率/% | 乙二醇的产率/% |
| 160 | 23.8 | 23.2 |
| 180 | 62.1 | 60.9 |
| 200 | 99.9 | 94.7 |
| 220 | 99.9 | 92.4 |
(2)多晶
 是目前唯一被实验证实能高效催化
是目前唯一被实验证实能高效催化 还原为烃类(如
还原为烃类(如 )的金属。如图所示,电解装置中分别以多晶
)的金属。如图所示,电解装置中分别以多晶 和
和 为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后
为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后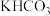 浓度基本保持不变,温度控制在10℃左右,生成
浓度基本保持不变,温度控制在10℃左右,生成 的电极反应式为
的电极反应式为
(3)
 与
与 反应如果用
反应如果用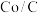 作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将
作为催化剂,可以得到含有少量甲酸的甲醇。为研究催化剂的催化效率,将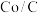 催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因:
催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇产量如图所示,试推测甲醇产量变化的原因: 相似)
相似)
(4)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。

该物质转化示意图可以描述为
您最近一年使用:0次
2023-08-14更新
|
222次组卷
|
2卷引用:湖北省武汉市武钢三中2023-2024学年高三上学期8月月考化学试题
解题方法
8 . 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。工业合成氨生产示意图如图所示。

(1)下列有关合成氨工业的说法正确的是_________
(2)循环利用的Y是氮气和氢气,目的是__________________ 。
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有_________ (填编号)。
①使用催化剂 ②恒温恒容,增大原料气 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体 使压强增大
使压强增大
(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分 值。
值。
分析数据可知:
①在 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻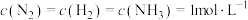 ,此时
,此时
_________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②人类不适合大规模模拟大气固氮的原因是__________________ 。
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。
已知: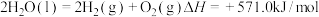 。
。
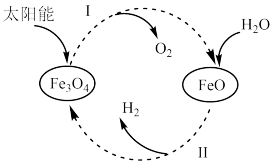
过程Ⅰ: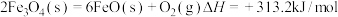
过程Ⅱ:……
过程Ⅱ的热化学方程式为_________ 。

(1)下列有关合成氨工业的说法正确的是_________
| A.工业合成氨的反应是熵减小的放热反应,在低温或常温时可自发进行 |
| B.合成氨反应中,反应物的总键能小于产物的总键能 |
C.合成氨厂一般采用的压强为 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
D. 的量越多, 的量越多, 的转化率越大,因此,充入的 的转化率越大,因此,充入的 越多越有利于 越多越有利于 的合成 的合成 |
(3)在合成氨工业中,要使氨的产率增大,同时又能提高反应速率,可采取的措施有
①使用催化剂 ②恒温恒容,增大原料气
 和
和 充入量 ③及时分离产生的
充入量 ③及时分离产生的
④升高温度 ⑤恒温恒容,充入惰性气体
 使压强增大
使压强增大(4)氮的固定和氮的循环是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分
 值。
值。| 反应 | 大气固氮 | 工业固氮 | |||
温度 | 27 | 2000 | 25 | 400 | 450 |
 |  | 0.1 | 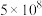 | 0.507 | 0.152 |
①在
 下模拟工业固氮,某时刻
下模拟工业固氮,某时刻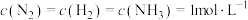 ,此时
,此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②人类不适合大规模模拟大气固氮的原因是
(5)为获得合成氨的原料气氢气,某科研小组以太阳能为热源分解
 ,经热化学铁氧化合物循环分解水制
,经热化学铁氧化合物循环分解水制 的过程如下。
的过程如下。已知:
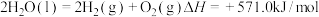 。
。
过程Ⅰ:
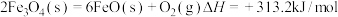
过程Ⅱ:……
过程Ⅱ的热化学方程式为
您最近一年使用:0次
9 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和。 催化加氢合成二甲醚是一种实现“碳中和”理想的
催化加氢合成二甲醚是一种实现“碳中和”理想的 转化方法。该过程中涉及的反应如下:
转化方法。该过程中涉及的反应如下:
主反应: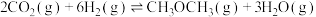

副反应:

回答下列问题:
(1)主反应通过以下步骤来实现:
I.
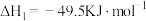
II.
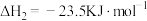
则主反应的
_______ 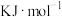 。
。
(2)在恒压、 和
和 的起始量一定时,
的起始量一定时, 平衡转化率和平衡时
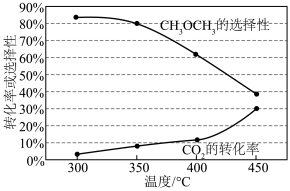
平衡转化率和平衡时 的选择性随温度的变化如下图所示,
的选择性随温度的变化如下图所示, 的选择性
的选择性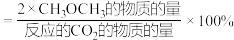 。
。 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是_______
②420℃时,在催化剂作用下 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性约为50%。不改变反应时间,一定能提高
的选择性约为50%。不改变反应时间,一定能提高 选择性的措施有
选择性的措施有_______ (填标号)。
A.升高温度 B.增大压强 C.增大 D.更换适宜的催化剂
D.更换适宜的催化剂
(3)在温度为543K。原料组成为 、初始总压为4MPa恒容密闭容器中进行反应,体系达到平衡时
、初始总压为4MPa恒容密闭容器中进行反应,体系达到平衡时 的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
的转化率为30%,二甲醚的选择性为50%,则氢气的转化率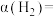
_______ ;主反应的压强平衡常数
_______ (列出计算式)。
(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为_______ 。
(5)1,2-丙二醇(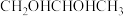 )单分子解离反应相对能量如图所示,路径包括碳碳键断裂解离和脱水过程。从能量的角度分析,TS1、TS2、TS3、TS4四种路径中
)单分子解离反应相对能量如图所示,路径包括碳碳键断裂解离和脱水过程。从能量的角度分析,TS1、TS2、TS3、TS4四种路径中_______ 路径的速率最慢。
 催化加氢合成二甲醚是一种实现“碳中和”理想的
催化加氢合成二甲醚是一种实现“碳中和”理想的 转化方法。该过程中涉及的反应如下:
转化方法。该过程中涉及的反应如下:主反应:
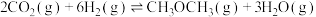

副反应:


回答下列问题:
(1)主反应通过以下步骤来实现:
I.

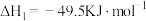
II.

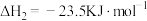
则主反应的

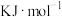 。
。(2)在恒压、
 和
和 的起始量一定时,
的起始量一定时, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如下图所示,
的选择性随温度的变化如下图所示, 的选择性
的选择性 。
。
 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是②420℃时,在催化剂作用下
 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性约为50%。不改变反应时间,一定能提高
的选择性约为50%。不改变反应时间,一定能提高 选择性的措施有
选择性的措施有A.升高温度 B.增大压强 C.增大
 D.更换适宜的催化剂
D.更换适宜的催化剂(3)在温度为543K。原料组成为
 、初始总压为4MPa恒容密闭容器中进行反应,体系达到平衡时
、初始总压为4MPa恒容密闭容器中进行反应,体系达到平衡时 的转化率为30%,二甲醚的选择性为50%,则氢气的转化率
的转化率为30%,二甲醚的选择性为50%,则氢气的转化率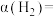

(4)二甲醚直接燃料电池具有启动快、效率高、能量密度大等优点。若电解质溶液呈碱性,二甲醚直接燃料电池的负极反应为
(5)1,2-丙二醇(
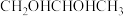 )单分子解离反应相对能量如图所示,路径包括碳碳键断裂解离和脱水过程。从能量的角度分析,TS1、TS2、TS3、TS4四种路径中
)单分子解离反应相对能量如图所示,路径包括碳碳键断裂解离和脱水过程。从能量的角度分析,TS1、TS2、TS3、TS4四种路径中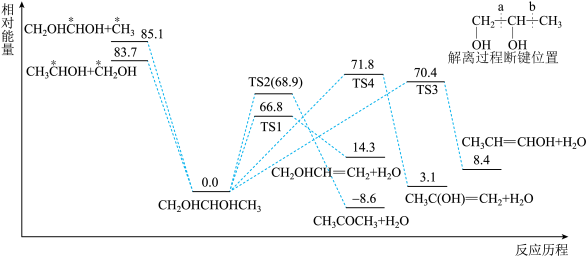
您最近一年使用:0次
10 . 2030年实现“碳达峰”,2060年达到“碳中和”的承诺,体现了我国的大国风范。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇涉及的反应可表示为:
①

②
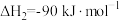
③
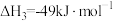
(1)根据上述反应求:④ 的
的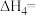
___________  。
。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
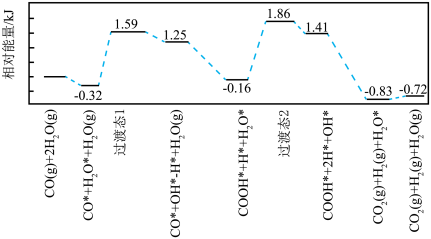
写出该历程中决速步骤的化学方程式:________ 。
(3)一体积可变的密闭容器中,在保持a MPa下,按照 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
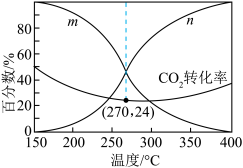
①图中m曲线代表的物质为________ 。
②下列说法正确的是________ (填标号)。
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为________ (保留2位有效数字)。
(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应 ,其速率方程为
,其速率方程为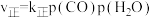 ,
,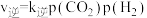 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
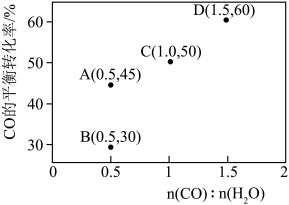
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是________ ,在C点所示投料比下,当CO转化率达到40%时,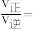
________ 。
二氧化碳加氢制甲醇涉及的反应可表示为:
①


②

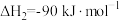
③

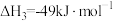
(1)根据上述反应求:④
 的
的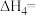
 。
。(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

写出该历程中决速步骤的化学方程式:
(3)一体积可变的密闭容器中,在保持a MPa下,按照
 投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
①图中m曲线代表的物质为
②下列说法正确的是
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,270℃时反应①的分压平衡常数为
,270℃时反应①的分压平衡常数为(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应
 ,其速率方程为
,其速率方程为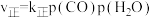 ,
,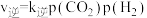 ,其中
,其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 分别为速率常数,p为气体的分压。已知降低温度时,
分别为速率常数,p为气体的分压。已知降低温度时, 增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是
增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是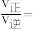

您最近一年使用:0次
2023-06-29更新
|
454次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2023-2024学年高二上学期10月月考化学试题



