1 . 随着低碳钢等洁净钢技术的发展,Al2O3-C耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
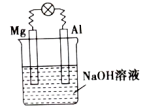
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:_____ 。
(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①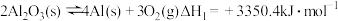
②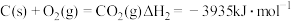
③
④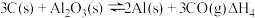 则
则

______  。
。
(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤
⑥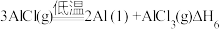
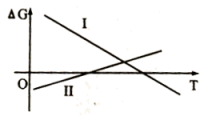
反应⑤、反应⑥中自由能( )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线____ (填“I”或“II”),试分析氧化铝碳热还原氯化法炼铝的可行性:______
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑: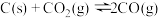 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
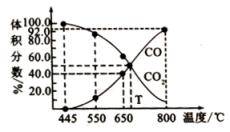
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=___________ 。
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=___________ [用含p总的代数式表示,气体分压(p分)=气体总压(p总) 体积分数]。
体积分数]。
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:

(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①
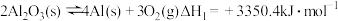
②
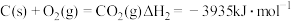
③

④
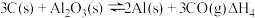 则
则
 。
。(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤

⑥
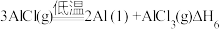
反应⑤、反应⑥中自由能(
 )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:
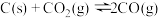 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
 体积分数]。
体积分数]。
您最近一年使用:0次
2 . 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
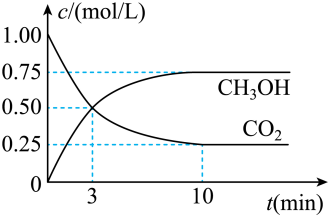
(1)应开始到平衡,H2的平均反应速率v(H2)=___________ mol/(L·min),H2的转化率为___________ 。
(2)能判断该反应是否达到化学平衡状态的依据是___________ 。
a.容器中压强不变 b.混合气体中c(CO2)=c(H2O)
c.混合气体的平均分子量不变 d.混合气体的密度不变
(3)下列措施中能使活化分子百分数增大的是___________ 。
A.升高温度 B.增大反应物浓度 C.增大压强 D.使用正催化剂
(4)一种新型燃料电池,一极通入空气,另一极通入甲醇气体;燃料电池内部是熔融的K2CO3,在其内部可以传导CO 。在电池内部CO
。在电池内部CO 移向
移向___________ ,该电池的负极反应为___________ 。
(5)氮氧化物的污染也受到高度重视,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是___________ 。
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)应开始到平衡,H2的平均反应速率v(H2)=
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO2)=c(H2O)
c.混合气体的平均分子量不变 d.混合气体的密度不变
(3)下列措施中能使活化分子百分数增大的是
A.升高温度 B.增大反应物浓度 C.增大压强 D.使用正催化剂
(4)一种新型燃料电池,一极通入空气,另一极通入甲醇气体;燃料电池内部是熔融的K2CO3,在其内部可以传导CO
 。在电池内部CO
。在电池内部CO 移向
移向(5)氮氧化物的污染也受到高度重视,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
您最近一年使用:0次
名校
解题方法
3 . I.已知下列热化学方程式:
①P4(s,白磷)+5O2(g)=P4O10(s);△H1=-2983.2kJ/mol
②P(s,红磷)+ O2(g)=
O2(g)= P4O10(s);△H1=-738.5kJ/mol
P4O10(s);△H1=-738.5kJ/mol
③CO(g)=C(s)+ O2(g);△H=+110.5kJ•mol-1
O2(g);△H=+110.5kJ•mol-1
④C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
(1)白磷的稳定性比红磷___________ (填“高”或“低”)
(2)表示CO燃烧热的热化学方程式为___________
II.一定条件下,在2L密闭容器中发生反应:3A(g)+B(s) 2C(g)。开始时加入4molA、6molB、2molC,在5min末测得C的物质的量是3mol。
2C(g)。开始时加入4molA、6molB、2molC,在5min末测得C的物质的量是3mol。
(1)用A的浓度变化表示反应的平均速率:___________ 。
(2)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①降低温度,化学反应速率___________ ;
②充入1molB,化学反应速率___________ ;
③将容器的体积变为1L,化学反应速率___________
①P4(s,白磷)+5O2(g)=P4O10(s);△H1=-2983.2kJ/mol
②P(s,红磷)+
 O2(g)=
O2(g)= P4O10(s);△H1=-738.5kJ/mol
P4O10(s);△H1=-738.5kJ/mol③CO(g)=C(s)+
 O2(g);△H=+110.5kJ•mol-1
O2(g);△H=+110.5kJ•mol-1④C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
(1)白磷的稳定性比红磷
(2)表示CO燃烧热的热化学方程式为
II.一定条件下,在2L密闭容器中发生反应:3A(g)+B(s)
 2C(g)。开始时加入4molA、6molB、2molC,在5min末测得C的物质的量是3mol。
2C(g)。开始时加入4molA、6molB、2molC,在5min末测得C的物质的量是3mol。(1)用A的浓度变化表示反应的平均速率:
(2)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①降低温度,化学反应速率
②充入1molB,化学反应速率
③将容器的体积变为1L,化学反应速率
您最近一年使用:0次
解题方法
4 . 不同价态含硫化合物的转化在工业上有重要的应用。回答下列问题:
(1)利用NO2将SO2转化为SO3的反应过程如下:
Ⅰ.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
Ⅱ.2NO(g)+O2(g)=2NO2(g) ΔH= -114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH= -197.7kJ·mol-1。
则Q=_______ ;NO2的作用是_______ 。
(2)某化学小组对反应2SO2(g)+O2(g)⇌2SO3(g)进行研究。在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到数据如下表:
①表中a=_______ ,甲组实验在该条件下的平衡常数K=_______ 。
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正_______ v逆(填“>”“=”或“<”),平衡时SO3的百分含量与原甲组实验相比_______ (填“变大”“变小”或“不变”)。
③表中b=_______ ,若将乙组实验的容器改为绝热容器,则b值_______ (填“变大”“变小”或“不变”)。
(1)利用NO2将SO2转化为SO3的反应过程如下:
Ⅰ.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
Ⅱ.2NO(g)+O2(g)=2NO2(g) ΔH= -114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH= -197.7kJ·mol-1。
则Q=
(2)某化学小组对反应2SO2(g)+O2(g)⇌2SO3(g)进行研究。在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到数据如下表:
| 实验分组 | 甲组 | 乙组 |
| 反应物 | 2molSO2、1molO2 | 2molSO3 |
| 反应热量 | 放热158.16kJ | |
| 反应物的平衡转化率 | a | b |
①表中a=
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正
③表中b=
您最近一年使用:0次
5 . 目前,汽车尾气系统中均安装了催化转化器,大大减少了CO和NOx汽车尾气的排放。
(1)在催化剂作用下CO还原NO、NO2。
标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,25℃下几种物质的标准生成焓如下:
ⅰ.CO(g)+NO2(g) CO2(g)+NO(g) ΔH1
CO2(g)+NO(g) ΔH1
ⅱ.2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH2=-623KJ• mol-1
2CO2(g)+N2(g) ΔH2=-623KJ• mol-1
ΔH1=___________ ;写出用 CO还原NO2生成两种无污染的气态物质总反应的热化学方程式:___________
人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。
(2)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:___________ 。
(3)一种以 CO为燃料,以空气为氧化剂,以熔融态 K2CO3为电解质的燃料电池,工作原理如下图所示:
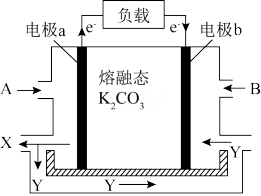
①电极a为___________ (填“ 正极”或“ 负极” ),Y物质为___________ ;
②正极上的电极反应式为___________ 。
(1)在催化剂作用下CO还原NO、NO2。
标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,25℃下几种物质的标准生成焓如下:
| NO2 | CO | CO2 | NO | |
| 标准生成焓/kJ•mol-1 | 33.1 | -110.5 | -183.6 | 90.3 |
 CO2(g)+NO(g) ΔH1
CO2(g)+NO(g) ΔH1ⅱ.2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH2=-623KJ• mol-1
2CO2(g)+N2(g) ΔH2=-623KJ• mol-1ΔH1=
人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。
(2)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:
(3)一种以 CO为燃料,以空气为氧化剂,以熔融态 K2CO3为电解质的燃料电池,工作原理如下图所示:

①电极a为
②正极上的电极反应式为
您最近一年使用:0次
名校
6 . 参照反应Br+H2⇌HBr+H的能量对反应历程的示意图,下列叙述中正确的是


| A.正反应为吸热反应 |
| B.加入催化剂,该化学反应的放热量变多 |
| C.反应物总能量高于生成物总能量 |
| D.升高温度可增大正反应速率,降低逆反应速率 |
您最近一年使用:0次
2021-03-18更新
|
161次组卷
|
2卷引用:辽宁省锦州市义县高级中学2020-2021学年高一下学期3月考试化学试题
名校
解题方法
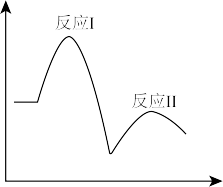
7 . 已知完全分解1molH2O2放出热量为98kJ,在含有少量I-的溶液中H2O2分解的机理为
反应Ⅰ:H2O2(aq)+I-(aq) IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1
反应Ⅱ:H2O2(aq)+IO-(aq) O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2
在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
反应Ⅰ:H2O2(aq)+I-(aq)
 IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1反应Ⅱ:H2O2(aq)+IO-(aq)
 O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是

| A.反应Ⅱ高温下能自发进行 |
| B.H2O2分解产生氧气的速率是由反应I决定的 |
| C.I-、IO-都是催化剂 |
| D.△H1+△H2=-196kJ•mol-1 |
您最近一年使用:0次
2021-03-16更新
|
940次组卷
|
12卷引用:辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题
辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题浙江省2021届高三下学期3月联考化学试题(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州中学2021-2022学年高二上学期期中考试化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题浙江省温州新力量联盟2022-2023学年高二 上学期期中联考化学试题广东省广州市东涌中学2022-2023学年高二上学期期中考试化学试题广东省深圳市富源学校2023-2024学年高二上学期11月期中化学试题
8 . 反应2H2(g)+O2(g)=2H2O(1) ΔH=-571.6 kJ·mol-1 过程中的能量变化关系如图。下列说法错误的是

| A.ΔH1>△H2 |
| B.ΔH1+ΔH2+ΔH3=ΔH4=-571.6kJ·mol-1 |
C.2mol水蒸气转化为液态水能够释放出的能量为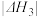 kJ kJ |
| D.若将上述反应设计成原电池,则当氢失4mol电子时能够产生571.6kJ的电能 |
您最近一年使用:0次
2021-03-14更新
|
496次组卷
|
6卷引用:辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题
辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题福建省福州市2021届高考3月毕业班质量检测(一模)化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
9 . MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):不正确 的是

| A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 |
| B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 |
| C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) |
| D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 |
您最近一年使用:0次
2019-04-12更新
|
7428次组卷
|
49卷引用:辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题
辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题天津市第一中学2018-2019学年高一下学期期末考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练选择性必修1(SJ)专题1专题培优专练(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)选择性必修1 专题1 素养检测(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题10.化学反应中的能量变化-十年(2012-2021)高考化学真题分项汇编(浙江专用)四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题湖北省石首市2021-2022学年高二上学期期中考试化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)河南省信阳市2021-2022学年高二上学期期中考试化学试题2019年4月浙江省普通高校招生选考科目考试化学试题黑龙江省鹤岗市第一中学2020届高三11月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高二上学期期中化学试题浙江省宁波市余姚中学2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第二节 反应热的计算 高考帮安徽省池州市第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过高考 3年真题强化闯关(已下线)【浙江新东方】97(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题7 盖斯定律专练(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)第一章 综合拔高练(已下线)高中化学-高二上-9(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考卷(五)化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题(已下线)第六章 化学反应与能量 第34讲 反应热的计算黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题天津市区重点中学2023届高三毕业班联考(一)化学试题广东省揭阳市惠来县第一中学2022-2023学年高二下学期第一次月考化学试题山西省孝义市2022-2023学年高二4月月考化学试卷(已下线)专题08 化学反应中的能量变化(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省哈尔滨第三中学2023-2024学年高二上学期第二次验收考试化学试题
名校
10 . 甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3=_________ 。
(2)反应1能够自发进行的原因是_______________ ,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________ 。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______ 。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________ 。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________ ,反应Ⅱ的平衡常数_________ (结果保留两位有效数字)
反应Ⅰ(主) :CH3OH(g)+ H2O(g)
 CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol反应Ⅱ(副) :H2(g)+ CO2(g)
 CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3(1)计算反应Ⅲ的ΔH3=
(2)反应1能够自发进行的原因是
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是
③写出一条能提高CH3OH转化率而降低CO生成率的措施
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率
您最近一年使用:0次
2018-01-19更新
|
2038次组卷
|
10卷引用:辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题
辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】2021年天津高考化学试题变式题13-16广东省佛山市普通高中2018届高三教学质量检测(一)化学试题河北省衡水中学2018届高三第十五次模拟理科综合化学试题【全国百强校】河南省林州市第一中学2017-2018学年高二5月月考化学试题【全国百强校】河南省信阳高级中学2018届高三第四次模拟考试化学试题山西省大同市第二中学2020届高三3月月考理综化学试题甘肃省兰州市第一中学2020-2021学年高二上学期期中考试化学(理)试题2020届高三化学二轮冲刺新题专练——化学反应原理综合题



