解题方法
1 . 铂(Pt)是一种贵金属,广泛用于化工领域。从某废催化剂(主要含有Pt、C、Al2O3、MgO)中回收Pt的一种工艺流程如图所示。

(1)I中焙烧时,C与空气中的O2生成了CO和CO2,发生的反应如下:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;
2C(s)+O2(g)=2CO(g) △H2=-221kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) △H3=____ kJ·mol-1。
(2)实验人员采用三种不同的浸出液分别研究II中Pt的浸出率。所用的浸出液分别是HCl-H2SO4-NaClO3、HCl-NaClO3和HCl-H2O2。
①将下列浸出反应的离子方程式补充完整:____ 。
3Pt+ Cl-+
Cl-+ ClO
ClO +
+ _____=3[PtCl6]2-+
_____=3[PtCl6]2-+ H2O
H2O
②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=____ 。
③c(H+)相同、浸出时间相同时,三种浸出液对Pt的浸出率如表。
[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
a.以HCl-NaClO3为例,说明当其中氧化剂浓度大于0.2mol·L-1时,Pt的浸出率降低的原因:随着c(NaClO3)增大,其氧化性增强,部分ClO 被
被_____ 还原而消耗。
b.氧化剂浓度均为0.2mol·L-1时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,_____ 。
(3)III中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
i.R3N(O)+H+(A)+Cl-(A) R3NHCl(O)
R3NHCl(O)
ii.2R3NHCl(O)+[PtCl6]2-(A) (R3NH2)[PtCl6](O)+2Cl-(A)
(R3NH2)[PtCl6](O)+2Cl-(A)
①分离操作x是____ 。
②IV中向含Pt的有机物中加入NaOH溶液可使[PtCl6]2-进入水溶液体系,反应的离子方程式是_____ 。

(1)I中焙烧时,C与空气中的O2生成了CO和CO2,发生的反应如下:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;
2C(s)+O2(g)=2CO(g) △H2=-221kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) △H3=
(2)实验人员采用三种不同的浸出液分别研究II中Pt的浸出率。所用的浸出液分别是HCl-H2SO4-NaClO3、HCl-NaClO3和HCl-H2O2。
①将下列浸出反应的离子方程式补充完整:
3Pt+
 Cl-+
Cl-+ ClO
ClO +
+ _____=3[PtCl6]2-+
_____=3[PtCl6]2-+ H2O
H2O②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=
③c(H+)相同、浸出时间相同时,三种浸出液对Pt的浸出率如表。
[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
| 氧化剂浓度/mol·L-1 | 0.1 | 0.2 | 0.3 | 0.4 | |
| 甲 | HCl-H2SO4-NaClO3对Pt的浸出率/% | 72.7 | 78.2 | 77.5 | 75.4 |
| 乙 | HCl-NaClO3对Pt的浸出率/% | 79.6 | 85.3 | 82.1 | 81.6 |
| 丙 | HCl-H2O2对Pt的浸出率/% | 80.0 | 85.6 | 83.2 | 82.5 |
a.以HCl-NaClO3为例,说明当其中氧化剂浓度大于0.2mol·L-1时,Pt的浸出率降低的原因:随着c(NaClO3)增大,其氧化性增强,部分ClO
 被
被b.氧化剂浓度均为0.2mol·L-1时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,
(3)III中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
i.R3N(O)+H+(A)+Cl-(A)
 R3NHCl(O)
R3NHCl(O)ii.2R3NHCl(O)+[PtCl6]2-(A)
 (R3NH2)[PtCl6](O)+2Cl-(A)
(R3NH2)[PtCl6](O)+2Cl-(A)①分离操作x是
②IV中向含Pt的有机物中加入NaOH溶液可使[PtCl6]2-进入水溶液体系,反应的离子方程式是
您最近一年使用:0次
22-23高三上·山西·开学考试
解题方法
2 . 氯化亚铜(CuCl)常用作有机合成工业中的催化剂。工业上由辉铜矿(主要成分为 ,含有
,含有 杂质)制备CuCl的工艺流程如下。
杂质)制备CuCl的工艺流程如下。

已知:i.CuCl是白色粉末,难溶于水和乙醇,在空气中迅速被氧化成绿色固体碱式氯化铜 ;CuCl在水溶液中存在平衡:
;CuCl在水溶液中存在平衡: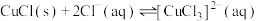
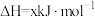 ,
, 为无色离子。
为无色离子。
ⅱ.操作A为向滤液②中加入去氧水(除去氧气的蒸馏水),操作B为用无水乙醇洗涤滤渣②,然后在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。
回答下列问题:
(1)为提高辉铜矿的浸取率,可采用的方法是_______ (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)已知“滤渣①”的成分为 和S,且“浸取”时
和S,且“浸取”时 中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为
中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为_______ 。
(3)已知: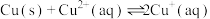
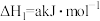
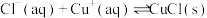
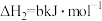
则“还原”时的反应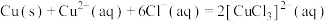 的
的
_______ ;出现_______ 现象时,表明“还原”进行完全。
(4)操作A和操作B除了防止CuCl固体被氧化外,操作A的作用还有_______ ,操作B中采用70℃干燥的目的是_______ 。
(5)CuCl还可用电解法制备,实验装置如图(电解液温度为T℃)。
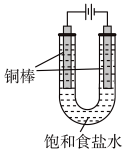
①阳极的电极反应式为_______ 。
②实验开始时,阳极附近没有产生CuOH沉淀的原因是_______ [T℃时,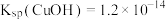 ,
,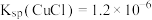 ]。
]。
 ,含有
,含有 杂质)制备CuCl的工艺流程如下。
杂质)制备CuCl的工艺流程如下。
已知:i.CuCl是白色粉末,难溶于水和乙醇,在空气中迅速被氧化成绿色固体碱式氯化铜
 ;CuCl在水溶液中存在平衡:
;CuCl在水溶液中存在平衡: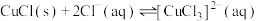
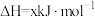 ,
, 为无色离子。
为无色离子。ⅱ.操作A为向滤液②中加入去氧水(除去氧气的蒸馏水),操作B为用无水乙醇洗涤滤渣②,然后在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。
回答下列问题:
(1)为提高辉铜矿的浸取率,可采用的方法是
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)已知“滤渣①”的成分为
 和S,且“浸取”时
和S,且“浸取”时 中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为
中N元素主要被还原为最低价态,则“浸取”时反应的离子方程式为(3)已知:
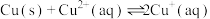
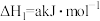
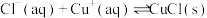
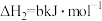
则“还原”时的反应
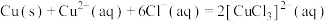 的
的
(4)操作A和操作B除了防止CuCl固体被氧化外,操作A的作用还有
(5)CuCl还可用电解法制备,实验装置如图(电解液温度为T℃)。

①阳极的电极反应式为
②实验开始时,阳极附近没有产生CuOH沉淀的原因是
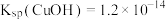 ,
,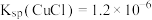 ]。
]。
您最近一年使用:0次
2022-09-08更新
|
290次组卷
|
3卷引用:北京市海淀区2023届高三上学期期末考试变式汇编(15-19)
(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(15-19)山西省2022-2023学年高三上学期第一次摸底考试化学试题山西省运城市2022-2023学年高三入学新生教学质量监测考试化学试题
名校
解题方法
3 . 回收利用CO2是目前解决长期载人航天舱内(如空间站)供氧问题的有效途径,其物质转化如图:

(1)反应A为CO2(g)+4H2(g) CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ•mol-1
CH4(g)+2O2(g)=2H2O(g)+CO2(g) ΔH=-802.3kJ•mol-1
反应A的ΔH=____ kJ•mol-1。
(2)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。

①理论上,能提高CO2平衡转化率的措施有____ (写出一条即可)。
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是_____ 。
(3)下列关于空间站内物质和能量变化的说法中,不正确 的是_____ (填字母)。
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(4)用CO2(g)+2H2(g) C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是_____ 。

(1)反应A为CO2(g)+4H2(g)
 CH4(g)+2H2O(g),是回收利用CO2的关键步骤。
CH4(g)+2H2O(g),是回收利用CO2的关键步骤。已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ•mol-1
CH4(g)+2O2(g)=2H2O(g)+CO2(g) ΔH=-802.3kJ•mol-1
反应A的ΔH=
(2)将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应A,在相同时间内测得H2O的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。

①理论上,能提高CO2平衡转化率的措施有
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高CO2的转化效率,原因是
(3)下列关于空间站内物质和能量变化的说法中,
a.反应B的能量变化是电能→化学能或光能→化学能
b.物质转化中O、H原子的利用率均为100%
c.不用Na2O2作供氧剂的原因可能是Na2O2不易实现循环利用
(4)用CO2(g)+2H2(g)
 C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
C(s)+2H2O(g)代替反应A,可实现氢、氧元素完全循环利用,缺点是使用一段时间后催化剂的催化效果会明显下降,其原因是
您最近一年使用:0次
2022-09-02更新
|
316次组卷
|
4卷引用:北京市西城区2021—2022学年高二上学期期末化学试题
名校
4 . 工业尾气H2S对环境和人体健康产生危害,必须经过处理才可排放。依据题意回答下列问题:
(1)生物脱硫可处理含H2S的烟气,过程中使用的硫杆菌是一种微生物。

①反应 的
的 =
=_______ 。
②若反应温度过高,反应速率下降(如图),其原因是_______ 。
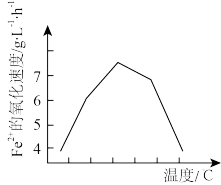
(2)科研工作者利用微波法处理尾气中的H2S并回收H2和S,反应为: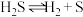 ,一定条件下,H2S的转化率随温度变化的曲线如图。
,一定条件下,H2S的转化率随温度变化的曲线如图。
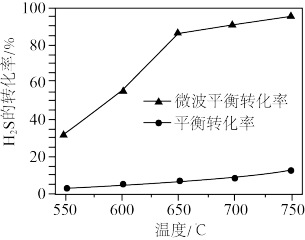
①H2S分解生成H2和S的反应为_______ 反应(填“吸热”或“放热”)。
②微波的作用是_______ 。
(3)利用电化学法也可处理尾气H2S。为避免硫磺沉积在阳极,将氧化吸收和电解制氢过程分开进行,装置如下图所示。氧化吸收器中为Fe2(SO4)3溶液,电解反应器中,以石墨为阳极,以 为阴极,中间用质子交换膜隔开。
为阴极,中间用质子交换膜隔开。
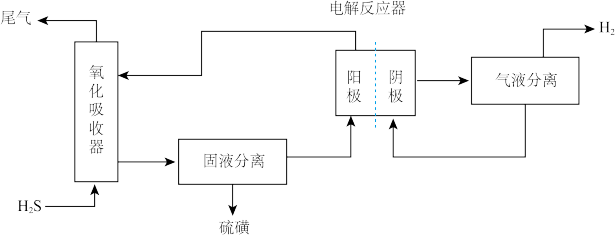
①氧化吸收器中反应的离子方程式为_______ 。
②电解反应器中,阴极的电极反应式为_______ 。
③电解反应器的作用是_______ (写出2点)。
(1)生物脱硫可处理含H2S的烟气,过程中使用的硫杆菌是一种微生物。
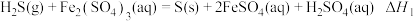

①反应
 的
的 =
=②若反应温度过高,反应速率下降(如图),其原因是

(2)科研工作者利用微波法处理尾气中的H2S并回收H2和S,反应为:
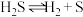 ,一定条件下,H2S的转化率随温度变化的曲线如图。
,一定条件下,H2S的转化率随温度变化的曲线如图。
①H2S分解生成H2和S的反应为
②微波的作用是
(3)利用电化学法也可处理尾气H2S。为避免硫磺沉积在阳极,将氧化吸收和电解制氢过程分开进行,装置如下图所示。氧化吸收器中为Fe2(SO4)3溶液,电解反应器中,以石墨为阳极,以
 为阴极,中间用质子交换膜隔开。
为阴极,中间用质子交换膜隔开。
①氧化吸收器中反应的离子方程式为
②电解反应器中,阴极的电极反应式为
③电解反应器的作用是
您最近一年使用:0次
2022-09-01更新
|
178次组卷
|
3卷引用:北京市房山区2021-2022学年高三上学期期末考试化学试题
北京市房山区2021-2022学年高三上学期期末考试化学试题新疆维吾尔自治区塔城地区第二中学2022-2023学年高三上学期11月月考化学试题(B)(已下线)2023年北京卷高考真题变式题(原理综合题)
5 .  (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。
①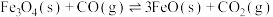
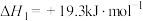
②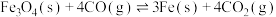

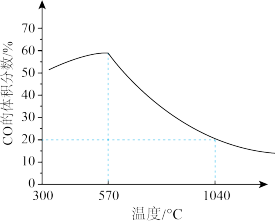
反应的还原产物与温度密切相关。其他条件一定, (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
 (s)与CO(g)主要发生如下反应。
(s)与CO(g)主要发生如下反应。①
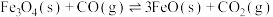
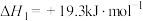
②
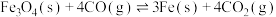

反应的还原产物与温度密切相关。其他条件一定,
 (s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
(s)和CO(g)反应达平衡时,CO(g)的体积分数随温度的变化关系如图所示。下列说法不正确的是
A.反应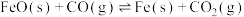 的焓变为 的焓变为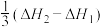 |
B.根据图象推测, 应当小于0 应当小于0 |
C.反应温度越高, 主要还原产物中铁元素的价态越低 主要还原产物中铁元素的价态越低 |
D.温度高于1040℃时, (s)和CO(g)发生的主要反应的化学平衡常数 (s)和CO(g)发生的主要反应的化学平衡常数 |
您最近一年使用:0次
2022-09-01更新
|
960次组卷
|
11卷引用:北京市海淀区2021-2022学年高三上学期期末考试化学试题
北京市海淀区2021-2022学年高三上学期期末考试化学试题四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题北京市第二十中学2022-2023学年高二上学期期末考试化学试题广东省华南师范大学附属中学2022届高三下学期押题预测(一)化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第八十中学2024届高三上学期10月月考化学试题北京市育才学校2023-2024学年高三上学期11月期中考试化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市密云二中2023-2024学年高二上学期10月月考化学试卷 河南省豫北名校2022-2023学年高二上学期10月教学质量检测化学试题安徽省六安第一中学2023-2024学年高二上学期期中考试化学试题
名校
6 . CO2相关转化的研究,对解决环境、能源问题意义重大。
(1)CO2催化加氢制取汽油,CO2转化过程示意图如图:
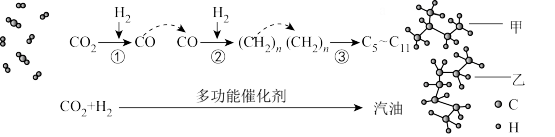
下列说法不正确的是____ 。
a.反应①的产物中含有水
b.图中甲与乙互为同系物
c.反应②中只有碳碳键形成
d.汽油主要是C5~C11的烃类混合物
(2)CO2与CH4经催化重整可制得合成气:
CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH
2CO(g)+2H2(g) ΔH
已知:C(s)+2H2(g)=CH4(g) ΔH1=−75 kJ∙mol−1
C(s)+O2(g)=CO2g) ΔH2=−394 kJ∙mol−1
2C(s)+O2(g)=2CO(g) ΔH3=−222 kJ∙mol−1
该催化重整反应的ΔH=____ kJ∙mol−1
(3)CO2与H2反应制取甲醇(CH3OH)。
已知1gH2与CO2反应生成CH3OH气体和水蒸气放出9.7kJ的热量。
①写出CO2(g)与H2(g)制取CH3OH(g)的热化学方程式____ 。
②已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由CO2合成1mol液态甲醇和1mol液态水放出____ kJ热量。
(4)制取化工原料草酸铝[Al2(C2O4)3]。
利用Al−CO2电池,能有效地将CO2转化成草酸铝,工作原理如图所示。
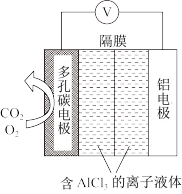
①电池的负极反应式是:____ 。
②电池的正极反应式:2CO2+2e-=C2O (草酸根)
(草酸根)
正极反应过程中,O2起催化作用,催化过程可表示为:
I.2O2+2e-=2O
II.……
写出II的离子方程式:____ 。
(1)CO2催化加氢制取汽油,CO2转化过程示意图如图:

下列说法不正确的是
a.反应①的产物中含有水
b.图中甲与乙互为同系物
c.反应②中只有碳碳键形成
d.汽油主要是C5~C11的烃类混合物
(2)CO2与CH4经催化重整可制得合成气:
CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH
2CO(g)+2H2(g) ΔH已知:C(s)+2H2(g)=CH4(g) ΔH1=−75 kJ∙mol−1
C(s)+O2(g)=CO2g) ΔH2=−394 kJ∙mol−1
2C(s)+O2(g)=2CO(g) ΔH3=−222 kJ∙mol−1
该催化重整反应的ΔH=
(3)CO2与H2反应制取甲醇(CH3OH)。
已知1gH2与CO2反应生成CH3OH气体和水蒸气放出9.7kJ的热量。
①写出CO2(g)与H2(g)制取CH3OH(g)的热化学方程式
②已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由CO2合成1mol液态甲醇和1mol液态水放出
(4)制取化工原料草酸铝[Al2(C2O4)3]。
利用Al−CO2电池,能有效地将CO2转化成草酸铝,工作原理如图所示。

①电池的负极反应式是:
②电池的正极反应式:2CO2+2e-=C2O
 (草酸根)
(草酸根)正极反应过程中,O2起催化作用,催化过程可表示为:
I.2O2+2e-=2O

II.……
写出II的离子方程式:
您最近一年使用:0次
名校
7 . 氧、硫、硒( )、碲(
)、碲( )、钋(
)、钋( )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ 。
(2)某温度时,该族单质与 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下:
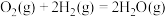

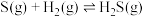


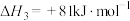
①硫和硒的氢化物的热稳定性:H2S_____ H2Se (填>、=或<);用原子结构知识解释你的判断结果_______ 。
②写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式_______ 。
(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为_______ 。
②生物浸出时的总反应的氧化剂是_______ 。
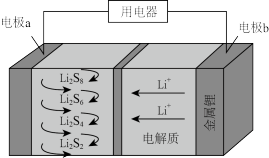
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: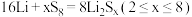 。下列说法
。下列说法错误 的是_______
 )、碲(
)、碲( )、钋(
)、钋( )是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:
)是元素周期表中原子序数依次增大的同主族元素。该族元素及其化合物在生产生活中发挥着巨大作用。回答下列问题:(1)
 在周期表中的位置为
在周期表中的位置为(2)某温度时,该族单质与
 反应生成气态
反应生成气态 的热化学方程式如下:
的热化学方程式如下: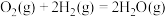

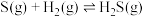


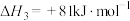
①硫和硒的氢化物的热稳定性:H2S
②写出
 与
与 反应生成
反应生成 和
和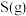 的热化学方程式
的热化学方程式(3)生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。

①步骤I反应的离子方程式为
②生物浸出时的总反应的氧化剂是
(4)全固态锂硫电池能量密度高,其工作原理如图所示,其中电极
 常用掺有石墨烯的
常用掺有石墨烯的 材料,电池反应为:
材料,电池反应为: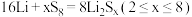 。下列说法
。下列说法
A.电池工作时,正极可发生反应: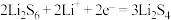 |
B.电池工作时,外电路中流过 电子,负极材料减重 电子,负极材料减重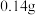 |
C.石墨烯的作用主要是提高电极 的导电性 的导电性 |
D.电池充电时间越长,电池中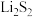 的量越多 的量越多 |
您最近一年使用:0次
2022-07-05更新
|
130次组卷
|
2卷引用:北京市第十二中学2021-2022学年高一下学期6月月考化学试题
名校
解题方法
8 .  分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用
分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用 作为碳源,通过
作为碳源,通过 催化加氢方式,不仅可以减少温室气体的排放,还可以将
催化加氢方式,不仅可以减少温室气体的排放,还可以将 转化为高附加值的化学产品,具有重要的战略意义。
转化为高附加值的化学产品,具有重要的战略意义。
(1) 的结构与
的结构与 相似,写出
相似,写出 的电子式
的电子式_______ 。
(2)一种 直接加氢的反应机理如图a所示。
直接加氢的反应机理如图a所示。

①写出总反应的化学方程式_______ 。
②a、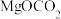 也可以写成
也可以写成 (难溶),写出
(难溶),写出 溶于乙酸的离子方程式
溶于乙酸的离子方程式_______ ;
b、 比
比 更难溶,加热
更难溶,加热 的水溶液可以生成
的水溶液可以生成 ,写出反应的化学方程式
,写出反应的化学方程式_______ 。
(3)①已知:主反应 催化加氢制甲醇是放热反应
催化加氢制甲醇是放热反应

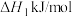

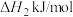
写出 催化加氢制甲醇的热化学方程式
催化加氢制甲醇的热化学方程式_______ ( 用含
用含 和
和 的代数式表示)。
的代数式表示)。
②已知
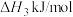 ,则
,则
_______  (填>、<或=)。
(填>、<或=)。
③我国科学家设计了离子液体电还原 合成
合成 工艺,写出碱性条件下
工艺,写出碱性条件下 生成甲醇的电极反应式
生成甲醇的电极反应式_______ 。
 分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用
分子结构稳定,难以给出电子,较容易接受电子,较难活化。采用 作为碳源,通过
作为碳源,通过 催化加氢方式,不仅可以减少温室气体的排放,还可以将
催化加氢方式,不仅可以减少温室气体的排放,还可以将 转化为高附加值的化学产品,具有重要的战略意义。
转化为高附加值的化学产品,具有重要的战略意义。(1)
 的结构与
的结构与 相似,写出
相似,写出 的电子式
的电子式(2)一种
 直接加氢的反应机理如图a所示。
直接加氢的反应机理如图a所示。
①写出总反应的化学方程式
②a、
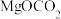 也可以写成
也可以写成 (难溶),写出
(难溶),写出 溶于乙酸的离子方程式
溶于乙酸的离子方程式b、
 比
比 更难溶,加热
更难溶,加热 的水溶液可以生成
的水溶液可以生成 ,写出反应的化学方程式
,写出反应的化学方程式(3)①已知:主反应
 催化加氢制甲醇是放热反应
催化加氢制甲醇是放热反应
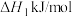

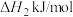
写出
 催化加氢制甲醇的热化学方程式
催化加氢制甲醇的热化学方程式 用含
用含 和
和 的代数式表示)。
的代数式表示)。②已知

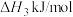 ,则
,则
 (填>、<或=)。
(填>、<或=)。③我国科学家设计了离子液体电还原
 合成
合成 工艺,写出碱性条件下
工艺,写出碱性条件下 生成甲醇的电极反应式
生成甲醇的电极反应式
您最近一年使用:0次
2022-06-19更新
|
146次组卷
|
2卷引用:北京市第十二中学2021-2022学年高一下学期6月月考化学试题
9 . NSR(NO2的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中NO2的排放,其工作原理如图。

(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ·mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H3=____ 。
(2)①存储阶段:Ba存储NO2后转化为Ba(NO3)2的化学方程式是____ 。
②还原阶段:NO2从Ba(NO3)2中释放,然后在Pt的表面被CO、H2还原为N2。若参加反应的n(CO)=n(H2),则反应的n(CO):n(H2):n(NO2)=____ 。
(3)某实验小组模拟NSR系统中的一个存储、还原过程。让尾气通过NSR反应器,测得过程中出口NO2浓度变化如图。

①t1时刻前,NO2的浓度接近0,原因是____ 。
②t2时刻,切换至贫氧条件,NO2的浓度急剧上升又快速下降的原因是____ 。

(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ·mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H3=
(2)①存储阶段:Ba存储NO2后转化为Ba(NO3)2的化学方程式是
②还原阶段:NO2从Ba(NO3)2中释放,然后在Pt的表面被CO、H2还原为N2。若参加反应的n(CO)=n(H2),则反应的n(CO):n(H2):n(NO2)=
(3)某实验小组模拟NSR系统中的一个存储、还原过程。让尾气通过NSR反应器,测得过程中出口NO2浓度变化如图。

①t1时刻前,NO2的浓度接近0,原因是
②t2时刻,切换至贫氧条件,NO2的浓度急剧上升又快速下降的原因是
您最近一年使用:0次
2022-06-13更新
|
302次组卷
|
3卷引用:北京市北京师范大学附属实验中学2021-2022学年高一下学期练习卷化学试题
名校
解题方法
10 . Ⅰ.红磷(P)和 可发生反应生成
可发生反应生成 和
和 ,反应中的能量关系如图所示。
,反应中的能量关系如图所示。

(1)写出P(s)和 (g)转化为
(g)转化为 (g)总反应的热化学方程式
(g)总反应的热化学方程式___________ 。
(2)一定条件下,在2L恒温恒容的密闭容器中充入0.1mol 发生反应
发生反应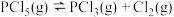 。
。
①下列说法可以判定该反应达到平衡状态的是___________ 。
a.容器内的压强保持不变
b.容器内的混合气体密度保持不变
c. 保持不变
保持不变
d.混合气体的平均相对分子质量保持不变
②若该反应达到平衡时Cl2的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。
Ⅱ.氢能源汽车通过燃料电池提供动力。一种燃料电池的结构如图所示。

(3)该电池正极是___________ (填“a”或“b”),电极反应式___________ 。
(4)另一极的电极反应式是___________ 。
 可发生反应生成
可发生反应生成 和
和 ,反应中的能量关系如图所示。
,反应中的能量关系如图所示。
(1)写出P(s)和
 (g)转化为
(g)转化为 (g)总反应的热化学方程式
(g)总反应的热化学方程式(2)一定条件下,在2L恒温恒容的密闭容器中充入0.1mol
 发生反应
发生反应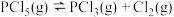 。
。①下列说法可以判定该反应达到平衡状态的是
a.容器内的压强保持不变
b.容器内的混合气体密度保持不变
c.
 保持不变
保持不变d.混合气体的平均相对分子质量保持不变
②若该反应达到平衡时Cl2的体积分数为
 ,则
,则 的平衡转化率为
的平衡转化率为Ⅱ.氢能源汽车通过燃料电池提供动力。一种燃料电池的结构如图所示。

(3)该电池正极是
(4)另一极的电极反应式是
您最近一年使用:0次



