解题方法
1 .  资源化利用是实现
资源化利用是实现 减排的首要途径。已知
减排的首要途径。已知 加氢制甲醇反应体系中,主要反应有
加氢制甲醇反应体系中,主要反应有
Ⅰ.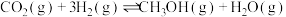


Ⅱ.


Ⅲ.

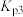
回答下列问题:
(1)
_______ 。
(2)在一定温度范围和压强范围内,只发生反应Ⅰ和Ⅱ,为了增大甲醇产率,理论上可采取的措施是_______ (写2点);
(3)已知反应Ⅰ和Ⅱ的 ,随温度的变化如图所示:
,随温度的变化如图所示:
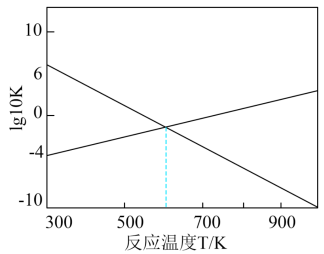
①300K时, 、
、 、
、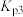 由大到小的顺序为
由大到小的顺序为_______ 。
②在600K、3MPa下,向密闭容器中充入2mol 和1mol
和1mol ,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程
,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程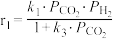 ,CO的生成速率方程
,CO的生成速率方程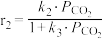 ,
, 、
、 为速率方程常数、
为速率方程常数、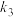 为常数。体系达到平衡时,
为常数。体系达到平衡时,
_______ , 的平衡转化率为
的平衡转化率为_______ 。
(4) 电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
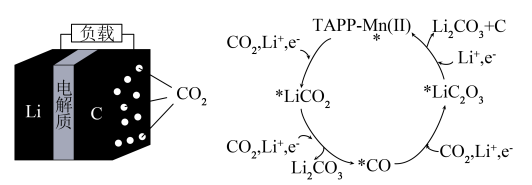
①该正极反应历程中有_______ 种中间产物;
②放电时,该电池的正极反应式为_______ 。
 资源化利用是实现
资源化利用是实现 减排的首要途径。已知
减排的首要途径。已知 加氢制甲醇反应体系中,主要反应有
加氢制甲醇反应体系中,主要反应有Ⅰ.
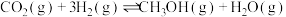


Ⅱ.



Ⅲ.


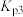
回答下列问题:
(1)

(2)在一定温度范围和压强范围内,只发生反应Ⅰ和Ⅱ,为了增大甲醇产率,理论上可采取的措施是
(3)已知反应Ⅰ和Ⅱ的
 ,随温度的变化如图所示:
,随温度的变化如图所示:
①300K时,
 、
、 、
、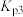 由大到小的顺序为
由大到小的顺序为②在600K、3MPa下,向密闭容器中充入2mol
 和1mol
和1mol ,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程
,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程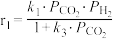 ,CO的生成速率方程
,CO的生成速率方程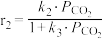 ,
, 、
、 为速率方程常数、
为速率方程常数、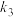 为常数。体系达到平衡时,
为常数。体系达到平衡时,
 的平衡转化率为
的平衡转化率为(4)
 电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
①该正极反应历程中有
②放电时,该电池的正极反应式为
您最近一年使用:0次
名校
2 . 在2L恒容密闭容器中投入4molA、2molB和催化剂,发生反应:2A(g)+B(g) 4C(g) △H>0,在不同温度下测得A的物质的量与时间t的关系如表所示。
4C(g) △H>0,在不同温度下测得A的物质的量与时间t的关系如表所示。
下列说法不正确的是
 4C(g) △H>0,在不同温度下测得A的物质的量与时间t的关系如表所示。
4C(g) △H>0,在不同温度下测得A的物质的量与时间t的关系如表所示。| t/min T/K | 0 | 4 | 8 | 12 | 16 |
| T1 | 4.0 | 3.3 | 2.8 | 2.5 | 2.4 |
| T2 | 4.0 | 3.2 | 2.6 | 2.6 | 2.6 |
| A.反应的温度:T1>T2 |
| B.T2温度下,催化剂活性更高 |
| C.T1温度下,到16min时,反应已达到平衡状态 |
| D.T2温度下,4~8min内,v(C)=0.15mol•L-1•min-1 |
您最近一年使用:0次
2024-03-10更新
|
58次组卷
|
2卷引用:四川省绵阳中学2023-2024学年高二下学期开学化学试题
名校
3 . 某密闭容器中含有X和Y,同时发生以下两个反应:① ;②
;② 。反应①的正反应速率
。反应①的正反应速率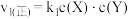 ,反应②的正反应速率
,反应②的正反应速率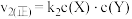 ,其中
,其中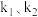 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度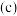 随时间
随时间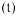 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
 ;②
;② 。反应①的正反应速率
。反应①的正反应速率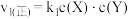 ,反应②的正反应速率
,反应②的正反应速率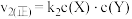 ,其中
,其中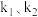 为速率常数。某温度下,体系中生成物浓度
为速率常数。某温度下,体系中生成物浓度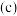 随时间
随时间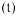 变化的曲线如图所示。下列说法正确的是
变化的曲线如图所示。下列说法正确的是
A. 时,正反应速率 时,正反应速率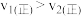 |
B.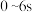 内,X的平均反应速率 内,X的平均反应速率 |
C.若升高温度, 时容器中 时容器中 的比值减小 的比值减小 |
| D.反应①的活化能大于反应② |
您最近一年使用:0次
2024-03-08更新
|
426次组卷
|
5卷引用:四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷
四川省成都市石室中学2023-2024学年高二下学期4月月考化学试卷2024届河北省各市高三下学期一模联考化学试题(已下线)选择题11-14(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河北省衡水市衡水董子高级中学2023-2024学年高三下学期3月月考化学试题
名校
4 . 工业生产硝酸的核心反应之一是在恒压装置中将NO转化为 :
:
反应Ⅰ:

目前认为反应Ⅰ分两步进行:
反应Ⅱ:
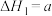
反应Ⅲ: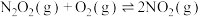
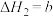
回答下列问题:
(1)已知: (C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
(C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
_____  。该工艺适宜的压强条件是
。该工艺适宜的压强条件是_____ (填“高压”或“低压”)。
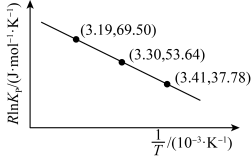
(2)Raoult定律表明:一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象_____ (用字母表示)。
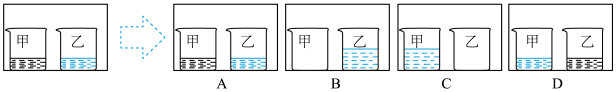
(3)控制原料比 ,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当
,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当 、90℃时,NO转化率达到50%的过程中,
、90℃时,NO转化率达到50%的过程中,
_____  (保留3位有效数字)。
(保留3位有效数字)。
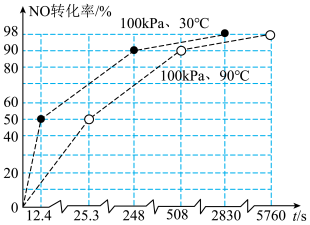
(4)由图可知,反应Ⅰ的速率随温度升高而_____ (填“增大”“减小”或“不变”),可能的原因是_____ 。[已知反应Ⅱ为快速平衡, ,反应Ⅲ的速率方程为
,反应Ⅲ的速率方程为 ]。
]。
(5)T℃、 时,控制原料比
时,控制原料比 发生反应Ⅰ(
发生反应Ⅰ( 由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
_____ 。
(6)已知不同温度下反应Ⅰ的浓度平衡常数 如表。
如表。
NO由 催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有
催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有_____ (写出两条即可)。
 :
:反应Ⅰ:


目前认为反应Ⅰ分两步进行:
反应Ⅱ:

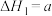
反应Ⅲ:
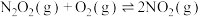
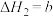
回答下列问题:
(1)已知:
 (C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
(C为常数),根据反应Ⅲ实验数据得到下图,则反应Ⅲ的反应热
 。该工艺适宜的压强条件是
。该工艺适宜的压强条件是
(2)Raoult定律表明:一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象

(3)控制原料比
 ,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当
,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图。当 、90℃时,NO转化率达到50%的过程中,
、90℃时,NO转化率达到50%的过程中,
 (保留3位有效数字)。
(保留3位有效数字)。
(4)由图可知,反应Ⅰ的速率随温度升高而
 ,反应Ⅲ的速率方程为
,反应Ⅲ的速率方程为 ]。
]。(5)T℃、
 时,控制原料比
时,控制原料比 发生反应Ⅰ(
发生反应Ⅰ( 由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
由空气带入,不参与反应),NO平衡转化率为80%,写出该反应压强平衡常数的计算式:
(6)已知不同温度下反应Ⅰ的浓度平衡常数
 如表。
如表。| 温度/℃ | 27 | 77 | 127 | 177 | 227 | 500 |
平衡常数 | 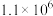 |  |  |  |  | 1.0 |
 催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有
催化氧化得到,而催化氧化后的产物气体往往高于800℃,为使反应Ⅰ顺利进行,再进行反应。“急剧冷却”的目的有
您最近一年使用:0次
解题方法
5 . 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量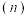 随着时间
随着时间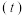 变化的曲线如图所示.下列说法正确的是
变化的曲线如图所示.下列说法正确的是

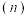 随着时间
随着时间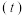 变化的曲线如图所示.下列说法正确的是
变化的曲线如图所示.下列说法正确的是
A.该反应的化学方程式为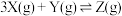 |
| B.混合气体的总质量不随时间的变化而变化,说明反应已达化学平衡状态 |
C.0到2min内用Y表示的平均反应速率为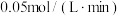 |
| D.达到平衡时X的转化率为30% |
您最近一年使用:0次
解题方法
6 . 一定条件下,在2L密闭容器中发生反应: ,测得
,测得 内,
内,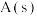 的物质的量减少了
的物质的量减少了 ,则
,则 内该反应的平均速率为
内该反应的平均速率为
 ,测得
,测得 内,
内,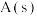 的物质的量减少了
的物质的量减少了 ,则
,则 内该反应的平均速率为
内该反应的平均速率为A. | B. |
C. | D. |
您最近一年使用:0次
解题方法
7 . 丙烯是重要的有机化工原料,丙烷脱氢是工业生产丙烯的重要途径,其化学方程式为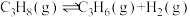 。回答下列相关问题:
。回答下列相关问题:
(1)已知:I.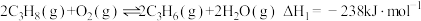
Ⅱ.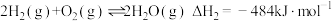
则丙烷脱氢制丙烯反应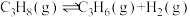 的
的 为
为___________  ,该反应在
,该反应在___________ (填“高温”“低温”“任何温度”)条件下可以自发进行。
(2)一定温度下,向1L的密闭容器中充入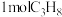 发生脱氢反应,经过
发生脱氢反应,经过 达到平衡状态,测得平衡时气体压强是开始的1.6倍。
达到平衡状态,测得平衡时气体压强是开始的1.6倍。
① 丙烯的化学反应速率
丙烯的化学反应速率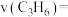
___________  。
。
②欲提高反应的速率和丙烷转化率,可采取的措施是___________ 。
A.缩小容积 B.加催化剂 C.升高温度 D.及时分离出H2
E.体积不变充入丙烷 F.体积不变充入Ar
③下列叙述能说明反应到达平衡状态的是________
A.容器内气体的总压强不变 B.容器内气体密度不变
C.C3H6的浓度不再变化 D. 容器内气体平均摩尔质量不再变化
E.单位时间内消耗amolC3H8同时生成amolH2
④若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是___________ 。
(3)一定温度下,向2L恒容密闭容器中充入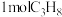 ,平衡时总压强为
,平衡时总压强为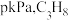 的气体体积分数与反应时间的关系如图:
的气体体积分数与反应时间的关系如图:
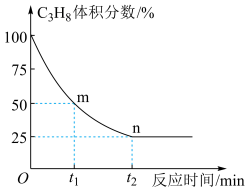
此温度下该反应的平衡常数Kp=___________ (用含字母p的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×气体的体积分数)。平衡后,继续向容器中充入1molC3H8,则 =
=___________ (填“增大”、“减小”或“不变”)。其中v正=k正·p(C3H8 ),v逆=k逆·p( C3H6)·p(H2)。
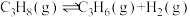 。回答下列相关问题:
。回答下列相关问题:(1)已知:I.
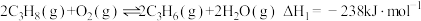
Ⅱ.
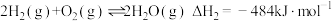
则丙烷脱氢制丙烯反应
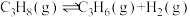 的
的 为
为 ,该反应在
,该反应在(2)一定温度下,向1L的密闭容器中充入
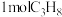 发生脱氢反应,经过
发生脱氢反应,经过 达到平衡状态,测得平衡时气体压强是开始的1.6倍。
达到平衡状态,测得平衡时气体压强是开始的1.6倍。①
 丙烯的化学反应速率
丙烯的化学反应速率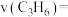
 。
。②欲提高反应的速率和丙烷转化率,可采取的措施是
A.缩小容积 B.加催化剂 C.升高温度 D.及时分离出H2
E.体积不变充入丙烷 F.体积不变充入Ar
③下列叙述能说明反应到达平衡状态的是
A.容器内气体的总压强不变 B.容器内气体密度不变
C.C3H6的浓度不再变化 D. 容器内气体平均摩尔质量不再变化
E.单位时间内消耗amolC3H8同时生成amolH2
④若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始
 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是(3)一定温度下,向2L恒容密闭容器中充入
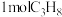 ,平衡时总压强为
,平衡时总压强为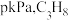 的气体体积分数与反应时间的关系如图:
的气体体积分数与反应时间的关系如图:
此温度下该反应的平衡常数Kp=
 =
=
您最近一年使用:0次
解题方法
8 . 太阳能甲烷—水蒸气重整制氢技术因具有原料储量丰富、成本低、产量高等特点而被广泛采用。制氢的反应为 。
。
(1)已知:几种化学键的键能(键能为 气态分子离解成气态原子所吸收的能量或气态原子形成
气态分子离解成气态原子所吸收的能量或气态原子形成 气态分子所释放的能量)如下表。
气态分子所释放的能量)如下表。
反应: 的
的
______  。
。
(2)加压使 平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是
平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是____________ (填一条即可,下同),为弥补加压带来的不利因素,可采取的措施为______ 。
(3) 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和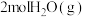 ,发生上述反应,
,发生上述反应, 达平衡,
达平衡, 的平衡转化率为
的平衡转化率为 。
。
① 内,
内,
______  。
。
②
______ 。
③平衡后保持温度和容积不变,若再向容器中充入 和
和 ,此时
,此时
______ (选填“>”、“<”或“=”)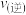 。
。
 。
。(1)已知:几种化学键的键能(键能为
 气态分子离解成气态原子所吸收的能量或气态原子形成
气态分子离解成气态原子所吸收的能量或气态原子形成 气态分子所释放的能量)如下表。
气态分子所释放的能量)如下表。化学键 |
|
|
|
|
键能 | 413 | 463 | 436 | 1071 |
 的
的
 。
。(2)加压使
 平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是
平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是(3)
 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和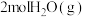 ,发生上述反应,
,发生上述反应, 达平衡,
达平衡, 的平衡转化率为
的平衡转化率为 。
。①
 内,
内,
 。
。②

③平衡后保持温度和容积不变,若再向容器中充入
 和
和 ,此时
,此时
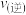 。
。
您最近一年使用:0次
名校
解题方法
9 . 在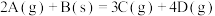 反应中,表示反应速率最快的是
反应中,表示反应速率最快的是
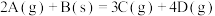 反应中,表示反应速率最快的是
反应中,表示反应速率最快的是A. | B. |
C. | D.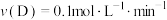 |
您最近一年使用:0次
2024-01-22更新
|
210次组卷
|
2卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期1月期末考试化学试题
解题方法
10 . 碳的资源化利用是实现碳中和目标的重要环节,将碳氧化物催化氢化制备燃料甲醇,对绿色化与可持续发展意义重大。已知催化氢化时同时存在:
反应I: (主反应)
(主反应)
反应Ⅱ: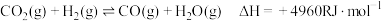 (R为大于0的常数,下同)
(R为大于0的常数,下同)
反应Ⅲ: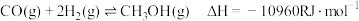
回答下列问题:
(1)在500K下,增大 平衡产率的方法有
平衡产率的方法有___________ (写两条)。
(2)目前应着力开发活性温度___________ (填“更低”或“更高”)的催化剂。
(3)已知 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的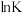 如下表中数据:
如下表中数据:
(i)反应I的
___________ (填“>”或“<”)0,判断理由是___________ 。
(ii)反应I的
___________  (用含常数R的式子表示)。
(用含常数R的式子表示)。
(4)判断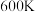 时,反应
时,反应___________ (填“I”或“Ⅲ”)在热力学上趋势更大。
(5)在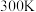 、恒压
、恒压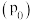 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(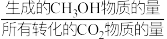 )为50%。
)为50%。
(i)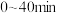 时,
时,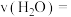
___________ 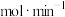 。
。
(ii)反应I的分压平衡常数
___________ (列出计算式)。
反应I:
 (主反应)
(主反应)反应Ⅱ:
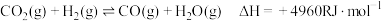 (R为大于0的常数,下同)
(R为大于0的常数,下同)反应Ⅲ:
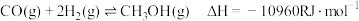
回答下列问题:
(1)在500K下,增大
 平衡产率的方法有
平衡产率的方法有(2)目前应着力开发活性温度
(3)已知
 (K为平衡常数,
(K为平衡常数, 、R和C均视为常数),反应Ⅰ在不同温度T下的
、R和C均视为常数),反应Ⅰ在不同温度T下的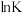 如下表中数据:
如下表中数据: | 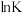 |
| 300 | 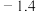 |
| 600 | 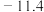 |

(ii)反应I的

 (用含常数R的式子表示)。
(用含常数R的式子表示)。(4)判断
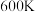 时,反应
时,反应(5)在
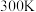 、恒压
、恒压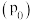 容器中加入
容器中加入 和
和 ,发生上述反应I和Ⅱ,
,发生上述反应I和Ⅱ, 后达平衡,
后达平衡, 平衡转化率为20%,甲醇的选择性(
平衡转化率为20%,甲醇的选择性(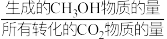 )为50%。
)为50%。(i)
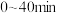 时,
时,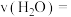
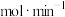 。
。(ii)反应I的分压平衡常数

您最近一年使用:0次
2024-01-06更新
|
246次组卷
|
2卷引用:2024届四川省成都市高中毕业班第一次诊断性检测理科综合








