名校
1 . 氮的氧化物既是空气的主要污染物,也是重要的化工原料。回答下列问题:
(1)已知
Ⅰ、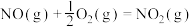 ,
,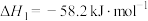 ;
;
Ⅱ、 ,
,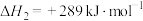 。
。
则反应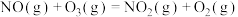 的△H=
的△H=___________ 。又知 ,反应机理为
,反应机理为 (快反应),
(快反应), (慢反应),则活化能较小的是反应是
(慢反应),则活化能较小的是反应是___________ (填“快反应”或“慢反应”)。
(2)若用 、
、 分别表示正、逆反应的速率常数(只受温度影响),反应
分别表示正、逆反应的速率常数(只受温度影响),反应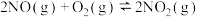 △H<0的
△H<0的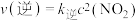 ,
, ,则该反应的正反应速率v(正)、
,则该反应的正反应速率v(正)、 、反应物浓度之间的关系式为
、反应物浓度之间的关系式为___________ 。
(3)在不同压强下,向某恒容密闭容器中通入初始浓度为2
 、6
、6 NO,使其发生反应
NO,使其发生反应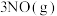
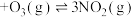 ,
,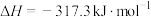 ,测得平衡时
,测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:
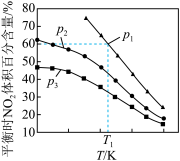
① 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,为提高NO的转化率,可采取的措施是___________ (写两点)。
②若 、
、 时,反应开始到达到平衡的时间为10s,则此阶段中
时,反应开始到达到平衡的时间为10s,则此阶段中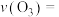
___________ (用分数表示),平衡常数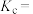
___________ 。
(1)已知
Ⅰ、
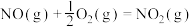 ,
,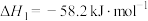 ;
;Ⅱ、
 ,
,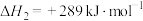 。
。则反应
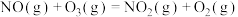 的△H=
的△H= ,反应机理为
,反应机理为 (快反应),
(快反应), (慢反应),则活化能较小的是反应是
(慢反应),则活化能较小的是反应是(2)若用
 、
、 分别表示正、逆反应的速率常数(只受温度影响),反应
分别表示正、逆反应的速率常数(只受温度影响),反应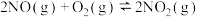 △H<0的
△H<0的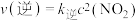 ,
, ,则该反应的正反应速率v(正)、
,则该反应的正反应速率v(正)、 、反应物浓度之间的关系式为
、反应物浓度之间的关系式为(3)在不同压强下,向某恒容密闭容器中通入初始浓度为2

 、6
、6 NO,使其发生反应
NO,使其发生反应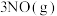
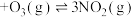 ,
,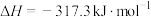 ,测得平衡时
,测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:
①
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②若
 、
、 时,反应开始到达到平衡的时间为10s,则此阶段中
时,反应开始到达到平衡的时间为10s,则此阶段中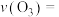
您最近半年使用:0次
名校
解题方法
2 . 对于可逆反应: (正反应放热),下列图像中正确的是
(正反应放热),下列图像中正确的是
 (正反应放热),下列图像中正确的是
(正反应放热),下列图像中正确的是A.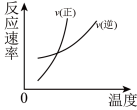 | B.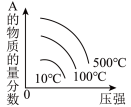 | C. | D. |
您最近半年使用:0次
2022-11-16更新
|
541次组卷
|
17卷引用:贵州省贵州铜仁伟才学校2022-2023学年高二上学期12月月考化学试题
贵州省贵州铜仁伟才学校2022-2023学年高二上学期12月月考化学试题2015届湖南省常德一中高三上学期第五次月考化学试卷【全国百强校】黑龙江省哈尔滨市第三中学校2018-2019学年高二(理)上学期期中考试化学试题安徽省合肥市六校2019-2020学年高二上学期期末考试化学试题重庆市凤鸣山中学2018-2019学年高二上学期期中考试化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)海南省海口市第四中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象四川省成都外国语学校2020-2021学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期期末考试化学试题四川省遂宁市第二中学2020-2021学年高二上学期期中考试化学试题海南省华中师范大学海南附属中学2021-2022学年高二上学期第一次月考化学试题甘肃省天水市第一中学2021-2022学年高二下学期开学检测化学试题四川省广安市第二中学校2022-2023学年高二上学期11月期中考试化学试题四川省成都市东部新区养马高级中学2021-2022学年高二上学期期中考试化学试题四川省凉山州宁南中学2023-2024学年高二上学期第一次月考化学试题广东省惠州市博罗县博罗中学2023-2024学年高二上学期高二10月月考化学试题
名校
3 . 对于可逆反应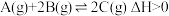 ,下列图像中正确的是
,下列图像中正确的是
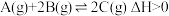 ,下列图像中正确的是
,下列图像中正确的是A.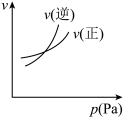 | B.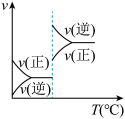 | C.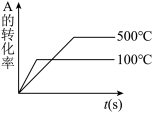 | D.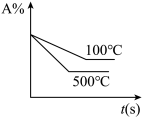 |
您最近半年使用:0次
2022-11-13更新
|
137次组卷
|
75卷引用:2016-2017学年贵州省思南中学高二上半期考试化学卷
2016-2017学年贵州省思南中学高二上半期考试化学卷贵州省思南中学2017-2018学年高二上学期第一次月考化学试题(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年四川省金堂中学高二下学期期中考试化学试卷 (已下线)2012-2013学年广东东莞第七高级中学高二上期中考试化学试卷(已下线)2013-2014学年广东省肇庆市高二上学期末考试化学试卷(已下线)2013-2014北京市房山区下学期高二期末测验化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷(已下线)2014-2015学年吉林省汪清县第六中学高二上学期期中考试化学试卷2014-2015学年重庆复旦中学高二上学期期中化学试卷2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷2015-2016学年河南省鄢陵高级中学高二上学期第二次月考化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016北京大学附中宇华教育集团高一12月化学卷2015-2016学年安徽省钱桥中学、泥河中学高二上12月联考化学试卷2015-2016学年安徽省六安一中高二上第一阶段测化学试卷2015-2016学年宁夏吴忠中学高二下开学考试化学试卷2015-2016学年贵州省大方一中高二上学期期末化学试卷2015-2016学年河北省邢台一中高一下期中化学试卷2015-2016学年广西南宁市二十六中高二下学期期中化学试卷2015-2016学年云南省云天化中学高二下期中理综化学试卷2016-2017学年浙江省温州中学高二上10月月考化学试卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷2016-2017学年西藏山南二中高二上学期期中化学试卷浙江省2018版考前特训(2017年10月)学考70快练:化学反应速率及反应限度辽宁省庄河市高级中学2017-2018学年高二上学期开学考试化学试题吉林省长春外国语学校2017-2018学年高一上学期开学测试化学试题甘肃省武威市第六中学2017-2018学年高二上学期第一次学段考试化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题陕西省渭南市尚德中学2017-2018学年高二上学期期中考试化学试卷山东省枣庄市第三中学2017-2018学年高二第六学段学情调查(1月)化学试题贵州省毕节市实验高级中学2017-2018学年高二上学期期末考试化学试题安徽省滁州市民办高中2017-2018学年高一下学期第二次月考化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高一下学期期末考试化学试题云南省腾冲市第八中学2017-2018学年高二下学期期末考试化学试题广东省蓝精灵中学2018-2019学年高二上学期联考化学试题2017-2018学年鲁科版高二化学选修4第二章第一节化学反应的方向作业题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期10月月考化学试题西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区伊宁市生产建设兵团四师一中2018-2019学年高二上学期期中考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高二上学期期中考试化学试题江苏省邗江中学2018-2019学年高二下学期期中考试化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题安徽省芜湖市城南实验中学2019-2020学年高二上学期期中考试化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题贵州省金沙中学2019年普通高中学生学业基础水平测试化学试题(已下线)【南昌新东方】江西省九江一中2014-2015学年高二上学期期中化学试卷河北省邢台市第二中学2019-2020学年高二下学期开学考试化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精练)-2021年高考化学一轮复习讲练测河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题广东省佛山市第一中学2020-2021学年高二上学期第一次段考化学(选考)试题黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题西藏日喀则市上海实验学校2019-2020学年高二上学期期末考试化学试题新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二下学期期初考试化学试题江苏省宿迁市沭阳县潼阳中学2020-2021学年高二下学期第一次月考化学试题福建省南安市柳城中学2020-2021学年高二上学期第二次月考化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期段考(期中)化学试题吉林省延边第二中学2020-2021学年高二上学期第一次考试月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题广东省广州市北师大附中为明学校2021-2022学年高二10月月考化学试题河南省平顶山九校联盟2021-2022学年高二上学期期中考试化学试题广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题湖北省部分高中联考协作体2022-2023学年高二上学期期中考试化学试题(已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像河南省南阳市2022-2023学年高二下学期期末考试化学试题(已下线)第4讲 化学反应速率及平衡图像江西省南昌市第一中学2023-2024学年高二上学期10月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题浙江省杭州东方中学2023-2024学年高二上学期期中考试化学试题河南省郑州学森实验学校2023-2024学年高二上学期期中考试 化学试题
4 . 对已经达到化学平衡的反应: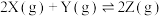 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是
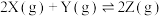 ,减小压强时,对反应产生的影响是
,减小压强时,对反应产生的影响是| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
您最近半年使用:0次
2022-11-02更新
|
729次组卷
|
97卷引用:【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题
【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2010—2011学年浙江省杭州学军中学高二下学期期中考试化学试卷(已下线)2010—2011学年内蒙古赤峰二中高一下学期期末考试化学试卷(已下线)2011-2012学年山东省鲁北中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市邹城二中高二上学期期中质量检测化学试卷(已下线)2011-2012学年云南省玉溪一中高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2012-2013学年江苏省南京三中高二下学期期中考试化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2014-2015学年河南周口市沈丘县县直高级中学高二上第一次月考化学(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014秋安徽省淮北师范大学附属实验中学高二上学期期中化学试卷2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2015-2016学年青海西宁第十四中学高二上期中考试化学卷2015-2016学年陕西省澄城县寺前中学高一下学期期中考试化学试卷(已下线)同步君 人教版 选修4 第2章 第3节 化学平衡状态2016-2017学年湖北省襄阳五中高二上开学考试化学试卷2016-2017学年河北省博野中学高二上学期第二次月考化学试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷2016-2017学年甘肃省民乐一中高二上10月月考化学试卷2016-2017学年山东省桓台二中高二12月检测化学试卷辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题云南省德宏州芒市第一中学2017-2018学年高二上学期期中考试化学试题山东省济南第一中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)【全国省级联考】广东省蓝精灵中学2017-2018 学年度高二上学期期末联考化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高二上学期第一次月考化学试题甘肃省岷县一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题四川省宜宾市第四中学2018-2019学年高二上学期期中考试理科综合化学试题高二人教版选修4 第二章 第三节 化学平衡河北省承德市第一中学2018-2019学年高二上学期第三次月考化学试题甘肃省镇原县孟坝中学2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区沙雅县第二中学2018-2019学年高二上学期期中考试化学试题河南省永城市实验高级中学2018-2019学年高二上学期期中考试化学试题辽宁省大连渤海高级中学2018-2019学年高二下学期期中考试化学试题上海市华东师范大学附属天山学校2018-2019学年高一第二学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二10月月考化学试题湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题甘肃省张掖市山丹县第一中学2019-2020学年上学期9月月考--高二化学江西省宜春九中(外国语学校)2019-2020学年高二上学期期中考试化学试题吉林省蛟河市朝鲜族中学校2019-2020学年高二上学期期中考试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题新疆沙雅县第二中学2019-2020学年高二上学期期中考试化学试题贵州省毕节市实验高级中学2018-2019学年高二上学期期末考试化学试题湖南省邵阳市洞口县第四中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二上学期期末考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题陕西省延安市吴起高级中学2019-2020学年高一下学期第四次质量检测(期末)化学试题黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题海南省海口市第四中学2020-2021学年高二上学期第一次月考化学试题吉林省通化县综合高级中学2020-2021学年高二上学期期中考试化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时3 影响化学平衡的因素河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试题河北省张家口宣化一中2020-2021学年高二上学期12月月考化学试题黑龙江漠河市高级中学2020-2021学年高二上学期期末考试化学试题湖北省十堰市2020-2021学年高二上学期期末考试化学试题广东省惠州市2020-2021学年高二上学期期末考试化学试题福建省莆田第十五中学2018-2019学年高二上学期期末考试化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题广东省惠州市2020-2021学年高二上学期期末质量监测化学试题吉林长春市榆树高级中学2019-2020学年高二下学期期末考试化学试题湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题河南省开封市五县2020-2021学年高二上学期期末考试化学试题选择性必修1(SJ)专题2第三单元 化学平衡的移动山东省山大附中卧龙学校2021-2022学年高二上学期第一次月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期中考试化学试题内蒙古乌兰察布市部分学校2021-2022学年高二上学期期中联考化学试题青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省随州市洛平许济四市联盟2022-2023学年高三上学期第一次质量检测化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题河南省灵宝市第五高级中学2021-2022学年高二下学期第一次月考化学试题甘肃省临夏州临夏县中学2021-2022学年高二上学期期中考试化学(B卷)试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题广东省阳江市高新区2022-2023学年高二上学期1月期末考试化学试题作业(十二) 压强对化学平衡的影响 勒·夏特列原理
名校
5 . 在一密闭容器中,反应aX(g) bY(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,Y的浓度是原来的60%,则
bY(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,Y的浓度是原来的60%,则
 bY(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,Y的浓度是原来的60%,则
bY(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,Y的浓度是原来的60%,则| A.平衡向正反应方向移动了 | B.物质X的转化率减小了 |
| C.物质Y的质量分数降低了 | D.a>b |
您最近半年使用:0次
2021-05-25更新
|
346次组卷
|
76卷引用:贵州省铜仁伟才学校2017-2018学年高二上学期期中考试化学(理)试题
贵州省铜仁伟才学校2017-2018学年高二上学期期中考试化学(理)试题(已下线)2010年江苏省淮安市淮阴区高二第二学期期末化学试卷(已下线)2010年青海省青海师大附中高二上学期期中考试化学试卷(已下线)2010—2011学年内蒙古赤峰二中高一下学期期末考试化学试卷(已下线)2011-2012年河北省南宫中学高二上学期9月份月考化学(理)试卷(已下线)2011-2012年广东省汕头市金山中学高二上学期期中考试化学试卷(理科)(已下线)2011-2012学年贵州省湄潭中学高二上学期期末考试化学试卷(已下线)2011-2012学年福建省龙岩一中上学期高二期末考试化学试卷(已下线)2011-2012学年山西省康杰中学高二下学期期中考试化学试卷(已下线)2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(已下线)2013届辽宁省实验中学分校高三12月月考化学试卷(已下线)2012-2013学年陕西省长安一中高二下学期期中考试化学试卷(已下线)2013-2014学年河北省遵化市高二上学期期中质量检测化学试卷(已下线)2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(已下线)2014届江西省九江一中上学期期中考试高二化学试卷2014-2015河南省濮阳市一中高二上学期第三次质量检测化学试卷2014-2015河南省濮阳市一中高二上学期第三次月考化学试卷2014-2015江西省德镇市高二上学期期末化学试卷2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2015-2016学年重庆市杨家坪中学高二上学期第一次月考化学试卷2016届浙江省建人高复学校高三上学期第三次月考化学试卷2015-2016学年浙江省桐乡市高级中学高二上期中(普通班)化学试卷2015-2016学年吉林省松原市油田高中高一下期中化学试卷2015-2016学年辽宁省实验中学分校高一下学期6月月考化学试卷2017届山东省滕州市第二中学高三上学期10月月考化学试卷2016-2017学年河北省卓越联盟高二上第一次月考化学试卷2016-2017学年甘肃省民乐一中高二上10月月考化学试卷2016-2017学年黑龙江哈尔滨六中高二上期末化学卷2016-2017学年湖南省长沙市第一中学高二上学期期末考试化学试卷安徽省蚌埠市第二中学2017-2018学年高二8月月考化学试题2018版化学(苏教版)高考总复习专题七增分补课7--化学平衡分析中的虚拟过程--化学反应的方向和限度新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题(已下线)2018年9月19日 《每日一题》人教选修4-平衡转化率的判断新疆维吾尔自治区昌吉市第四中学2018-2019学年第一学期高二第一次月考化学试题四川省成都市实验中学2018-2019学年高二上学期期中模拟考试化学试题【校级联考】江西省南昌市八一中学、洪都中学七校2018-2019学年高二上学期期中考试化学试题【全国百强校】湖南省衡阳市第一中学2018-2019学年高二上学期期中考试化学试题新疆自治区昌吉市第九中学2018-2019学年高二上学期第二次月考化学试题山东省微山县第二中学2018-2019学年高二上学期第三学段教学质量监测化学试题河北省承德第一中学2019-2020学年高二上学期开学考试化学试题河北省大名县第一中学2019-2020学年高二9月月考化学试题河北省邯郸大名一中2019-2020学年高二上学期第一次月考化学试题浙江省台州市五校2020届高三10月联考化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题天津市静海区大邱庄中学等四校2019-2020学年高二10联考化学试题安徽省蚌埠铁路中学2019-2020学年高二上学期期中考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高二上学期期中考试化学试题安徽省滁州市六校2019-2020学年高二12月联考化学试题宁夏贺兰县景博中学2019-2020学年高二上学期第一次月考化学试题河南省三门峡市第一高级中学2020-2021学年高二上学期9月月考化学试题宁夏银川市第二中学2020-2021学年高二上学期月考(一)化学试题山西省朔州市怀仁县怀仁一中云东校区2020-2021学年高二上学期第二次月考化学试题安徽省马鞍山市含山县含山中学2020-2021学年高二上学期第一次月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题辽宁省锦州市义县高级中学2020-2021学年高二10月月考化学试题四川省广安市武胜烈面中学校2020-2021学年高二上学期10月月考化学试题湖北省汉川市第二中学2020-2021学年高二上学期期中考试化学试题海南省海口市灵山中学2019—2020学年高二上学期期中测试化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题(已下线)作业06 化学反应的调控-2021年高二化学暑假作业(人教版2019)重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题海南省东方市琼西中学2021-2022学年高二上学期第一次月考化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题陕西省渭南市咸林中学2021-2022学年高二上学期第三阶段检测化学试题(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)内蒙古包头市第四中学2020-2021学年高二上学期第一次月考化学试题重庆市石柱中学校2021-2022学年高二上学期第一次月考化学试题山东省枣庄滕州市第一中学2022-2023学年高二上学期10月月考化学试题苏教2020版选择性必修1专题2第三单元 化学平衡的移动课后习题辽宁省大连庄河市高级中学2022-2023学年高二上学期12月月考化学(B卷)试题宁夏中卫市中宁县2022-2023学年高二上学期质量测查(期末)化学试题2.3.1浓度 压强变化对化学平衡的影响 课中重庆市璧山来凤中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
6 . 在一个体积为1L的密闭容器中发生某化学反应:2A(g) B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
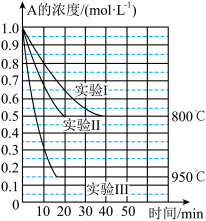
(1)在实验Ⅰ中,反应在20~40min内A的平均反应速率为__ mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是___ 。
(2)该反应的ΔH___ 0,其判断理由是___ 。
(3)实验Ⅰ第40min末,若降低反应温度,达到新的平衡后,A的浓度不可能为___ (填序号)。
A.0.35mol·L-1 B.0.4mol·L-1 C.0.7mol·L-1 D.0.8mol·L-1
(4)若反应在800℃进行,在该1L的密闭容器中加入1molA、0.2molHe,达到平衡时A的转化率应___ 。
A.等于86% B.等于50% C.小于50% D.介于50%~86%之间
 B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题: 
(1)在实验Ⅰ中,反应在20~40min内A的平均反应速率为
(2)该反应的ΔH
(3)实验Ⅰ第40min末,若降低反应温度,达到新的平衡后,A的浓度不可能为
A.0.35mol·L-1 B.0.4mol·L-1 C.0.7mol·L-1 D.0.8mol·L-1
(4)若反应在800℃进行,在该1L的密闭容器中加入1molA、0.2molHe,达到平衡时A的转化率应
A.等于86% B.等于50% C.小于50% D.介于50%~86%之间
您最近半年使用:0次
2019-11-25更新
|
372次组卷
|
8卷引用:贵州省铜仁市松桃民族中学2023-2024学年高二上学期9月月考化学试题
贵州省铜仁市松桃民族中学2023-2024学年高二上学期9月月考化学试题(已下线)2.3.2 影响化学平衡状态的因素高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)新疆自治区阿克苏地区库车县伊西哈拉镇中学2018-2019学年高二上学期期中考试化学试题湖南省株洲市茶陵县第三中学2019-2020学年高二上学期期中考试化学(选考)试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡(已下线)练习7 化学平衡(二)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记
名校
7 . t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:
xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成B的平均反应速率为_____________ 。
(2)x=__________ ,平衡常数K=_________ ,A的转化率为_____________ 。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)________________ 。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为______________ 。
 xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:
xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:(1)从开始反应至达到平衡状态,生成B的平均反应速率为
(2)x=
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为
您最近半年使用:0次
名校
8 . 图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的反应是


A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
B.2SO2(g)+O2(g) 2SO3(g)ΔH< 0 2SO3(g)ΔH< 0 |
C.H2(g)+I2(g) 2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.C(s)+H2O(g) CO(g)+H2(g)ΔH>0 CO(g)+H2(g)ΔH>0 |
您最近半年使用:0次
2018-11-29更新
|
323次组卷
|
31卷引用:【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题
【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2010年安徽师大附中高二第二学期期中考查(已下线)2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷(已下线)天津市塘沽一中等三校2011-2012学年高二上学期期末联考化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2011-2012学年陕西省三原县北城中学高二上学期期中考试化学试卷(已下线)2012-2013学年天津市天津一中高二上学期期中考试化学试卷(已下线)2013-2014学年江西省南昌市高二上学期期中测试理科化学试卷(乙)(已下线)2013-2014吉林省长春市十一中高一下学期期末考试化学试卷2014-2015吉林省吉林市一中高二上学期期末化学试卷2014-2015河北省邢台市高二上学期期末考试化学试卷2014-2015学年河南省扶沟县高级中学高一5月月考化学试卷2015-2016学年河南省扶沟县高级中学高二开学考试化学试卷2015-2016学年湖北省宜昌市部分示范高中高二上期中测试化学试卷2015-2016学年浙江台州中学高二上第三次统练化学试卷2015-2016浙江宁波效实中学高二上期中考试化学试题卷2015-2016学年陕西省长安区一中高二上期末理化学试卷2016-2017学年河南省漯河中学高二上第一次月考化学卷甘肃省临夏中学2016-2017学年高二上学期期末考试化学试题甘肃省白银市靖远县第四中学2018-2019学年高二上学期期中考试化学试题甘肃省定西市岷县第二中学2019-2020学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题河北省沧州市肃宁县第一中学2019-2020学年高二上学期第四次月考化学试题福建省莆田第一中学2019-2020学年高一下学期期中考试化学试题四川省简阳市阳安中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第3节 化学反应的速率 课时2 浓度、温度、催化剂对化学反应速率的影响新疆乌鲁木齐市第四中学2020-2021学年高二上学期期中考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题广东省普宁市第二中学2021-2022学年高二上学期期中考试化学试题
名校
9 . 下列事实不能用勒沙特列原理解释的是
| A.浓度均为0.1 mol·L-1的新制氯水,加入少量NaHSO3晶体,片刻后,溶液中HClO分子的浓度减小 |
| B.室温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL后,测得其pH<5 |
| C.在硫化氢水溶液中加入碱有利于S2—的生成 |
| D.增大压强更利于合成氨反应 |
您最近半年使用:0次
名校
10 . 在容积为1.00L的容器中,通入一定量的四氧化二氮,发生反应N2O4(g)⇌2NO2 (g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H=________ 0 (填“大于”“小于”)
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•S﹣1的平均速率降低,经10s又达到平衡.
①T________ 100℃(填“大于”“小于”)
②温度T 时反应达平衡后,将反应容器的容积减少一半,平衡向________ (填“正反应”或“逆反应”)方向移动,混合气体的颜色怎么变?________ .
(3)要增大该反应的K值,可采取的措施有(填序号)________ ;若要重新达到平衡时,使C(NO2 )/C(N2O4)值变小,可采取的措施有(填序号)________ .
A.增大四氧化二氮的起始浓度 B.向混合气体中通入二氧化氮
C.使用高效催化剂 D.升高温度.
(1)反应的△H=
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L﹣1•S﹣1的平均速率降低,经10s又达到平衡.
①T
②温度T 时反应达平衡后,将反应容器的容积减少一半,平衡向
(3)要增大该反应的K值,可采取的措施有(填序号)
A.增大四氧化二氮的起始浓度 B.向混合气体中通入二氧化氮
C.使用高效催化剂 D.升高温度.
您最近半年使用:0次



