1 . 异丁烯是一种重要的化工原料,主要用于制备甲基叔丁基醚、丁基橡胶、甲基丙烯腈等。将异丁烷脱氢制备异丁烯,可提高异丁烷的附加值,具有良好的经济与社会效益。回答下列问题。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
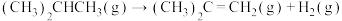 ∆H=
∆H=____________ kJ·mol-1。
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成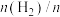 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。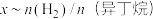 为曲线
为曲线_________ (填“M”或“N”),催化剂易被副反应产生的加聚产物__________ (填写结构简式)影响而失活。
(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是_____________ ,若生产过程中加入的空气过多,产生的主要问题是_____________ 。
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属_____________ (填元素符号)是酸性位点;而电负性较小的金属是碱性位点,吸附________________ (填“异丁烷”或“CO2”)。
(1)利用下列燃烧热数据,计算异丁烷直接脱氢生成异丁烯反应的∆H:
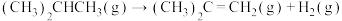 ∆H=
∆H=| 物质 | 异丁烷(g) | 异丁烯(g) | 氢气(g) |
| 燃烧热/(kJ·mol-1) | 2868 | 2700 | 286 |
(2)在恒温853K、恒压100kPa条件下,初始反应气体组成
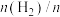 (异丁烷)或
(异丁烷)或 (异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
(异丁烷)与平衡时异丁烷的物质的量分数x的关系如下图所示。
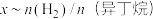 为曲线
为曲线(3)有人提出在恒温恒压条件下加入适量空气,采用异丁烷氧化脱氢的方法制备异丁烯。比较异丁烷直接脱氢制备异丁烯,从平衡产率角度分析该方法的优点是
(4)有人提出加入适量CO2,采用MgFe2O4催化CO2氧化异丁烷脱氢的方法制备异丁烯。催化过程中,反应物异丁烷、CO2先各自被催化剂上的不同位点吸附。催化剂中电负性较大的金属
您最近一年使用:0次
2024-03-22更新
|
116次组卷
|
2卷引用:江苏省南京市金陵中学2022-2023学年高二下学期期中考试 化学试卷
名校
解题方法
2 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应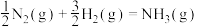 的
的
___________  。
。

(2)合成氮的原料混合气体的进料组成为 ;
;
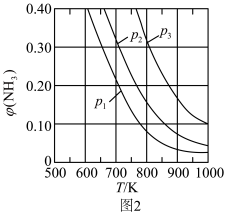
①在不同压强下反应达平衡时,氨的体积分数 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)由小到大 的顺序为___________ 。
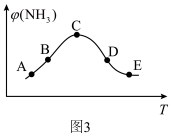
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中 的体积分数
的体积分数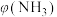 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定未达到 平衡的是___________ (填字母)。
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
(4)氮氧化物会造成环境污染,SCR技术利用 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
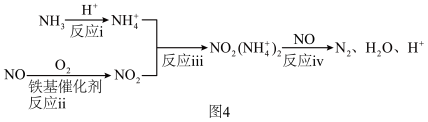
①对于反应ii: ,用
,用 表示的速率方程为
表示的速率方程为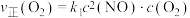 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则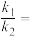
___________ (填数值)。
②根据上述机理,等物质的量的 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为___________ 。
(1)根据图1数据计算反应
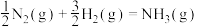 的
的
 。
。
(2)合成氮的原料混合气体的进料组成为
 ;
;①在不同压强下反应达平衡时,氨的体积分数
 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中
 的体积分数
的体积分数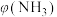 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
| A.采用较高温度(400~500℃) | B.将生成的氨液化并及时从体系中分离出来 |
| C.用铁触媒加快化学反应速率 | D.采用较高压强(20~50MPa) |
(4)氮氧化物会造成环境污染,SCR技术利用
 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
①对于反应ii:
 ,用
,用 表示的速率方程为
表示的速率方程为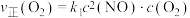 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则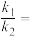
②根据上述机理,等物质的量的
 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为
您最近一年使用:0次
名校
3 . 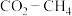 重整可获得
重整可获得 。
。 重整反应的热化学方程式为
重整反应的热化学方程式为
反应I: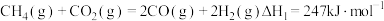
反应Ⅱ: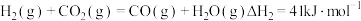
反应Ⅲ:
 下,将
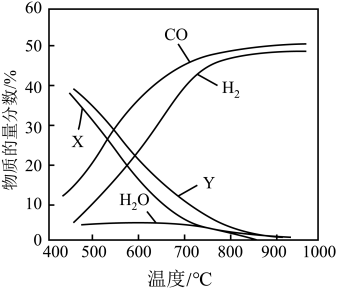
下,将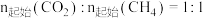 的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各气体组分的物质的量分数如图所示。下列说法
的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各气体组分的物质的量分数如图所示。下列说法不正确 的是
 重整可获得
重整可获得 。
。 重整反应的热化学方程式为
重整反应的热化学方程式为反应I:
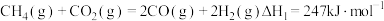
反应Ⅱ:
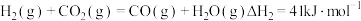
反应Ⅲ:

 下,将
下,将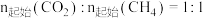 的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各气体组分的物质的量分数如图所示。下列说法
的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各气体组分的物质的量分数如图所示。下列说法
A.曲线X表示 |
B.反应 进行的程度很小 进行的程度很小 |
C.500℃, 时,向平衡体系中再充入一定量的 时,向平衡体系中再充入一定量的 ,达新平衡后, ,达新平衡后,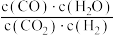 保持不变 保持不变 |
D.随着温度升高,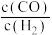 变小。原因是反应Ⅲ增大的程度小于反应Ⅱ增大的程度 变小。原因是反应Ⅲ增大的程度小于反应Ⅱ增大的程度 |
您最近一年使用:0次
2023-07-17更新
|
218次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
4 . 二甲醚催化制备乙醇主要涉及以下两个反应:
反应I:CO(g)+CH3OCH3(g)=CH3COOCH3(g)
反应II:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)
固定CO、CH3OCH3、H2的起始原料比为1∶1∶2、体系压强不变的条件下发生反应I、II,平衡时部分物质的物质的量分数随温度变化如图所示。下列说法不正确 的是

反应I:CO(g)+CH3OCH3(g)=CH3COOCH3(g)
反应II:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g)
固定CO、CH3OCH3、H2的起始原料比为1∶1∶2、体系压强不变的条件下发生反应I、II,平衡时部分物质的物质的量分数随温度变化如图所示。下列说法

| A.反应II为放热反应 |
| B.由图可知,600K以后随温度的升高,氢气物质的量减少 |
| C.曲线C也可以表示CH3OH的物质的量分数 |
| D.由500K上升至600K,温度对反应I的影响大于对反应II的影响 |
您最近一年使用:0次
2022-11-07更新
|
1290次组卷
|
4卷引用:江苏省南京外国语学校2022-2023学年高三上学期期末考试化学试题
名校
解题方法
5 . 将金红石(TiO2)转化为TiCl4是生产金属钛的关键步骤。在1.0×105Pa,将TiO2、C、Cl2以物质的量比1:2:2进行反应,平衡体系中主要物质的物质的量分数(x)随温度变化理论计算结果如图所示。
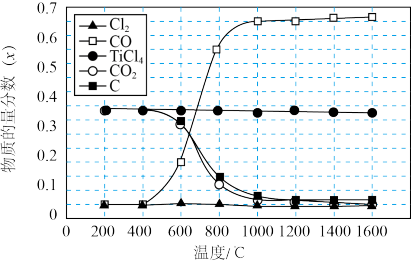
下列说法不 正确的是

下列说法
| A.200~1600℃反应达到平衡时,TiO2的转化率均已接近100% |
B.将400℃时的平衡体系加热至800℃,平衡C(s)+CO2(g) 2CO(g)向正反应方向移动 2CO(g)向正反应方向移动 |
| C.1000℃时,测得某时刻x(TiCl4)=0.2.其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4) |
| D.实际生产时反应温度选择900℃而不选择200℃,其主要原因是:900℃比200℃时化学反应速率更快,生产效益更高 |
您最近一年使用:0次
2022-09-08更新
|
1142次组卷
|
8卷引用:江苏省南京市2023届高三9月学情调研化学试题
江苏省南京市2023届高三9月学情调研化学试题江苏省南京师范大学附属中学江宁分校2022-2023学年高三上学期期末检测化学试题浙江省舟山市舟山中学2022-2023学年国庆返校检测高三化学试题江苏省常州市2022-2023学年高二下学期3月联合调研考试化学试题(已下线)2022年北京高考真题化学试题变式题(选择题11-14)(已下线)题型23 平衡常数、平衡转化率图象(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建江苏省无锡市第一中学2023-2024学年高三上学期综合练习(三)化学试题
21-22高三上·江苏·阶段练习
名校
6 . 工业上利用硫(S8)与CH4为原料制备CS2.450℃以上,发生反应I:S8(g)=4S2(g);通常在600℃以上发生反应II:2S2(g)+CH4(g)⇌CS2(g)+2H2S(g)。一定条件下,S8分解产生S2的体积分数、CH4与S2反应中CH4的平衡转化率与温度的关系图所示。下列说法一定正确的是


| A.反应II的正反应为吸热反应 |
| B.在恒温密闭容器中,反应相同时间,温度越低,CH4的转化率越大 |
| C.某温度下若S8完全分解成S2,在密闭容器中,n(S2)∶n(CH4)=2∶1开始反应,当CS2体积分数为10%时,CH4转化率为43% |
| D.发生反应Ⅱ温度不低于600℃的原因是:此温度CH4平衡转化率已很高;低于此温度,S2浓度小,反应速率慢 |
您最近一年使用:0次
2022-03-14更新
|
445次组卷
|
9卷引用:江苏省南京市中华中学 2021-2022学年高三上学期第一次月考化学试题
江苏省南京市中华中学 2021-2022学年高三上学期第一次月考化学试题(已下线)【苏州新东方】五中高三综合测试化学试题江苏省苏州八校联盟2021-2022学年高三上学期第二次适应性检化学试题(已下线)解密09 化学反应速率与化学平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)黄金卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)江苏省盐城市阜宁中学2021-2022学年高三下学期第三次综合测试化学试题(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)江苏省徐州市第七中学2021-2022学年高三下学期4月学情调研化学试题江苏省盐城中学2022-2023学年高三上学期阶段性质量检测化学试题
名校
解题方法
7 . 一定量的CO2与足量的碳在恒压(起始压强为P)密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
| A.一定温度下达到平衡后,充入一定量CO2 ,达到新平衡后,二氧化碳所占体积分数将变大 |
| B.该反应△H<0 |
| C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 |
D.650℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=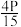 |
您最近一年使用:0次
2021-07-24更新
|
570次组卷
|
4卷引用:江苏省南京市南京第一中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
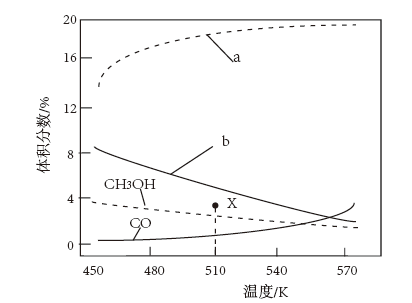
8 . 二氧化碳加氢合成二甲醚(CH3OCH3)具有重要的现实意义和广阔的应用前景。该方法主要涉及下列反应:
反应I:
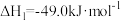
反应II:
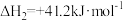
反应III: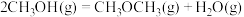
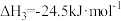
向恒压密闭容器中按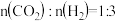 通入CO2和H2,平衡时各含碳物种的体积分数随温度的变化如图所示。下列有关说法正确的是
通入CO2和H2,平衡时各含碳物种的体积分数随温度的变化如图所示。下列有关说法正确的是
反应I:

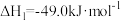
反应II:

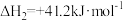
反应III:
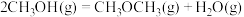
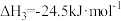
向恒压密闭容器中按
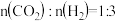 通入CO2和H2,平衡时各含碳物种的体积分数随温度的变化如图所示。下列有关说法正确的是
通入CO2和H2,平衡时各含碳物种的体积分数随温度的变化如图所示。下列有关说法正确的是
A.反应I的平衡常数可表示为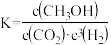 |
| B.图中曲线b表示CO2的平衡体积分数随温度的变化 |
| C.510 K时,反应至CH3OCH3的体积分数达到X点的值,延长反应时间不能提高CH3OCH3的体积分数 |
D.增大压强有利于提高平衡时CH3OCH3的选择性(CH3OCH3的选择性 ) ) |
您最近一年使用:0次
2021-05-10更新
|
1317次组卷
|
11卷引用:江苏省南京市2021届高三5月第三次模拟考试化学试题
江苏省南京市2021届高三5月第三次模拟考试化学试题(已下线)第21讲 化学平衡状态 化学平衡的移动(精练)-2022年高考化学一轮复习讲练测江苏省常熟市2021-2022学年高三上学期阶段性抽测一化学试题(已下线)2020年江苏卷化学高考真题变式题11-15江苏省扬州中学2021-2022学年高三下学期3月月考化学试题(已下线)押新高考卷09题 速率和平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)押江苏卷第14题 反应机理、化学反应速率与平衡 -备战2022年高考化学临考题号押题(江苏卷)江苏省南通市海安高级中学2022-2023学年高二上学期期中考试化学试题(已下线)专题17 化学平衡图表分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)江苏省盐城市实验高级中学2022-2023学年高三下学期第三次模拟考试化学试题(已下线)不定项选择题
名校
解题方法
9 . 下图所示与对应叙述相符的是
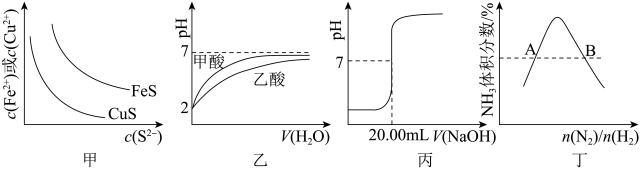

| A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,Ksp(FeS)>Ksp(CuS) |
| B.图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 |
| C.图丙表示用0.1000 mol·L-lNaOH溶液滴定20.00 mL硫酸的滴定曲线,则c(H2SO4)=0.1000 mol·L-1 |
| D.图丁表示反应N2(g)+3H2(g)⇌2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2) |
您最近一年使用:0次
名校
10 . 已知:CH4(g)+2H2S(g) CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示,下列说法正确的是( )
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示,下列说法正确的是( )
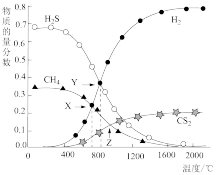
 CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示,下列说法正确的是( )
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示,下列说法正确的是( )
| A.该反应的ΔH<0 |
| B.X点CH4的转化率为20% |
| C.X点与Y点容器内压强比为51∶55 |
| D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆) |
您最近一年使用:0次
2020-06-22更新
|
163次组卷
|
4卷引用:江苏省南京盐城2018届高三年级第一次模拟考试化学试卷



