名校
1 . 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
| A.①⑥ | B.②⑤ | C.③④ | D.③⑤ |
您最近一年使用:0次
2020-10-06更新
|
384次组卷
|
2卷引用:人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 方法帮
解题方法
2 . 无水氯化铁是一种重要的化工原料,其熔点为306℃,沸点为315℃,极易潮解。工业制备氯化铁的一种工艺如下:

回答下列各题:
(1)向沸水中滴入几滴饱和氯化铁溶液,煮沸至溶液变为红褐色,该过程可用离子方程式表示为________________ 。
(2)由FeCl3·6H2O获得无水氯化铁的方法是_________ 。
(3) “氯化”时,若温度超过400℃产物中存在相对分子质量为325的物质,该物质的化学式为_______________ 。
(4)吸收塔内盛放的吸收剂为____________ 。
(5)某兴趣小组仿照工业制备无水氯化铁,设计如下实验:

①装置C中玻璃丝的作用为_____________ ;
②该实验设计存在的明显缺陷为_______________ ;
③通过下列实验测定实验后所得固体中FeCl3的质量分数。
a.称取mg所得固体,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;
b.取出10mL待测溶液液于锥形瓶中,加入稍过量的KI溶液充分反应;
c.以淀粉做指示剂,用bmol/LNa2S2O3溶液滴定(I2+2Na2S2O3=Na2S4O6+2NaI),共用去VmL。
通过上述实验测得所得固体中氯化铁的质量分数为_____________ ;若加入淀粉偏多,可能导致最终结果______ (填“偏大”“偏小”或“无影响”)。

回答下列各题:
(1)向沸水中滴入几滴饱和氯化铁溶液,煮沸至溶液变为红褐色,该过程可用离子方程式表示为
(2)由FeCl3·6H2O获得无水氯化铁的方法是
(3) “氯化”时,若温度超过400℃产物中存在相对分子质量为325的物质,该物质的化学式为
(4)吸收塔内盛放的吸收剂为
(5)某兴趣小组仿照工业制备无水氯化铁,设计如下实验:

①装置C中玻璃丝的作用为
②该实验设计存在的明显缺陷为
③通过下列实验测定实验后所得固体中FeCl3的质量分数。
a.称取mg所得固体,溶于稀盐酸,再转移到100mL容量瓶中,用蒸馏水定容;
b.取出10mL待测溶液液于锥形瓶中,加入稍过量的KI溶液充分反应;
c.以淀粉做指示剂,用bmol/LNa2S2O3溶液滴定(I2+2Na2S2O3=Na2S4O6+2NaI),共用去VmL。
通过上述实验测得所得固体中氯化铁的质量分数为
您最近一年使用:0次
3 . 设NA为阿伏加 德罗常数的值,下列说法正确的是
| A.用惰性电极电解MgSO4溶液,加入0.1molH2O能使溶液复原,则电路中转移的电子数为0.4NA |
| B.100g质量分数为46%的乙醇溶液中含有氢原子的数目为6NA |
| C.100mL 12mol•L-1 HNO3溶液与过量Cu反应,转移的电子数为0.6NA |
| D.1L 0.1mol•L-1 Na2CO3溶液中,阴离子总数大于0.1NA |
您最近一年使用:0次
名校
解题方法
4 . 某溶液可能含Na+、Fe3+、Al3+、 、
、 、
、 、Cl-中的几种离子,为了确定其成分,设计了如下实验;
、Cl-中的几种离子,为了确定其成分,设计了如下实验;
①取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
②在①反应后的溶液中滴加硝酸银溶液,产生白色沉淀。
下列推断正确的是
 、
、 、
、 、Cl-中的几种离子,为了确定其成分,设计了如下实验;
、Cl-中的几种离子,为了确定其成分,设计了如下实验;①取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
②在①反应后的溶液中滴加硝酸银溶液,产生白色沉淀。
下列推断正确的是
| A.溶液中一定含 Na+、Cl- | B.溶液中一定含 、可能含 Cl- 、可能含 Cl- |
C.溶液中可能含 、Fe3+ 、Fe3+ | D.溶液中一定不含 、Al3+、Fe3+ 、Al3+、Fe3+ |
您最近一年使用:0次
5 . 下列说法错误的是
| A.进行酸碱中和滴定实验时,眼睛须注视着锥形瓶内的颜色变化 |
B.除去 溶液中少量 溶液中少量 杂质,加入稍过量的 杂质,加入稍过量的 固体后过滤 固体后过滤 |
C.配制 溶液时,将 溶液时,将 固体溶于稀硫酸中,然后稀释至所需浓度 固体溶于稀硫酸中,然后稀释至所需浓度 |
D.将 溶液和 溶液和 溶液分别加热蒸干、灼烧后,所得固体为 溶液分别加热蒸干、灼烧后,所得固体为 和 和 |
您最近一年使用:0次
名校
解题方法
6 . 甲醇是重要的化工原料,在有机合成中具有广泛应用。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
则该反应的△H=______ kJ·mol-1
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)⇌CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:
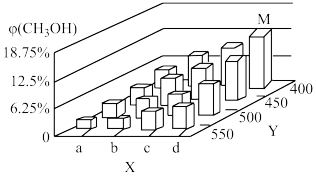
①图中a___ b(填“大于”或“小于”)。图中Y轴表示温度,其理由是_________ ;
②若反应II的平衡常数K值变小,则下列说法中正确的是___________ (填序号)。
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为_____ ;用H2表示I的反应速率为_____ mol·L-1·min-1。
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c( )∶c(
)∶c( )=
)=___________ [已知H2CO3的电离平衡常数为:K1=4.4×10−7、K2=5×10−11],溶液中c(Na+)_______ c( )+2c(
)+2c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
(1)用甲醇制取甲胺的反应为:CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g)△H
已知该反应中相关化学键的键能数据如下:
| 共价键 | C―O | H―O | N―H | C―N |
| 键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=
(2)一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应:
主反应:CO(g)+2H2(g)⇌CH3OH(g)△H<0 Ⅰ
副反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)随温度、压强的变化如图所示:

①图中a
②若反应II的平衡常数K值变小,则下列说法中正确的是
A.平衡均向正反应方向移动 B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小 D.容器中φ(CH3OCH3)增大
③平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为
(3)用NaOH溶液做CO2碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=11的溶液,则溶液中c(
 )∶c(
)∶c( )=
)= )+2c(
)+2c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
您最近一年使用:0次
11-12高二下·浙江温州·期末
名校
解题方法
7 . 为了除去氯化镁酸性溶液中的铁离子,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
| A.一水合氨 | B.烧碱 | C.碳酸镁 | D.碳酸钠 |
您最近一年使用:0次
2020-07-03更新
|
255次组卷
|
13卷引用:2011-2012学年浙江省温州市十校联合体高二下学期期末考试化学试卷
(已下线)2011-2012学年浙江省温州市十校联合体高二下学期期末考试化学试卷(已下线)2012-2013学年江苏省宿迁市泗洪县洪翔中学高二下学期期中考化学卷(已下线)2012-2013学年四川省雅安市高二下学期期末检测化学试卷(已下线)2014届福建省福州市高三上学期期末质量检测化学试卷2015届福建省三明市一中高三上学期第二次月考化学试卷黑龙江省大庆第一中学2017-2018学年高二上学期期末(第四次月考)考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期10月考试化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(能力卷)试题2020届高三化学二轮冲刺新题专练——过滤(抽滤)、蒸发、结晶等除杂分离法北京市中国人民大学附属中学 2019-2020 学年度高二下学期期末练习化学试题(已下线)3.3.2 影响盐类水解的因素(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)山西省稷山中学2021-2022学年高二上学期第二次月考化学试题云南省昆明师范专科学校附属中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
8 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,一些水管的活塞会“自动”熔化,喷出水来。由一种铋矿(主要成分为Bi2S3,含强氧化性杂质PbO2等)制备金属铋的简单工艺如图:

已知:酸性溶液中,氧化性PbO2>KMnO4
回答下列问题:
(1)“浸出”时发生的离子反应包括___ 、___ 。
(2)浸出液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是___ 。
(3)检验母液中主要金属阳离子的方法是___ 。
(4)乙二胺四乙酸二钠盐(EDTA)可以和Bi3+1:1形成稳定的配合物,一种测定浸出液中Bi3+浓度的方法如下:取25mL浸出液,调节pH=l,滴入2滴二甲酚橙作指示剂(二甲酚橙:溶于水呈亮黄色,能和多种金属阳离子形成紫红色配合物),用0.01000mol/L的EDTA溶液滴定,达到滴定终点时,测得耗去标准液35.00mL,则浸出液中Bi3+的浓度为___ g/L,达到滴定终点的现象是__ 。
(5)以Bi2(SiF6)3的水溶液为电解液,可以实现粗铋的电解精炼。电解过程中,当电路中通过0.3mol电子时,阴极析出的金属Bi的质量为__ ;电解一段时间后,电解液会有损失,并会出现大量杂质,加入___ (填化学式)可以除去该杂质,并使电解液H2SiF6再生。

已知:酸性溶液中,氧化性PbO2>KMnO4
回答下列问题:
(1)“浸出”时发生的离子反应包括
(2)浸出液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是
(3)检验母液中主要金属阳离子的方法是
(4)乙二胺四乙酸二钠盐(EDTA)可以和Bi3+1:1形成稳定的配合物,一种测定浸出液中Bi3+浓度的方法如下:取25mL浸出液,调节pH=l,滴入2滴二甲酚橙作指示剂(二甲酚橙:溶于水呈亮黄色,能和多种金属阳离子形成紫红色配合物),用0.01000mol/L的EDTA溶液滴定,达到滴定终点时,测得耗去标准液35.00mL,则浸出液中Bi3+的浓度为
(5)以Bi2(SiF6)3的水溶液为电解液,可以实现粗铋的电解精炼。电解过程中,当电路中通过0.3mol电子时,阴极析出的金属Bi的质量为
您最近一年使用:0次
9 . NA为阿伏加 德罗常数的值,下列说法不正确 的是( )
| A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA |
| B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA |
| C.含7.8gNa2S的溶液中阴离子总数大于0.1NA |
| D.向100mL1mol•L-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA |
您最近一年使用:0次
2020-06-09更新
|
819次组卷
|
5卷引用:浙江省温州市2020年4月份普通高中选考适应性测试(二模)化学试题
浙江省温州市2020年4月份普通高中选考适应性测试(二模)化学试题模拟卷05(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)新疆维吾尔自治区和田地区洛浦县2022-2023学年高三上学期11月期中考试化学试题
名校
10 . 某温度下,HF和CH3COOH的电离常数分别为3.5×10-4和1.7×10-5。将pH和体积均相同的NaF和CH3COONa溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
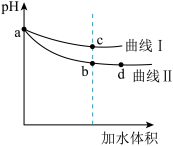

| A.曲线I代表CH3COONa溶液 |
| B.溶液中水的电离程度:c点>b点 |
C.从b点到d点,溶液中 保持不变(其中HA、 保持不变(其中HA、 分别代表相应的酸和酸根离子) 分别代表相应的酸和酸根离子) |
D.相同体积a点的两溶液分别与HCl恰好反应后,溶液中 相同 相同 |
您最近一年使用:0次
2020-05-27更新
|
392次组卷
|
2卷引用:浙江省宁波市2020届高三适应性考试(二模)化学试题



