名校
1 . 下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,回答下列问题。
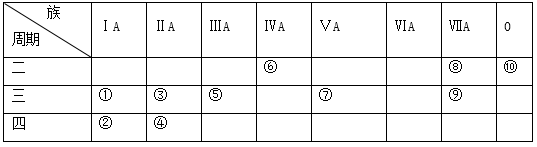
(1)这10种元素中,化学性质最不活泼的元素是____ (写序号),得电子能力最强的原子是____ (用元素符号表示);元素⑦的最高价氧化物对应的水化物是______ (写化学式)。
(2)元素④的离子结构示意图为____________________________ 。
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用离子符号表示)_____________ 。
(4)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式:___________________________ 。
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式:__________________ 。
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式:___________________ 。

(1)这10种元素中,化学性质最不活泼的元素是
(2)元素④的离子结构示意图为
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用离子符号表示)
(4)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式:
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式:
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式:
您最近一年使用:0次
2018-03-12更新
|
166次组卷
|
4卷引用:黑龙江省牡丹江市第一高级中学2017-2018学年高一4月月考化学试题
黑龙江省牡丹江市第一高级中学2017-2018学年高一4月月考化学试题《课时同步君》2017-2018学年高一化学人教必修2-1.2.2 元素周期表和元素周期律的应用(已下线)精做02 元素周期律——《大题精做》2017-2018学年高一化学人教必修2河南省南召现代中学2021-2022学年高一下学期开学检测化学试题
名校
2 . 下表为元素周期表的一部分。
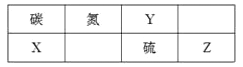
回答下列问题:
(1)Z元素在周期表中的位置为________ 。
(2)表中元素原子半径最大的是(写元素符号)________ 。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是________ 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为________________ ,
Q与水反应的化学方程式为_______________________________________ 。

回答下列问题:
(1)Z元素在周期表中的位置为
(2)表中元素原子半径最大的是(写元素符号)
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为
Q与水反应的化学方程式为
您最近一年使用:0次
13-14高三·四川成都·阶段练习
名校
3 . 二氧化氯是黄绿色的气体,可用于水体消毒与废水处理.一种制备方法为:
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是______ .
(2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)_____ g.
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是______ ,其中原子半径最大的元素最外层电子云形状为______ .
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与_______ 相同.(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:__________ .
(6)上述反应产物NaCl中含有______ 键,工业上用电解熔融的氯化钠制备金属钠,氯气在_____ (写电极名称)产生.
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是
(2)该反应每产生0.2mol ClO2,需要消耗草酸晶体(H2C2O4•2H2O)
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:
(6)上述反应产物NaCl中含有
您最近一年使用:0次
2017-09-07更新
|
228次组卷
|
3卷引用:黑龙江省齐齐哈尔市第八中学2018届高三上学期第一阶段测试化学试题
名校
4 . 下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分)

(1)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________ ;
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是________ (填化学式):能通过________ (写反应的化学方程式)说明。
(3)实验室制取②的氢化物的化学方程式________
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________ (用化学方程式表示)
(5)比较③与⑥的氢化物,更稳定________ (填化学式)
(6)③④两元素组成的化合物A2B2型电子式为:________ ;存在的化学键是________ ;写出A2B2与水反应的化学方程式______________ 。
(7)⑨的单质与水反应所得离子化合物中阳离子半径_______ S2-(填“>”或“<”)

(1)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是
(3)实验室制取②的氢化物的化学方程式
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因
(5)比较③与⑥的氢化物,更稳定
(6)③④两元素组成的化合物A2B2型电子式为:
(7)⑨的单质与水反应所得离子化合物中阳离子半径
您最近一年使用:0次
名校
解题方法
5 . (全部填元素符号或化学式)11—18号元素中,化学性质最稳定的元素是____ ;最高价氧化物对应水化酸性最强的元素是_______ ;最高价氧化物对应水化物为两性氢氧化物,其化学式为__________ ;与酸或水反应置换氢能力最强的元素是____ ,其最高价氧化物对应水化物的化学式为_______ 。
您最近一年使用:0次
2017-07-23更新
|
53次组卷
|
2卷引用:黑龙江省伊春市第二中学2016-2017学年高一下学期期末考试(文)化学试题
名校
6 . 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
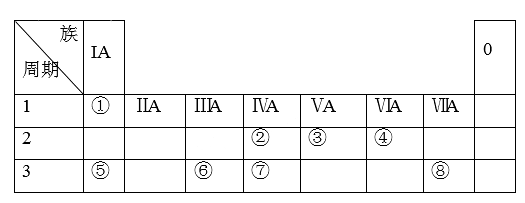
(1)①的元素符号为______ ;②的元素符号为______ ;③的元素符号为______ ;④的元素符号为______ ;⑤的元素符号为______ ;⑥的元素符号为______ ;⑦的元素符号为______ ;⑧的元素符号为_______
(2)⑥的原子结构示意图为_________ 。
(3)⑧的气态氢化物为_____________ (填化学式)。
(4)⑤对应的碱的化学式为__________ ;③的最高价含氧酸为___________ 。(填化学式)
(5)⑤、⑥元素的金属性强弱依次为___________ 。(填“增大”、“减小”或“不变”)

(1)①的元素符号为
(2)⑥的原子结构示意图为
(3)⑧的气态氢化物为
(4)⑤对应的碱的化学式为
(5)⑤、⑥元素的金属性强弱依次为
您最近一年使用:0次
名校
7 . 硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为____________ ,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_____________ 。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式__________________________ 。
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数数K=____________ 。
氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4-的电子式____________ 。
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构____________ (填“相同”或“不相同”)。
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式_____________ 。
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为____________ L。
(1)硼在元素周期表中的位置为
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数数K=
氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4-的电子式
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为
您最近一年使用:0次
2017-05-07更新
|
803次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试化学试题
8 . 下表是元素周期表的一部分,用相关化学用语回答下列问题:
(1)写出H、I两种元素的名称_____________ 、_____________ 。
(2)这些元素的气态氢化物中最稳定的是________________ ,元素A的最高价氧化物的分子式为____________ ,属于______________ 化合物(填离子或共价);
其电子式为_______________ ;其结构式为_______________ 。
(3)从E到K的元素中,______ 原子半径最小。元素E和J形成的化合物属于_______ 化合物(填离子或共价)
(4)试用实验证明E和F的金属性的强弱(简述实验内容和结论)_____________________________________________________________________________________________ 。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | A | B | C | D | ||||
| 3 | E | F | G | H | I | J | K | L |
(1)写出H、I两种元素的名称
(2)这些元素的气态氢化物中最稳定的是
其电子式为
(3)从E到K的元素中,
(4)试用实验证明E和F的金属性的强弱(简述实验内容和结论)
您最近一年使用:0次
解题方法
9 . 钠、铝、碳、硅是四种常见的化学元素。请回答下列问题:
(1)五种元素中,原子半径最大的是____________________ (填元素符号),单质广泛用作半导体材料的是____________________ (填化学式)。
(2)铝在周期表中位于第____________________ 周期第____________________ 族,氧化铝在另三种元素之一的最高价氧化物对应的水化物溶液中可溶解,写出反应的离子方程式:____________________ 。
(3)工业上由下列物质冶炼相应金属时与冶炼铝采用相同方法的是____________________ (填选项代号)。
(4)生产上常利用金属铝与Fe2O3在高温下的反应来进行焊接钢轨,请写出该反应的化学方程式:____________________ 。
(1)五种元素中,原子半径最大的是
(2)铝在周期表中位于第
(3)工业上由下列物质冶炼相应金属时与冶炼铝采用相同方法的是
| A.Fe2O3 | B.MgCl2 | C.NaCl | D.HgO |
(4)生产上常利用金属铝与Fe2O3在高温下的反应来进行焊接钢轨,请写出该反应的化学方程式:
您最近一年使用:0次
10 . 下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
(1)在这些元素中,化学性质最不活泼的是:________ (填具体元素符号,下同),原子结构示意图为________ 。元素⑩名称为________ 在周期表中的位置________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________ ,碱性最强的化合物的电子式是:________ 。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________ ,该化合物属于________ (填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________ ,该化合物是由________ (填”极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________ 。
(6)元素③的氢化物的结构式为________ ;该氢化物常温下和元素⑦的单质反应的化学方程式为_________________________________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是
(6)元素③的氢化物的结构式为
您最近一年使用:0次
2016-12-09更新
|
644次组卷
|
6卷引用:2014-2015黑龙江省鹤岗市第一中学高一下学期期中化学试卷

 主族
主族

