名校
解题方法
1 . 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______ 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______ 。
(3)与CN-互为等电子体的一种分子为______ (填化学式);1mol Fe(CN)63-中含有σ键的数目为______ 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______ (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______ 。

(1)Fe2+基态核外电子排布式为
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为
(3)与CN-互为等电子体的一种分子为
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为

您最近一年使用:0次
2018-10-10更新
|
257次组卷
|
5卷引用:2015届山东省济宁市高三第二次模拟考试理综化学试卷
解题方法
2 . 甲烷在镍催化作用下可与水反应制合成气(CO和H2),再制成甲醇代替燃油。
(1)CH4和H2O所含的三种元素电负性从小到大的顺序为________ 。
(2)CH4和CO2分子中碳原子的杂化类型分别是_____ 和_______ 。
(3)基态Ni原子的电子排布式为______ ,该元素位于元素周期表的第_____ 族。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。则1mol Ni(CO)4 中含有____ mol σ键,Ni(CO)4的晶体类型为_____ ,Ni(CO)4易溶于下列___ (填选项字母) 中。
a.水 b.四氧化碳 C.苯 d.硫酸镍溶液
(5)如图是一种镍镧合金储氢后的晶胞结构示意图。该合金中原子个数比La:Ni=_____ ,储氢后,含1molLa的合金可吸附H2的数目为______ 。

(1)CH4和H2O所含的三种元素电负性从小到大的顺序为
(2)CH4和CO2分子中碳原子的杂化类型分别是
(3)基态Ni原子的电子排布式为
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。则1mol Ni(CO)4 中含有
a.水 b.四氧化碳 C.苯 d.硫酸镍溶液
(5)如图是一种镍镧合金储氢后的晶胞结构示意图。该合金中原子个数比La:Ni=

您最近一年使用:0次
3 . Cu、Fe、Se、Co、S、P等元素常用于化工材料的合成。请回答下列问题:
(1)Fe3+最外层电子排布式为___________ ,其核外共有_____ 种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是_______________________________________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为_________________ (用元素符号表示),SeO2分子的空间构型为___________________ 。
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为__________ ,每个P4S3分子中含孤电子对的数目为_______________ 。

(4)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为a cm,则该氧化物的密度为________ g·cm-3。(设阿伏伽德罗常数的值为NA)。

(1)Fe3+最外层电子排布式为
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为

(4)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为a cm,则该氧化物的密度为

您最近一年使用:0次
2018-05-05更新
|
242次组卷
|
2卷引用:【全国市级联考】山东省潍坊市2018届高三第二次高考模拟考试理科综合化学试题1
名校
解题方法
4 . 科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_______ 形象化描述。在基态14C原子中,核外存在_______ 对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为_______ 。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。

①下列关于CH4和CO2的说法正确的是_______ (填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表所提供的数据分析,提出该设想的依据是_______ 。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
| 参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |

①下列关于CH4和CO2的说法正确的是
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表所提供的数据分析,提出该设想的依据是
您最近一年使用:0次
2018-04-28更新
|
197次组卷
|
3卷引用:山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题
名校
5 . 下列有关说法正确的是
| A.最外层都只有2个电子的X、Y原子,化学性质一定相似 |
| B.在所有的元素中,氟的电负性最大 |
| C.前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有4种 |
D.次氯酸分子的电子式: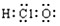 |
您最近一年使用:0次
2018-04-28更新
|
666次组卷
|
3卷引用:山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题
6 . 电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:答下列有关问题:
(1)预测周期表中电负性最大的元素应为____________ ;估计钙元素的电负性的取值范围:___________ < X <___________ 。
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是___________ ;简述元素电负性X的大小与元素金属性、非金属性之间的关系________________ 。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为________ ,其理由是____________________________________ 。
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)预测周期表中电负性最大的元素应为
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
您最近一年使用:0次
2018-04-23更新
|
223次组卷
|
2卷引用:山东省单县五中2017-2018学年高二下学期第一次月考化学试题
名校
解题方法
7 . 金属钛(22Ti)、铁(26Fe)及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_____________ ,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有_________ 种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_____________ 。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C N)和异硫氰酸(H-N=C=S)。
N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒______________ (分子或离子);
②硫氰酸分子中π键和σ键的个数之比为______________ ;
③异硫氰酸的沸点比硫氰酸沸点高的原因是__________________________________ 。
(4)TiCl3可用作烯烃定向聚合的催化剂,如:nCH3CH=CH2 。该反应涉及的物质中碳原子的杂化轨道类型有
。该反应涉及的物质中碳原子的杂化轨道类型有_______________________ ;反应涉及的元素中电负性最大的是_____________________________ 。
(5)Ti 的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+ 位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围________ 个O2-紧邻;若该晶胞的密度为dg/cm3 则钛氧键的键长为________ cm(用含NA 的代数式表示)。
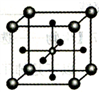
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C
 N)和异硫氰酸(H-N=C=S)。
N)和异硫氰酸(H-N=C=S)。①写出与SCN-互为等电子体的一种微粒
②硫氰酸分子中π键和σ键的个数之比为
③异硫氰酸的沸点比硫氰酸沸点高的原因是
(4)TiCl3可用作烯烃定向聚合的催化剂,如:nCH3CH=CH2
 。该反应涉及的物质中碳原子的杂化轨道类型有
。该反应涉及的物质中碳原子的杂化轨道类型有(5)Ti 的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+ 位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围

您最近一年使用:0次
解题方法
8 . 前36号元素A、B、C、D、E原子序数依次增大,A与B是同一周期紧邻元素,B与D同一主族,B元素氢化物的水溶液可用于玻璃的雕刻。C元素是同周期元素中第一电离能最小的元素,C与E的最外层电子数相同,E元素内层均排满电子。
(1)基态原子E的电子排布式为___________ ;依据电子排布周期表划分为5个区,该元素位于周期表的_________ 区。
(2)元素A、B、D电负性由大到小的顺序为___________ 。
(3)D2A分子中,中心原子的杂化方式为___________ 。分子键角大小关系,AB2分子_____ D2A分子(填“大于”,“小于”或“等于”),原因_________________________ 。
(4)单质C经常用于储氢,储氢后形成晶体结构如图所示:

该晶体中与C离子近邻的氢离子有_______ 个。这些氢离子,构成的空间构型为_______ 。已知C离子与氢离子之间最近的核间距为a pm,则该晶体的密度为_____ g·cm-3。
(1)基态原子E的电子排布式为
(2)元素A、B、D电负性由大到小的顺序为
(3)D2A分子中,中心原子的杂化方式为
(4)单质C经常用于储氢,储氢后形成晶体结构如图所示:

该晶体中与C离子近邻的氢离子有
您最近一年使用:0次
解题方法
9 . I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
(1)硒、铬、锰元素中,________ (填元素符号)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有________ 种。
(3)已知N N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的________
键稳定(填“σ”或“π”)。
Ⅱ.胆矾CuSO4•5H2O可写成[Cu(H2O)4]SO4 •H2O,其结构示意图如下:
(4)下列说法正确的是_______ (填字母)。
A.胆矾所含元素中,H、O、S的半径及电负性依次增大
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.加热条件下胆矾中的水会在相同温度下一同失去
(5)往硫酸铜溶液中加入过量氨水,溶液变为深蓝色,写出所发生反应的离子方程式__________________________ ;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________________________ 。

(1)硒、铬、锰元素中,
(2)天冬酰胺中碳原子的杂化轨道类型有
(3)已知N
 N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的键稳定(填“σ”或“π”)。
Ⅱ.胆矾CuSO4•5H2O可写成[Cu(H2O)4]SO4 •H2O,其结构示意图如下:

(4)下列说法正确的是
A.胆矾所含元素中,H、O、S的半径及电负性依次增大
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.加热条件下胆矾中的水会在相同温度下一同失去
(5)往硫酸铜溶液中加入过量氨水,溶液变为深蓝色,写出所发生反应的离子方程式
您最近一年使用:0次
解题方法
10 . 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为_______ 。
(2)纳米TiO2常用作下述反应的催化剂。
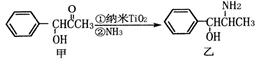
化合物甲的分子中采取sp2方式杂化的碳原子有_______ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为_______ 。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是_______ ,1 mol该配合物中含有的 键数目是
键数目是_______ 。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_______ 。
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_______ 个:Ti原子的配位数为_______ ;此配位原子构成的空间构型为_______ ;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为_______ g·cm-3、NA为阿伏伽德罗常数的值,只列计算式)。
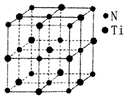
请回答下列问题:
(1)Ti的基态原子价电子排布式为
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是
 键数目是
键数目是(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有

您最近一年使用:0次
2017-04-13更新
|
293次组卷
|
2卷引用:山东省潍坊市昌乐县第二中学2018届高三下学期一模拉练理综化学试题



