名校
1 . TiCl4是制备金属钛的重要中间体。某小组同学利用如图装置在实验室制备(夹持装置略去)。
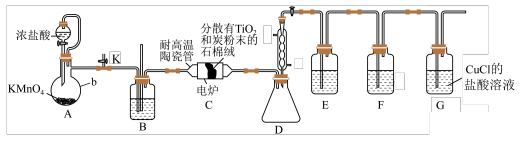
已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如表所示:
回答下列问题:
(1)装置B中的试剂是___________ (填试剂名称)。
(2)装置D的作用是___________ ,装置C中除生成 外,还生成CO,该反应的化学方程式为
外,还生成CO,该反应的化学方程式为___________ 。
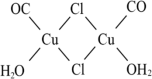
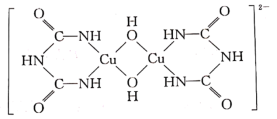
(3)利用G装置可以将CO吸收得到氯化羰基亚铜[Cu2Cl2(CO)2•2H2O],其结构如图所示。试从结构角度分析,CuCl的盐酸溶液可以吸收CO的原因是___________ 。
(4)可以选用下面的一套装置___________(填标号)替换掉装置E和F。
(5)利用如图装置测定所得TiCl4的纯度:取2.0g产品加入烧瓶中,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol•L-1K2CrO4溶液作指示剂,用1.00mol•L-1AgNO3标准溶液滴定至终点,消耗标准溶液40.00mL。已知:常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色,TiCl4+(2+n)H2O=TiO2•nH2O↓+4HCl。
①安全漏斗中的水在本实验中的作用除与TiCl4反应外,还有________ 。
②滴定终点的判断方法是_________ 。
③已知TiCl4的摩尔质量是190g/mol,则产品的纯度为______ (保留两位有效数字)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g•cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
(1)装置B中的试剂是
(2)装置D的作用是
 外,还生成CO,该反应的化学方程式为
外,还生成CO,该反应的化学方程式为(3)利用G装置可以将CO吸收得到氯化羰基亚铜[Cu2Cl2(CO)2•2H2O],其结构如图所示。试从结构角度分析,CuCl的盐酸溶液可以吸收CO的原因是

(4)可以选用下面的一套装置___________(填标号)替换掉装置E和F。
A. | B. | C.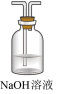 | D. |

①安全漏斗中的水在本实验中的作用除与TiCl4反应外,还有
②滴定终点的判断方法是
③已知TiCl4的摩尔质量是190g/mol,则产品的纯度为
您最近一年使用:0次
名校
2 . 七叶亭是一种植物抗菌素,适用于细菌性痢疾,其结构如图,下列说法,正确的是
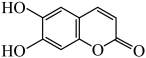

A.分子中存在 种官能团,无手性碳原子 种官能团,无手性碳原子 |
| B.分子中所有碳原子共平面,且碳原子的杂化方式只有一种 |
C. 该物质与足量溴水反应,最多可消耗 该物质与足量溴水反应,最多可消耗 Br2 Br2 |
D. 该物质与足量 该物质与足量 溶液反应,最多可消耗 溶液反应,最多可消耗 |
您最近一年使用:0次
3 . [Co(NH3)6]Cl2晶体的晶胞如下图所示(已知该立方晶胞的边长为a pm,阿伏加德罗常数为NA,[Co(NH3)6]Cl2的摩尔质量为M g/mol),以下说法正确的是
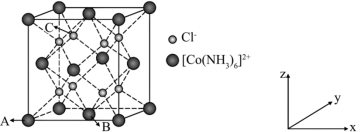

| A.[Co(NH3)6]Cl2中,中心离子的配位数为8 |
| B.离[Co(NH3)6]2+最近的Cl- 有4个 |
C.若规定A点原子坐标为(0,0,0),则C点原子坐标为(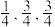 ) ) |
D.[Co(NH3)6]Cl2晶体的密度为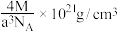 |
您最近一年使用:0次
名校
解题方法
4 . 我国的航空航天事业取得了举世瞩目的成就,近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。硼氢类离子液体的合成如图所示:
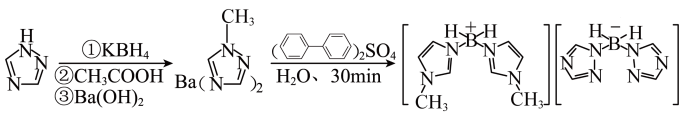
回答下列问题:
(1)基态K原子核外电子的空间运动状态有___________ 种。
(2)C、O、N的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3) 中,
中, 的空间构型为
的空间构型为___________ 。
(4)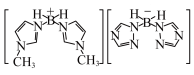 中
中不存在 的作用力有___________ (填字母)。
a.离子键 b.配位键 c. 键 d.
键 d. 键 e.金属键 f.氢键
键 e.金属键 f.氢键
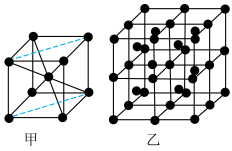
(5)Ba的一种晶体如甲、乙所示,若按甲虚线方向切乙,所得剖面图正确的是___________(填字母标号)。
(6)硼化钙晶胞结构如图所示,B原子构成B6八面体,各个顶点通过B-B键互相连接成三维骨架,八个B6多面体围成立方体,中心为Ca2+,晶胞密度为ρg·cm-3。
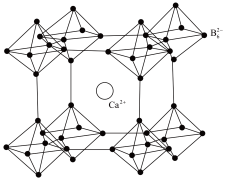
①硼化钙的化学式为___________ 。
②晶胞边长为___________ nm(已知NA为阿伏加德罗常数)。

回答下列问题:
(1)基态K原子核外电子的空间运动状态有
(2)C、O、N的第一电离能由大到小的顺序为
(3)
 中,
中, 的空间构型为
的空间构型为(4)
 中
中a.离子键 b.配位键 c.
 键 d.
键 d. 键 e.金属键 f.氢键
键 e.金属键 f.氢键(5)Ba的一种晶体如甲、乙所示,若按甲虚线方向切乙,所得剖面图正确的是___________(填字母标号)。

A.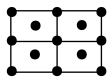 | B.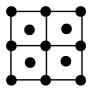 | C.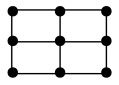 | D. |
(6)硼化钙晶胞结构如图所示,B原子构成B6八面体,各个顶点通过B-B键互相连接成三维骨架,八个B6多面体围成立方体,中心为Ca2+,晶胞密度为ρg·cm-3。

①硼化钙的化学式为
②晶胞边长为
您最近一年使用:0次
名校
解题方法
5 . 布洛芬为解热镇痛类化学药物,直接服用会对胃肠造成强烈刺激,故化学家进行如图所示的分子修饰,以缓刺激。下列说法正确的是
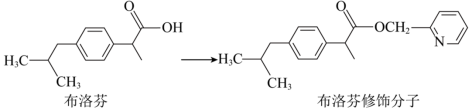

| A.组成布洛芬的元素均位于元素周期表p区 |
| B.布洛芬的晶体类型为分子晶体,存在分子内氢键 |
| C.布洛芬修饰分子中所有的碳原子可能共平面 |
| D.在胃肠内布洛芬修饰分子会转化为布洛芬分子 |
您最近一年使用:0次
名校
解题方法
6 . 工业合成尿素的原理: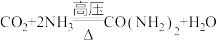 。有关化学用语表示正确的是
。有关化学用语表示正确的是
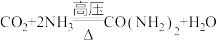 。有关化学用语表示正确的是
。有关化学用语表示正确的是| A.中子数为8的碳原子:8C |
B.NH3的VSEPR模型: |
C.CO(NH2)2的结构简式: |
D.基态氧原子的核外电子轨道表示式: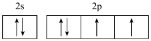 |
您最近一年使用:0次
名校
7 . 八氢香豆素(H)是合成香料的原料,以A为原料制备H的合成路线如下图所示,请回答下列问题:

已知:①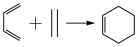 ;
;
②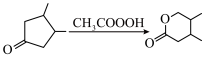
(1)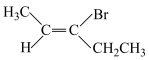 的名称为“反-3-溴-2-戊烯”,按此命名原则,A的名称为
的名称为“反-3-溴-2-戊烯”,按此命名原则,A的名称为___________ 。
(2)B中碳原子的杂化方式为___________ 。
(3)D的结构简式为___________ 。
(4)指出反应类型:E→F___________ 、G→H___________ 。
(5)写出F转化为G的化学方程式:___________ 。
(6)有机物X是H的同分异构体,X具有如下结构和性质:
①含有 结构,环上所有碳原子均为饱和碳原子,且环上只有一个取代基。
结构,环上所有碳原子均为饱和碳原子,且环上只有一个取代基。
②能使溴的四氯化碳溶液褪色。
③能发生银镜反应。
④能水解。
若不考虑立体异构,则X的可能结构有___________ 种。
(7)写出以 和CH≡C-COOCH3为原料,合成
和CH≡C-COOCH3为原料,合成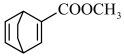 的路线流程图:
的路线流程图:___________ (无机试剂和有机溶剂任用)。

已知:①
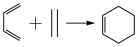 ;
; ②
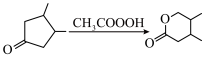
(1)
 的名称为“反-3-溴-2-戊烯”,按此命名原则,A的名称为
的名称为“反-3-溴-2-戊烯”,按此命名原则,A的名称为(2)B中碳原子的杂化方式为
(3)D的结构简式为
(4)指出反应类型:E→F
(5)写出F转化为G的化学方程式:
(6)有机物X是H的同分异构体,X具有如下结构和性质:
①含有
 结构,环上所有碳原子均为饱和碳原子,且环上只有一个取代基。
结构,环上所有碳原子均为饱和碳原子,且环上只有一个取代基。②能使溴的四氯化碳溶液褪色。
③能发生银镜反应。
④能水解。
若不考虑立体异构,则X的可能结构有
(7)写出以
 和CH≡C-COOCH3为原料,合成
和CH≡C-COOCH3为原料,合成 的路线流程图:
的路线流程图:
您最近一年使用:0次
名校
8 . 下列颜色绚丽的过程为化学变化,但不涉及氧化还原反应的是
| A.硫酸锶灼烧时火焰呈洋红色 |
| B.无水硫酸铜溶于浓氨水生成深蓝色溶液 |
| C.酸性重铬酸钾遇乙醇转化为绿色溶液 |
| D.《抱朴子》记载:“丹砂(HgS)烧之成水银,积变又还成丹砂” |
您最近一年使用:0次
2023-05-14更新
|
118次组卷
|
2卷引用:重庆市渝北中学2023-2024学年高三9月月考质量监测化学试题
名校
解题方法
9 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。
请根据以上情况,回答下列问题:
(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_______ 。
(2)B的氢化物分子的立体构型是_______ 。其中心原子采取_______ 杂化。
(3)E的核外电子排布式是_______ ,ECl3形成的配合物的化学式_______ 。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是_______ 。
(5)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是_______ ,SO 的空间构型为
的空间构型为_______ 。
(6)氨缩脲(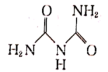 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为_______ ,σ 键与π键的数目之比为_______ 。氨缩脲与胆矾溶液反应得到如图所示的紫色物质,1 mol紫色物质中含配位键的数目为_______ 。
请根据以上情况,回答下列问题:
(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物分子的立体构型是
(3)E的核外电子排布式是
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(5)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是
 的空间构型为
的空间构型为(6)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为
您最近一年使用:0次
名校
解题方法
10 . Mn和Ni是构成合金钢金(即铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置_______ ,
(2)Ni的价电子排布式为_______ ,属于_______ 区的元素;
(3)过硫酸盐(S2O )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为_______ ;

(4)NiO、FeO属于_______ 晶体,已知r(Ni2+)>r(Fe2+),则熔点NiO_______ FeO(填“<"或“>’’),原因是_______ 。
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有_______ ,_______ ;
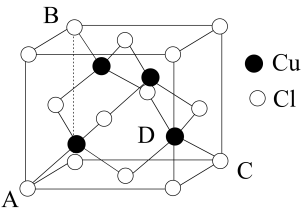
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)Mn在元素周期表中的位置
(2)Ni的价电子排布式为
(3)过硫酸盐(S2O
 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
(4)NiO、FeO属于
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为

您最近一年使用:0次
2022-04-02更新
|
222次组卷
|
2卷引用:重庆市南华中学校2021-2022学年高二3月月考化学试题



