名校
1 . 已知冰醋酸能与 在
在 催化下发生反应生成
催化下发生反应生成 和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
 在
在 催化下发生反应生成
催化下发生反应生成 和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是| A.实验中C―I键的产生,可通过红外光谱结果证明 |
B. 中存在 中存在 键 键 |
| C.C―I键比C―Cl键更易形成,且键能更大 |
D. 的酸性比 的酸性比 强 强 |
您最近一年使用:0次
2 . 现有五种元素A、B、C、D、E,其中A、B、C为三个不同周期的短周期元素,E为第四周期元素。请根据下列相关信息,回答下列问题:
(1)C基态原子中能量最高的电子,其电子云在空间有___________ 个方向,C简单离子核外有___________ 种运动状态不同的电子。
(2) 难溶于二硫化碳,简要说明理由
难溶于二硫化碳,简要说明理由___________ 。
(3) 分子的空间构型为
分子的空间构型为___________ , 分子的VSEPR模型名称为
分子的VSEPR模型名称为___________ 。
(4)下列气态分子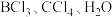 和
和 中,其键角由大到小的顺序为
中,其键角由大到小的顺序为___________ 。
| 元素 | 相关信息 |
| A | 核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 原子核外P电子数与s电子数相等 |
| C | 基态原子的价电子排布为 |
| D | 能层数与C相同,且电负性比C大 |
| E | 元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
(2)
 难溶于二硫化碳,简要说明理由
难溶于二硫化碳,简要说明理由(3)
 分子的空间构型为
分子的空间构型为 分子的VSEPR模型名称为
分子的VSEPR模型名称为(4)下列气态分子
 和
和 中,其键角由大到小的顺序为
中,其键角由大到小的顺序为
您最近一年使用:0次
名校
解题方法
3 . 表中关于各微粒的描述完全正确的一项是
| 选项 | A | B | C | D |
| 分子或离子的化学式 |  |  |  |  |
| 中心原子的杂化轨道类型 |  |  |  |  |
| VSEPR模型名称 | 直线形 | 平面正方形 | 平面三角形 | 正四面体形 |
| 分子或离子的空间结构 | 直线形 | 平面正方形 | V形 | 三角锥形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 短周期元素X、Y、Z、R的原子序数依次增大,离子化合物 可用于调味和食品保存,X、Y、Z三种元素组成的两种化合物A、B的性质如图,X的基态原子中s能级与P能级上的电子数相等,下列说法正确的是
可用于调味和食品保存,X、Y、Z三种元素组成的两种化合物A、B的性质如图,X的基态原子中s能级与P能级上的电子数相等,下列说法正确的是
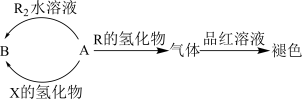
 可用于调味和食品保存,X、Y、Z三种元素组成的两种化合物A、B的性质如图,X的基态原子中s能级与P能级上的电子数相等,下列说法正确的是
可用于调味和食品保存,X、Y、Z三种元素组成的两种化合物A、B的性质如图,X的基态原子中s能级与P能级上的电子数相等,下列说法正确的是
A.简单离子半径: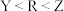 |
| B.与X同周期的非金属元素,最高正化合价从左到右依次升高 |
| C.X与Z形成的三原子分子为直线形分子 |
| D.X、Z、R的氢化物分子间均能形成氢键 |
您最近一年使用:0次
名校
解题方法
5 . 向盛有硫酸铜水溶液的试管里滴加氨水,首先形成蓝色难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法不正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后溶液中 的浓度不变 的浓度不变 |
B.在 离子中, 离子中, 提供空轨道, 提供空轨道, 给出孤对电子,配位数为4 给出孤对电子,配位数为4 |
C.沉淀溶解后生成深蓝色的配合离子 ,该配离子为平面正方形结构 ,该配离子为平面正方形结构 |
D.向反应后的溶液中加入乙醇,析出深蓝色晶体 |
您最近一年使用:0次
名校
解题方法
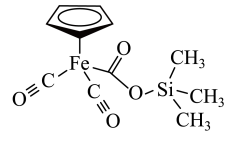
6 . 铁及其化合物在生产、生活中有重要应用。回答下列问题:
(1)基态Fe3+和Fe2+中成单电子个数之比为_______ 。
(2)某铁的配合物结构如图1所示,可由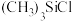 与
与 混合加热制得。
混合加热制得。
①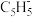 表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大
表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大 键可用符号
键可用符号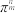 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为_______ 。
②该铁的配合物中碳原子的杂化方式共有_______ 种。
(3)普鲁士蓝晶体属立方晶系,晶胞棱长为a pm。铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点,CN-在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳K+,如图所示(CN-在图中省略)
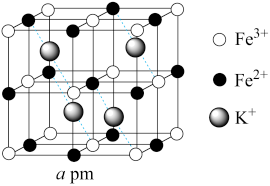
①普鲁士蓝中Fe2+与Fe3+个数之比为_______ ;该晶胞的化学式为_______ 。
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为_______ pm;该晶体的密度为_______ g·cm-3(阿伏加德罗常数为NA)
(1)基态Fe3+和Fe2+中成单电子个数之比为
(2)某铁的配合物结构如图1所示,可由
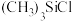 与
与 混合加热制得。
混合加热制得。
①
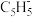 表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大
表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大 键可用符号
键可用符号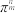 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则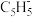 中的大
中的大 键应表示为
键应表示为②该铁的配合物中碳原子的杂化方式共有
(3)普鲁士蓝晶体属立方晶系,晶胞棱长为a pm。铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点,CN-在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳K+,如图所示(CN-在图中省略)

①普鲁士蓝中Fe2+与Fe3+个数之比为
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为
您最近一年使用:0次
2023-03-15更新
|
305次组卷
|
3卷引用:重庆市第十八中学2022-2023学年高二下学期4月期中化学试题
解题方法
7 . 有机化合物M的结构如图所示。关于M下列说法不正确的是
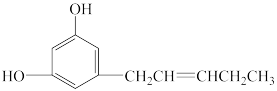

| A.M的分子式为C11H14O2 |
| B.M在苯环上发生取代反应,其一氯代物有2种 |
| C.最多可与4 mol H2发生加成反应 |
| D.分子中碳原子有sp、sp2、sp3三种杂化方式 |
您最近一年使用:0次
解题方法
8 . 铁(Fe)、钴(Co)、铬(Ni)是第四周期第VⅢ族的元素,在化学上称为铁系元素,其化合物在生产生活中应用广泛。
(1)基态Co原子的核外电子排布式为___________ 。
(2)铁系元素能与CO形成 、
、 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点103℃,则
为浅黄色液体,沸点103℃,则 中含有的化学键类型包括___________。
中含有的化学键类型包括___________。
(3)以甲醇为溶剂, 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。

①色胺酮分子中所含元素(C、N、O)第一电离能由小到大的顺序为___________ 。
②色氨酮分子中C原子的杂化类型为___________ 。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过___________ (填作用力)与色胺酮钴配合物相结合。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为___________ ,微粒之间存在的作用力是___________ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为 ;B为
;B为 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为___________ 。
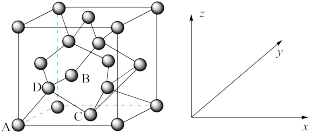
②晶胞参数,用于描述晶胞的大小和形状。已知Ge单晶的晶胞参数(棱长)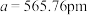 ,其密度为
,其密度为___________ g∙cm−3 (列出计算式即可,设NA为阿伏加德罗常数)。
(1)基态Co原子的核外电子排布式为
(2)铁系元素能与CO形成
 、
、 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点103℃,则
为浅黄色液体,沸点103℃,则 中含有的化学键类型包括___________。
中含有的化学键类型包括___________。| A.共价键 | B.离子键 | C.金属键 | D.配位键 |
 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。
①色胺酮分子中所含元素(C、N、O)第一电离能由小到大的顺序为
②色氨酮分子中C原子的杂化类型为
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为
 ;B为
;B为 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为
②晶胞参数,用于描述晶胞的大小和形状。已知Ge单晶的晶胞参数(棱长)
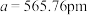 ,其密度为
,其密度为
您最近一年使用:0次
9 . R、T、W、X、Y、Z为前四周期元素,且W、X、Y、Z的核电荷数依次增大。表中列出它们的性质和结构:
(1)Y原子的核外电子排布式为___________ ,Z原子的价层电子轨道表示式为___________ 。
(2)Y与X以1:1形成的化合物中含有的化学键类型有___________ 。
(3)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有___________ 。
(4)与Z同周期某元素的三价阳离子比其二价阳离子更稳定,该元素位于周期表___________ 区。
(5)RW3分子的空间构型为___________ 。
(6)钛酸钡是一种典型钙钛矿型结构晶体,其晶胞如图,写出其化学式:___________ 。
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 单质及其化合物的焰色反应为黄色 |
| Z | 第四周期未成对电子数最多的元素 |
(2)Y与X以1:1形成的化合物中含有的化学键类型有
(3)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有
(4)与Z同周期某元素的三价阳离子比其二价阳离子更稳定,该元素位于周期表
(5)RW3分子的空间构型为
(6)钛酸钡是一种典型钙钛矿型结构晶体,其晶胞如图,写出其化学式:

您最近一年使用:0次
解题方法
10 . “类推”是一种重要的学习方法,但有时会产生错误,下列类推得到的结论正确的是
A.从CH4、NH 、SO 、SO 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、PO 、PO 也为正四面体结构 也为正四面体结构 |
| B.H2O常温下为液态,H2S常温下也为液态 |
| C.金刚石中C-C键的键长为154.45pm,C60中C-C键的键长为140~145pm,所以C60的熔点高于金刚石 |
| D.CH4和P4都为正四面体形,CH4中键角为109°28ˊ,P4中键角也为109°28ˊ |
您最近一年使用:0次



