解题方法
1 . 硫、铬、铁、铜等元素分别是人体必须的常量元素和微量元素,在生产中有着广泛应用。回答下列问题。
(1)硫元素在周期表中的位置为___________ 。
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如下图所示。
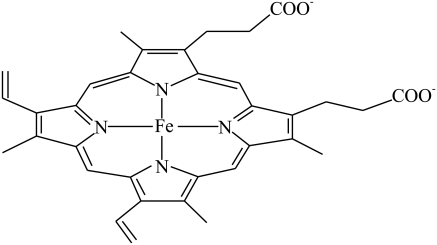
①血红蛋白中铁(II)的配位数为___________ ;
②基态Fe2+的核外价层电子排布式为___________ 。
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行________ 实验;加热该物质时,首先失去的是H2O分子,原因是________ 。
(5)金属晶体铜的晶胞如图所示。铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏加德罗常数。
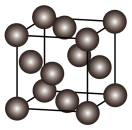
①Cu原子周围紧邻的Cu原子数目是___________ 。
②铜的相对原子质量为___________ (用a、ρ、NA表示,写出计算式即可)。
(1)硫元素在周期表中的位置为
(2)下列不同状态的Cr微粒中,电离最外层一个电子所需能量最大的是___________(填标号)。
| A.[Ar]3d54s1 | B.[Ar]3d44s14p1 | C.[Ar]3d5 | D.[Ar]3d54p1 |

①血红蛋白中铁(II)的配位数为
②基态Fe2+的核外价层电子排布式为
(4)Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定该物质是晶体还是非晶体,最科学的方法是对它进行
(5)金属晶体铜的晶胞如图所示。铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏加德罗常数。

①Cu原子周围紧邻的Cu原子数目是
②铜的相对原子质量为
您最近一年使用:0次
解题方法
2 . 碳是地球上组成生命的最基本元素之一、不仅能形成丰富多彩的有机化合物,还能形成多种无机化合物,碳及其化合物的用途广泛。根据要求回答下列问题:
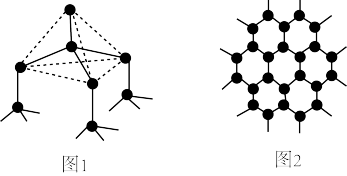
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为___________ ,图2晶体中,每个六元环占有___________ 个C原子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)丙炔( )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为___________ 。
(4)碳和氢形成的最简单碳正离子CH 的空间构型为
的空间构型为___________ 。
(5)双烯合成即狄尔斯-阿尔德反应(Diels—Alder反应),由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一、例如: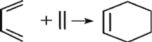 。现用2—甲基—1,3—丁二烯(
。现用2—甲基—1,3—丁二烯(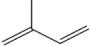 )通过狄尔斯-阿尔德反应合成A(
)通过狄尔斯-阿尔德反应合成A(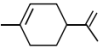 ),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式
),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式___________ 。
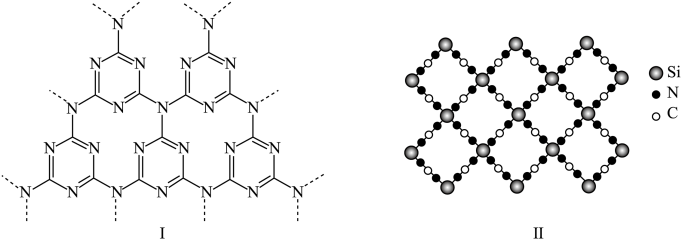
(6)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(I)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(II)所示,该化合物的化学式为___________ ,该化合物中所有元素的电负性由大到小的顺序为___________ 。
(1)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为

(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)丙炔(
 )分子中π键、σ键数目之比为
)分子中π键、σ键数目之比为(4)碳和氢形成的最简单碳正离子CH
 的空间构型为
的空间构型为(5)双烯合成即狄尔斯-阿尔德反应(Diels—Alder反应),由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一、例如:
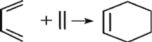 。现用2—甲基—1,3—丁二烯(
。现用2—甲基—1,3—丁二烯( )通过狄尔斯-阿尔德反应合成A(
)通过狄尔斯-阿尔德反应合成A( ),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式
),在合成A的过程中还可以生成A的多种同分异构体,写出其中一种同分异构体的结构简式(6)g-C3N4具有和石墨相似的层状结构,其中一种二维平面结构如下图(I)所示,用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物如下图(II)所示,该化合物的化学式为

您最近一年使用:0次
名校
解题方法
3 . 已知在有机化合物中,吸电子基团(吸引电子云密度靠近)能力:-Cl>-C≡CH>-C6H5>-CH=CH2>-H,推电子基团(排斥电子云密度偏离)能力:-C(CH3)3>-CH(CH3)2>-CH2CH3>-CH3>-H,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强。下列说法正确的是
| A.碳原子杂化轨道中s成分占比:CH2=CH2>CH≡CH |
| B.酸性:CH3COOH>ClCH2COOH |
C.羟基的活性: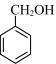 >CH3CH2OH >CH3CH2OH |
D.碱性: > > |
您最近一年使用:0次
2023-06-30更新
|
119次组卷
|
2卷引用:重庆市江津中学等七校2022-2023学年高二下学期期末联考化学试题
4 . 某金属有机多孔材料(MOFA)对CO2具有超高吸附能力,并能催化CO2与环氧丙烷反应,其工作原理如图所示。下列说法错误的是
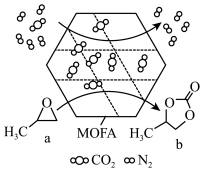

| A.b分子中碳原子采用sp2和sp3杂化 |
| B.b的一氯代物有3种 |
| C.1molb最多可与2molNaOH反应 |
| D.a转化为b发生取代反应,并有极性共价键的形成 |
您最近一年使用:0次
5 . 被誉为第三代半导体材料的氮化镓(GaN)硬度大、熔点高,在光电子、高温大功率器件和高频微波器件应用前景广阔。一定条件下由反应:2Ga+2NH3=2GaN+3H2制得GaN,下列叙述不正确的是
| A.GaN为共价晶体 |
| B.NH3分子的VSEPR模型是三角锥形 |
| C.基态Ga原子的价层电子排布式为4s24p1 |
| D.已知GaN和AlN的晶体类型相同,则熔点:GaN<AlN |
您最近一年使用:0次
名校
6 . 废旧银锌纽扣电池(含 、
、 石墨及少量
石墨及少量 、
、 等)的正极片中回收银的工艺流程如图:
等)的正极片中回收银的工艺流程如图:
 、
、 石墨及少量
石墨及少量 、
、 等)的正极片中回收银的工艺流程如图:
等)的正极片中回收银的工艺流程如图: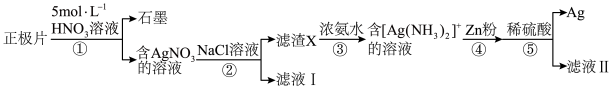
A.①中产生的气体为 |
B.②中适当增加 溶液的浓度有利于提高 溶液的浓度有利于提高 的回收率 的回收率 |
C.⑤中加稀硫酸的目的是反应 |
| D.废旧银锌纽扣电池应采用深埋的方式集中处理 |
您最近一年使用:0次
2023-01-13更新
|
159次组卷
|
3卷引用:重庆市七校(江津中学、大足中学、长寿中学、铜梁中学、合川中学、綦江中学、实验中学)2022-2023学年高二上学期期末学情调研化学试题
7 . 下列说法中正确的是
| A.NO2、SO2、BF3、NCl3分子中每原子的最外层电子都满足了8电子稳定结构 |
| B.P4和CH4都是正四面体形分子且键角都为109°28′ |
C.NH 的电子式为 的电子式为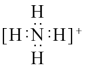 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
您最近一年使用:0次
名校
解题方法
8 . (1)基态溴原子的核外电子排布式为________ ,其核外电子所占用的最高能级电子云形状为_________ 。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____ ,σ键与π键数目之比为______ 。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______ 。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
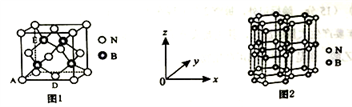
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为________ 。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___ pm.
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为
您最近一年使用:0次
解题方法
9 . 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等。运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是___________ (填元素符号),解释原因_____________________________________________
(2)二甲基二硫和甲酸中,在水中溶解度较大的是______ (填名称),原因是_________________________________ ;烧碱所属的晶体类型为________ ;硫化碱(Na2S)的S2-的基态电子排布式是__________________________
(3)硝酸铵中,NO3-的立体构型为_______ ,中心原子的杂化轨道类型为______________
(4)1mol化合物NaCN中CN-所含的π键数为_____ ,与CN-互为等电子体的分子有________ 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式____________ 。
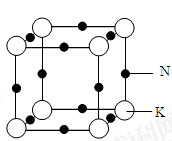
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________ ;晶胞中K 原子的配位数为______ ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 __________________ (列出计算式,不需要计算出结果)。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是
(2)二甲基二硫和甲酸中,在水中溶解度较大的是
(3)硝酸铵中,NO3-的立体构型为
(4)1mol化合物NaCN中CN-所含的π键数为
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为

您最近一年使用:0次
2016-12-09更新
|
388次组卷
|
5卷引用:【全国校级联考】重庆市江津巴县长寿等七校联盟2018届高三第三次联考理综化学试题



