名校
解题方法
1 . 回答下列问题:
(1)在周期表中,与Li化学性质最相似的邻族元素是_______ 。
(2) 的空间结构为
的空间结构为_______ 形,其中心原子的杂化轨道类型为_______ 。
(3)NH4H2PO4中,电负性最高的元素是_______ ;P的_____ 杂化轨道与O的2p轨道形成____ 键(填σ或π)。
(4)PH3和NH3相比,_______ 更易液化;原因_______ 。
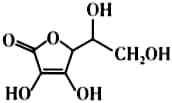
(5)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为_______ ;推测抗坏血酸在水中的溶解性:______ (填“难溶于水”或“易溶于水”)。
(1)在周期表中,与Li化学性质最相似的邻族元素是
(2)
 的空间结构为
的空间结构为(3)NH4H2PO4中,电负性最高的元素是
(4)PH3和NH3相比,
(5)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

您最近一年使用:0次
名校
解题方法
2 . 前四周期元素M、Q、W、X、Y、Z原子序数依次增大。M的单质常用作保护气,W是元素周期表中电负性最大的元素,X与Y形成化合物的化学式为YX且其焰色试验为紫色(透过蓝色钴玻璃),Z的原子序数为28,Q和Y形成的一种化合物甲的晶胞在xy平面、xz平面、yz平面上的投影图如图所示。W、Y、Z三种元素组成的化合物乙的晶体结构如图乙所示。
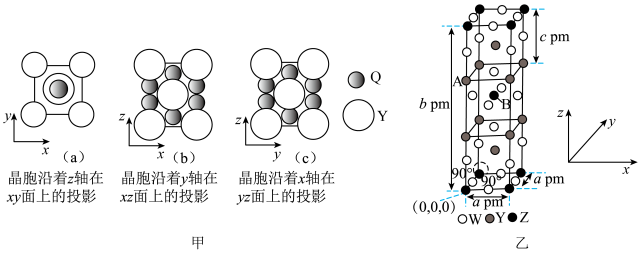
下列说法正确的是

下列说法正确的是
A.键角: | B.X是其所在周期第一电离能最大的元素 |
C.简单氢化物沸点: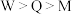 | D.化合物甲的化学式为YQ2 |
您最近一年使用:0次
2024-01-02更新
|
172次组卷
|
2卷引用:2024届河南省焦作市博爱县第一中学高三一模化学试题
3 . 短周期主族元素W、X、Z、Y的原子序数依次增大,简单离子所带电荷与离子半径的关系如图所示。下列叙述错误的是


A.电负性: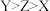 |
B.简单氢化物的还原性: |
C. 分子的 分子的 模型为三角锥形 模型为三角锥形 |
| D.Y、Z的氧化物对应的水化物可能是弱酸 |
您最近一年使用:0次
名校
4 . 锰酸钾( )可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗
)可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗 为原料,制备锰酸钾的反应为:
为原料,制备锰酸钾的反应为: 。下列说法错误的是
。下列说法错误的是
 )可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗
)可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗 为原料,制备锰酸钾的反应为:
为原料,制备锰酸钾的反应为: 。下列说法错误的是
。下列说法错误的是| A.X的化学式是KCl |
B. 阴离子的VSEPR模型为四面体形 阴离子的VSEPR模型为四面体形 |
C. 、 、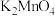 均具有氧化性和还原性 均具有氧化性和还原性 |
| D.生成1molX,转移2mol电子 |
您最近一年使用:0次
2023-05-27更新
|
281次组卷
|
3卷引用:2024届河南省焦作市博爱县第一中学高三一模化学试题
5 . 短周期元素X、Y、Z、M、T、R在元素周期表中的相对位置如图所示,请回答下列问题:
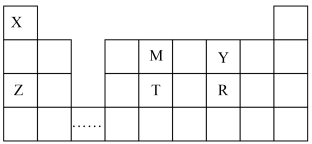
(1)元素X、M、Y的电负性由大到小的顺序为_______ (用元素符号表示)。
(2)T形成的单质的晶体类型为_______ 。
(3)基态R原子中,其电子占据的最高能层的符号为_______ ;基态Z离子占据的最高能级共有_______ 个原子轨道。
(4)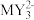 离子的空间构型为
离子的空间构型为_______ 。
(5)从原子轨道重叠方式分类,化合物M2X4中M、M之间的 键类型为_______(填序号)。
键类型为_______(填序号)。

(1)元素X、M、Y的电负性由大到小的顺序为
(2)T形成的单质的晶体类型为
(3)基态R原子中,其电子占据的最高能层的符号为
(4)
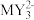 离子的空间构型为
离子的空间构型为(5)从原子轨道重叠方式分类,化合物M2X4中M、M之间的
 键类型为_______(填序号)。
键类型为_______(填序号)。| A.s-p | B.p-P | C.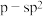 | D. |
您最近一年使用:0次
名校
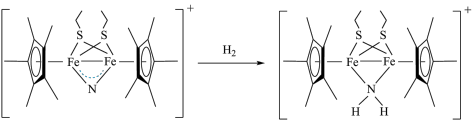
6 . 科学家近期合成了一种配合物,该物质可以在温和条件下活化 ,将
,将 转化为
转化为 ,反应过程如图所示。下列说法正确的是
,反应过程如图所示。下列说法正确的是
 ,将
,将 转化为
转化为 ,反应过程如图所示。下列说法正确的是
,反应过程如图所示。下列说法正确的是
A.电负性大小: | B.键角: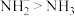 |
C.产物中 原子的杂化轨道类型为 原子的杂化轨道类型为 | D. 的VSEPR模型为四面体形 的VSEPR模型为四面体形 |
您最近一年使用:0次
2023-01-12更新
|
188次组卷
|
2卷引用:河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题
名校
7 . 我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)Cl(用R代表),经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。从结构角度分析,R中两种阳离子不同之处为
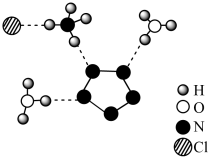

| A.中心原子的VSEPR模型 |
| B.中心原子的价层电子对数 |
| C.立体结构 |
| D.共价键类型 |
您最近一年使用:0次
2022-12-15更新
|
885次组卷
|
4卷引用:河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题
河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章01讲核心黑龙江省大庆市大庆中学2022-2023学年高二下学期4月月考化学试题(已下线)第二章分子结构与性质(B卷)
8 . 下列叙述中正确的是
| A.NH3、CO、CO2都是极性分子 |
| B.CH4、CCl4都是含有极性键的非极性分子 |
| C.HF、HCl、HBr、HI的稳定性依次增强 |
| D.CS2、H2O、C2H2都是直线形分子 |
您最近一年使用:0次
2022-10-18更新
|
2597次组卷
|
78卷引用:河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题
河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷2008年理综全国卷Ⅰ高考试题化学试题(已下线)2012届广西桂林十八中高三第一次月考化学试卷(已下线)2011-2012学年山西大同实验中学高二下学期期中考试化学试卷(已下线)2011-2012学年新疆农七师高级中学高二下学期期末考试试化学试卷(已下线)2011-2012学年福建省漳州立人学校高二下学期期中考试化学试卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2012-2013学年河北省唐山市第一中学高二下学期期末考试化学试卷(已下线)2013届山西省山西大学附中高三9月月考化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷2015-2016学年重庆市第八中学高二下第三次月考化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷2015-2016学年重庆四十二中高一下期中化学试卷(已下线)同步君 选修3 第二章 第三节 键的极性和分子的极性2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷2016-2017学年山东省淄博市高青一中、淄博实验中学高二下学期期中联考化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题陕西省黄陵中学2016-2017学年高二(重点班)下学期第三学月考化学试题高中化学人教版 选修三 第2章 分子结构与性质 键的极性和分子的极性(已下线)【段考模拟】高二化学下学期第一次月考(3月)原创B卷宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题(已下线)2019年6月12日 《每日一题》 选修3-物质类别、键的极性及分子的极性之间的关系安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题吉林省长春市汽车经济开发区第三中学2018-2019学年高二下学期期中考试化学试题云南省普洱市孟连县一中2018-2019学年高二下学期期末考试化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题上海市青浦二中2016届高三上学期8月摸底考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期线上检测化学试题河北省唐山市路北区第十一中学2019-2020学年高二期中考试化学试题辽宁省六校协作体2019-2020高二下学期期初考试化学试卷吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题安徽省六安中学2019-2020学年高二下学期期末考试化学试题新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题福建省龙海市第二中学2019-2020学年高二下学期期末考试化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 章末综合检测卷四川省绵阳市江油中学2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题辽宁省阜新二高2020-2021学年高二下学期期中考试化学试题云南省通海县一中2020-2021学年高二下学期期中考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题人教2019选择性必修2第二章 分子结构与性质复习与提高黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题福建省南安市侨光中学、昌财实验中学2021-2022学年高二下学期第4次联考(期中)化学试题宁夏贺兰县景博中学2021-2022学年高二下学期第一次月考化学试题四川省绵阳市盐亭中学2022-2023学年高二上学期第一次月考教学质量检测化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测山东省威海市文登新一中2021-2022学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题广东省台山市第一中学2022-2023学年高二下学期第一次月考化学试题江西省景德镇市2022-2023学年高二下学期4月期中测试化学试题广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题福建省德化第二中学2022-2023学年高二下学期期中考试化学试题安徽省合肥市第七中学2022-2023学年高二下学期期中检测化学试题广东省珠海市第三中学2023-2024学年高二下学期3月月考化学试卷河北省衡水市枣强中学2023-2024学年高二下学期第一次调研考试化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题四川省富顺一中2023-2024学年高二下学期第一次月考化学试题广东省惠州市华罗庚中学2023-2024学年高二下学期3月月考化学试题广东梅州五华县中英文实验学校2023-2024学年高二下学期3月考试化学试题
名校
解题方法
9 . 我国科技工作者利用计算机技术,预测了超硬钨氮化合物( )并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
)并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
(1)区分 是否为晶体的最可靠的科学方法为
是否为晶体的最可靠的科学方法为_______ 。
(2)已知基态W原子的价层电子排布式为 ,则基态W原子核外最外层电子占据的能层符号是
,则基态W原子核外最外层电子占据的能层符号是_______ ;与基态 原子相比,基态W原子与基态
原子相比,基态W原子与基态 原子的未成对电子数之比为
原子的未成对电子数之比为_______ 。
(3)常见的含氮微粒有 、
、 、
、 、
、 、
、 等。
等。
① 的组成元素中,电负性最大的元素是
的组成元素中,电负性最大的元素是_______ (填元素符号,下同);第一电离能最大的元素是_______ 。
② 中心原子的杂化类型为
中心原子的杂化类型为_______ ; 的空间构型为
的空间构型为_______ 。
③已知 中存在一个大π键,可用符号
中存在一个大π键,可用符号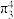 表示(3表示原子数,4表示参与形成大π键的p电子数),则一个
表示(3表示原子数,4表示参与形成大π键的p电子数),则一个 中键合电子(形成化学键的电子)的总数为
中键合电子(形成化学键的电子)的总数为_______ 。
④ 在水中的溶解性比
在水中的溶解性比 大很多,其主要原因是
大很多,其主要原因是_______ 。
(4)磷化硼( )是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设
)是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设 表示阿伏加德罗常数的值,则磷化硼晶体的密度为
表示阿伏加德罗常数的值,则磷化硼晶体的密度为_______  (用含a、
(用含a、 的计算式表示)。
的计算式表示)。

 )并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。
)并进行合成,这对扩充超硬材料家族以及研究硬度起源都有重要的科学意义。(1)区分
 是否为晶体的最可靠的科学方法为
是否为晶体的最可靠的科学方法为(2)已知基态W原子的价层电子排布式为
 ,则基态W原子核外最外层电子占据的能层符号是
,则基态W原子核外最外层电子占据的能层符号是 原子相比,基态W原子与基态
原子相比,基态W原子与基态 原子的未成对电子数之比为
原子的未成对电子数之比为(3)常见的含氮微粒有
 、
、 、
、 、
、 、
、 等。
等。①
 的组成元素中,电负性最大的元素是
的组成元素中,电负性最大的元素是②
 中心原子的杂化类型为
中心原子的杂化类型为 的空间构型为
的空间构型为③已知
 中存在一个大π键,可用符号
中存在一个大π键,可用符号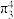 表示(3表示原子数,4表示参与形成大π键的p电子数),则一个
表示(3表示原子数,4表示参与形成大π键的p电子数),则一个 中键合电子(形成化学键的电子)的总数为
中键合电子(形成化学键的电子)的总数为④
 在水中的溶解性比
在水中的溶解性比 大很多,其主要原因是
大很多,其主要原因是(4)磷化硼(
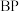 )是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设
)是超硬材料家族的重要成员之一,其晶胞结构如图所示,若硼原子与磷原子最近的距离为anm,设 表示阿伏加德罗常数的值,则磷化硼晶体的密度为
表示阿伏加德罗常数的值,则磷化硼晶体的密度为 (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
2022-06-15更新
|
120次组卷
|
2卷引用:河南省焦作市第一中学2021-2022学年高二下学期期末考试化学试题
真题
名校
10 . 用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
您最近一年使用:0次
2019-01-30更新
|
2678次组卷
|
77卷引用:河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷
河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷(已下线)09-10年辽宁大连23中高二下学期期末考试化学卷(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)09—10年哈三中高二下学期期末考试化学卷2007年普通高等学校招生全国统一考试(海南卷)化学试题(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年福建省厦门六中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷(已下线)2011-2012学年河南省偃师高中高二3月月考化学试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试理科化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二下学期期末考试化学试卷(已下线)2012-2013学年福建省福州文博中学高二上学期期末考试化学试卷(已下线)2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年辽宁省沈阳二中高二下学期期中考试化学试卷(已下线)2013-2014河北正定中学第二学期第一次月考高二化学试卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷2014-2015福建省四地六校高二下学期第一次联考化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山高中高二下学期期中化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷2015-2016学年河南省三门峡市灵宝一中高二下第一次月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷(已下线)同步君 选修3 第二章 第二节 第一课时 价电子互斥理论2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题广西宾阳县宾阳中学2016-2017学年高二下学期7月期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题陕西省宝鸡中学2016-2017学年高二下学期期末考试化学试题河北省定州中学2018届高三上学期高中毕业班第一次调研化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题高中化学人教版 选修三 第2章 分子结构与性质 价电子对互斥理论宁夏青铜峡市高级中学2017-2018学年高二上学期期末考试化学试题人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第1课时)河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题福建省晋江市季延中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷山东省泰安市2020年高二下学期化学期中考试(鲁科版)吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题新疆吐蕃市高昌区第二中学2019-2020学年高二下学期期末考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题福建省龙岩市武平县第一中学2020-2021学年高二上学期10月月考化学试题四川省阿坝州九寨沟2019-2020学年高二上学期期末考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)山西省晋中市新一双语学校2020-2021学年高二下学期3月月考化学试题山西省太原市2020-2021学年高二下学期期中质量监测理科化学试题吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期期中考试化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)宁夏吴忠中学2021-2022学年高三上学期第一次月考化学试题(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题(已下线)专题14 分子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题黑龙江省友谊县高级中学2022-2023学年高二上学期期末考试(新教材)化学试题贵州省江口中学2022-2023学年高二下学期3月份月考化学试题陕西省西安市铁一中学2022-2023学年高二下学期4月期中考试化学试题四川省资阳中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第二次月考化学试题湖南省株洲市炎陵县第一中学等2校2022-2023学年高二下学期开学考试化学试题2.2.1分子空间结构的理论分析(课后)-鲁科版选择性必修2河南省周口市西华县第一高级中学2023-2024学年高二上学期月考化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题山西省大同市浑源七中2023-2024学年高二下学期第一次月考化学试题辽宁省本溪市第一中学2023-2024学年高二上学期1月期末化学试题



