河北玉田县第一中学2021届高三上学期12月段考化学试题
河北
高三
阶段练习
2021-01-14
269次
整体难度:
适中
考查范围:
认识化学科学、化学与STSE、常见无机物及其应用、化学实验基础、有机化学基础、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
| A.指南针由天然磁石制成,磁石的主要成分是Fe3O4 |
| B.宣纸的主要成分是纤维素,纤维素属于天然高分子化合物 |
| C.活字印刷使用的胶泥由Al2O3、SiO2,CaO等组成,它们都属于氧化物 |
| D.黑火药爆炸反应为2KNO3+3C+S═K2S+N2↑+3CO2↑,其中氧化剂只有KNO3 |
| A.HClO 的结构式为H-Cl-O | B.核内有33个中子的Fe表示为 Fe Fe |
C.NH2OH的电子式为  | D.CH3CHO 的球棍模型为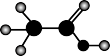 |
A.Na(s) Na2O2(s) Na2O2(s)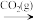 Na2CO3(s) Na2CO3(s) |
B.N2(g) NO(g) NO(g)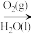 HNO3(aq) HNO3(aq) |
C.Al2O3(s)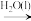 Al(OH)3(s) Al(OH)3(s) AlCl3(aq) AlCl3(aq) |
D.H2SiO3(s) SiO2(s) SiO2(s) SiCl4(aq) SiCl4(aq) |
【知识点】 物质的转化 硅酸 钠与氧气等非金属的反应解读 氧化铝
| A.SO2:Cu与浓H2SO4混合加热 | B.NH3:加热氯化铵固体 |
| C.Cl2:MnO2与稀HCl溶液混合 | D.HI:NaI与浓H2SO4混合 |
选项 | 物质(杂质) | 方法 |
A | NaHCO3(Na2CO3) | 通入CO2 |
B | FeCl3(FeCl2) | 通入Cl2 |
C | CO2(SO2) | 通过饱和NaHCO3溶液 |
D | CH4(乙烯) | 通过酸性高锰酸钾溶液 |
| A.A | B.B | C.C | D.D |
| A.NCl3中所有原子都满足8电子结构 |
| B.根据上面化学方程式,生成22.4L NH3时转移电子数目为6NA |
| C.在NaClO2和NCl3的反应中,氧化剂与还原剂的物质的量之比为6:1 |
| D.ClO2可用于净水,其原理与明矾相同 |
【知识点】 氧化还原反应的几组概念解读 共价键的实质与形成解读 电子转移计算
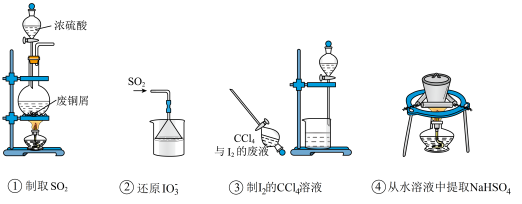
| A.①②③④ | B.①②③ | C.②③④ | D.②④ |
A.向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O = AlO +4NH +4NH +2H2O +2H2O |
B.足量NaHCO3溶液与澄清石灰水反应:HCO + Ca2++OH-= CaCO3↓+ H2O + Ca2++OH-= CaCO3↓+ H2O |
| C.向Mg(OH)2悬浊液中加入FeCl3溶液,白色沉淀转化为红褐色沉淀:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
D.NaHCO3溶液与NaHSO4溶液反应:CO +2H+= H2O+CO2↑ +2H+= H2O+CO2↑ |
【知识点】 离子方程式的正误判断解读 碳酸氢钠与碱反应解读 沉淀溶解平衡的应用
| A.A元素的含氧酸属于强酸 |
| B.B的最高价氧化物的水化物可溶于盐酸和氨水 |
| C.C 元素的单质在足量氧气中反应可生成 SO3 |
| D.D 的最高价氧化物的水化物一定为强电解质 |
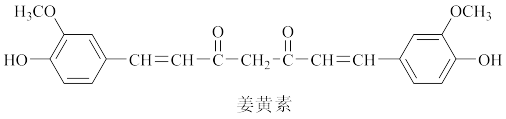
| A.分子式为C21H20O6 | B.分子中存在手性碳原子 |
| C.与浓溴水反应,消耗4 mol Br2 | D.既能发生取代反应,又能发生加成反应和氧化反应 |
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是 A.室温下,等体积的pH=l的 和pH=l的 和pH=l的 ,所含有的 ,所含有的 的个数均为0.1 的个数均为0.1 |
| B.1mol 羟基含电子数为10 NA |
C.向含有 各1mol的溶液中,通入一定量的 各1mol的溶液中,通入一定量的 ,充分反应后,发现有一种离子剩余,则转移电子的数目为 ,充分反应后,发现有一种离子剩余,则转移电子的数目为 |
D.20 g HF气体通入水中,其断裂的共价键数目为 |
 CH2=CH2+4H2O(g),不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是( )
CH2=CH2+4H2O(g),不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法正确的是( )
| A.其他条件相同时,M点的反应速率一定比N点大 |
| B.M点时,产物乙烯的体积分数为7.7% |
| C.其他条件相同时,N点的平衡常数比M点的大 |
| D.N点时向容器中再充入体积比为3:1的H2和CO2,再次达平衡时CO2的转化率降低 |
选项 | 操作 | 目的 |
A | 用酚酞作指示剂,用标准的 | 测定 |
B | 用玻璃棒蘸取NaClO溶液,点在干燥的红色石蕊试纸上 | 证明HClO为弱酸 |
C | 给含碎瓷片的石蜡油加强热,并将气体通入酸性高锰酸钾溶液中 | 证明气体产物含碳碳双键 |
D | 在 | 证明 |
| A.A | B.B | C.C | D.D |

| A.放电时,电流由X电极经用电器、Y电极、H2SO4溶液回到X电极 |
| B.放电过程中,H+向X电极移动 |
C.充电时,X电极反应式:VO2+﹣e﹣+H2O═VO +2H+ +2H+ |
| D.充电时,每转移1mol电子,左池溶液中n(H+)的变化量为2mol |
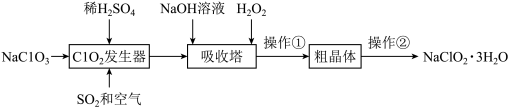
| A.加入的H2O2起氧化作用 |
| B.吸收塔中氧化剂与还原剂的物质的量之比为2:1 |
C.ClO2发生器中发生反应的离子方程式为2ClO + SO2 ═ 2ClO2 + SO + SO2 ═ 2ClO2 + SO |
| D.操作②实验方法是重结晶 |
| A.当V=10mL时,溶液中各粒子的浓度关系为:c(HA) + 2c(H+) = c(A-) + 2c(OH-) |
| B.当V=10mL时,溶液呈碱性 |
| C.当V=20mL时,溶液中各粒子的浓度大小关系为: c(Na+) > c(A-) > c(OH-) > c(HA) |
| D.当V=40mL时,溶液中各粒子的浓度关系为: c(Na+)= 2c(A-) + 2 c(HA) |
二、解答题 添加题型下试题
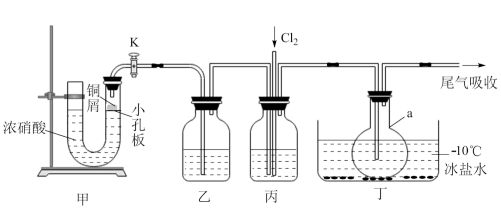
(1)仪器a的名称是
(2)装置乙中的试剂是
(3)装置丙的作用有:使两种气体充分混合、干燥气体和
(4)装置丁中生成NOCl的化学方程式是
(5)工业制得的NOCl中常含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.441g样品溶于适量的NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用硝酸酸化的0.4000mol•L﹣1 AgNO3溶液滴定至产生砖红色沉淀,消耗AgNO3溶液的体积为25.00mL,则NOCl的质量分数为

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中V2O3转化为VO2+,反应的离子方程式为
(2)萃取前用“铁粉”对浸出液进行处理,主要目的是
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R
 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用a.NaCl b.NaOH c.H2SO4
(4)反萃取后的水层中加KClO3,使VO2+变为VO
 ,ClO
,ClO 变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为
变为Cl﹣。当反应3mol VO2+时,至少需要KClO3的物质的量为(5)已知NH4VO3难溶于水,Ksp=3.0×10﹣8,向10mL 0.2mol•L﹣1 NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为①CO(g) + 2H2(g)⇌CH3OH(g) ΔH1= ―90.7kJ.mol-1
②2CH3OH(g)⇌CH3OCH3(g) + H2O(g) ΔH2= ―23.5kJ.mol-1
③CO(g) + H2O(g)⇌CO2(g) + H2(g) ΔH3 = ― 41.2 kJ.mol-1
回答下列问题:
(1)则反应3H2(g) + 3CO(g)⇌CH3OCH3(g) + CO2(g) ΔH=
(2)以下说法能说明反应3H2(g) + 3CO(g)⇌CH3OCH3(g) + CO2(g)达到平衡状态的有
A.CO和CH3OCH3的浓度之比保持3︰1不变
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
(3)如图所示装置,装置A是二甲醚燃料电池,该装置工作时电子从b极流向Fe电极。

①A池中b电极反应式为
②若装置B中溶液体积为300 mL,假设反应前后溶液体积不变,当装置A中消耗0.0025 mol二甲醚时,装置B中溶液的pH为
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2⇌2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:

(已知气体分压(
 )=气体总压(
)=气体总压( )×体积分数)
)×体积分数)①该反应ΔH
②650 ℃ 时,反应达平衡后CO2的转化率为
③T ℃ 时,用平衡分压代替平衡浓度表示的化学平衡常数

 。
。
(1)基态锰的价层电子排布式为
 )
) )。
)。(2)氧化锰能催化氧化HCHO生成
 和
和 。
。①等物质的量的HCHO、
 分子中
分子中 键数目之比为
键数目之比为②在HCHO、
 、
、 中,空间构型呈V形的分子是
中,空间构型呈V形的分子是③HCHO中C原子的杂化类型是
(3) [Zn(NH3)4]SO4中不存在的作用力类型是
A.非极性键 B.配位键 C.离子键 D.金属键
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:

 ,理由是
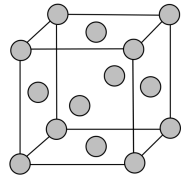
,理由是(5)铅晶胞如图所示。
已知:铅晶胞密度为
 ,
, 代表阿伏加德罗常数的值。
代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为
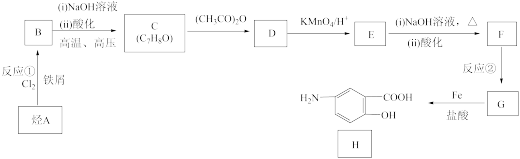
已知:Ⅰ.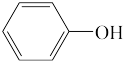

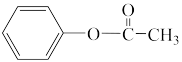
Ⅱ.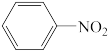
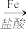
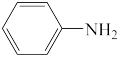
(1)H的分子式是
(2)D的结构简式是
(3)E与足量NaOH溶液反应的化学方程式是
(4)设计C→D和E→F两步反应的共同目的是
(5)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为3:2:2,写出1种符合要求的X的结构简式
(6)已知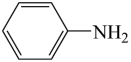 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物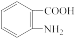 的合成路线
的合成路线
试卷分析
试卷题型(共 21题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 氧化还原反应的几组概念 化学科学对人类文明发展的意义 | |
| 2 | 0.94 | 有关粒子结构的化学用语 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价型分子结构式、电子式 | |
| 3 | 0.85 | 物质的转化 硅酸 钠与氧气等非金属的反应 氧化铝 | |
| 4 | 0.85 | 氯气的制法 氨气的实验室制法 二氧化硫的制备 常见气体的制备与收集 | |
| 5 | 0.65 | 碳酸钠与碳酸氢钠的相互转化 铁盐、亚铁盐相互除杂 乙烯与强氧化性物质的反应 物质分离、提纯的常见化学方法 | |
| 6 | 0.65 | 氧化还原反应的几组概念 共价键的实质与形成 电子转移计算 | |
| 7 | 0.65 | 二氧化硫的制备 物质分离、提纯的常见物理方法 常见无机物的制备 综合实验设计与评价 | |
| 8 | 0.4 | 离子方程式的正误判断 碳酸氢钠与碱反应 沉淀溶解平衡的应用 | |
| 9 | 0.65 | 元素周期律、元素周期表的推断 元素周期律的应用 “位构性”关系理解及应用 | |
| 10 | 0.65 | 分子的手性 酚类的取代反应 多官能团有机物的结构与性质 | |
| 11 | 0.85 | 阿伏加德罗常数的求算 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 | |
| 12 | 0.65 | 影响化学反应速率的因素 化学平衡的移动及其影响因素 等效平衡 化学平衡的有关计算 | |
| 13 | 0.65 | 测定溶液pH的方法 石蜡油分解实验 | |
| 14 | 0.65 | 电化学计算 新型电池 原电池、电解池综合考查 电解池电极反应式及化学方程式的书写与判断 | |
| 15 | 0.65 | 氧化还原反应的应用 蒸发与结晶 | |
| 16 | 0.4 | 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 盐的水解常数 | |
| 二、解答题 | |||
| 17 | 0.65 | 二氧化氮与水反应 酸碱中和滴定原理的应用 物质制备的探究 | 实验探究题 |
| 18 | 0.4 | 氧化还原反应有关计算 浓度对化学平衡移动的影响 萃取和分液 常见无机物的制备 | 工业流程题 |
| 19 | 0.65 | 盖斯定律与热化学方程式 化学平衡的有关计算 化学平衡状态的判断方法 电解池有关计算 | 原理综合题 |
| 20 | 0.15 | 物质结构与性质综合考查 价层电子对互斥理论的应用 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 21 | 0.65 | 逆合成分析法 根据题给物质选择合适合成路线 有机合成综合考查 有机推断综合考查 | 有机推断题 |

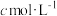 盐酸滴定一定体积未知浓度的
盐酸滴定一定体积未知浓度的 溶液
溶液 溶液中滴加适量稀硫酸,再加入
溶液中滴加适量稀硫酸,再加入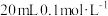 草酸溶液。将溶液分成两份,其中一份中加 入
草酸溶液。将溶液分成两份,其中一份中加 入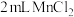 溶液,另一份中加入2 mL蒸馏水
溶液,另一份中加入2 mL蒸馏水 能降低该反应的活化能
能降低该反应的活化能

