名校
解题方法
1 . 下列有关物质的性质与用途具有对应关系的是
A. 是红棕色粉末,可用作油漆的颜料 是红棕色粉末,可用作油漆的颜料 |
B. 能溶于水,可用于生产盐酸 能溶于水,可用于生产盐酸 |
C. 为白色固体,可用于游泳池杀菌消毒 为白色固体,可用于游泳池杀菌消毒 |
D. 能与碱反应,可用作焙制糕点的膨松剂 能与碱反应,可用作焙制糕点的膨松剂 |
您最近一年使用:0次
2023-01-10更新
|
311次组卷
|
4卷引用:湖南省株洲市渌口区第三中学2022-2023学年高一上学期期末考试化学试题
湖南省株洲市渌口区第三中学2022-2023学年高一上学期期末考试化学试题江苏省南通市通州区2022-2023学年高一上学期期末考试化学试题山东省曹县第一中学2022-2023学年高一上学期期末考试化学试题(已下线)题型02 重要元素及其化合物的性质和转化-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)
2 . (1)相同体积的三种溶液 、
、 、
、 ,所含
,所含 的物质的量浓度相同,各溶质的物质的量浓度之比为
的物质的量浓度相同,各溶质的物质的量浓度之比为___________ 。
(2)已知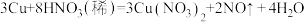 ;该反应中,若被还原的
;该反应中,若被还原的 为1mol,转移电子的物质的量为
为1mol,转移电子的物质的量为___________ mol。
(3)将15.8gNaOH与 的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为:
的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为: ,则原混合物中NaOH与
,则原混合物中NaOH与 的物质的量之比为
的物质的量之比为___________ ;形成这样的溶液,所需水的体积为___________ mL(水的密度以1.00 计)。
计)。
 、
、 、
、 ,所含
,所含 的物质的量浓度相同,各溶质的物质的量浓度之比为
的物质的量浓度相同,各溶质的物质的量浓度之比为(2)已知
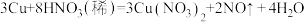 ;该反应中,若被还原的
;该反应中,若被还原的 为1mol,转移电子的物质的量为
为1mol,转移电子的物质的量为(3)将15.8gNaOH与
 的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为:
的混合物全部溶于一定量的水中,生成气体体积为1.12L(标况下)。若反应后溶液中的粒子个数关系为: ,则原混合物中NaOH与
,则原混合物中NaOH与 的物质的量之比为
的物质的量之比为 计)。
计)。
您最近一年使用:0次
13-14高三·宁夏银川·阶段练习
名校
解题方法
3 . 足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和二氧化氮、一氧化氮的混合气体2.24L(标准状况),这些气体与一定体积(标准状况)氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·L-1氢氧化钠溶液至铜离子恰好完全沉淀,则消耗氢氧化钠溶液的体积是50mL,下列说法正确的是
| A.混合气体中含二氧化氮1.12L |
| B.消耗氧气的体积为1.68L |
| C.此反应过程中转移的电子为0.3mol |
| D.参加反应的硝酸是0.4mol |
您最近一年使用:0次
2021-08-25更新
|
797次组卷
|
30卷引用:湖南省怀化市沅陵县第一中学2021-2022学年高一下学期第一次月考化学试题
湖南省怀化市沅陵县第一中学2021-2022学年高一下学期第一次月考化学试题(已下线)2015届宁夏银川一中高三第四次月考化学试卷2014-2015吉林省松原市扶余县一中高一上学期期末化学试卷2015届山东省滕州市三中上学期高三第四次月考理综化学试卷2016届河南省扶沟县高级中学高三上学期开学考试化学试卷2016届河南省三门峡市陕州中学高三上学期第一次精英对抗赛化学试卷2016届重庆市万州第二高级中学高三上学期期中测试理综化学试卷2015-2016学年河北省冀州中学高一下开学考试化学试卷2016届河南省信阳市鸡公山风景区学校高三下2月月考化学试卷2015-2016学年安徽省六安一中高一下周末作业二化学试卷2015-2016学年安徽师大附中高一下学期期中考查化学试卷2015-2016学年山东省淄博六中高一下学科竞赛化学试卷2017届广西桂林市第十八中学高三上第二次月考化学试卷2018届高三一轮复习化学:考点21-铜及其化合物性质探究(已下线)《考前20天终极攻略》-5月26日 元素及其化合物福建省三明市第一中学2018-2019学年高二上学期开学考化学试题云南省新平县一中2018-2019学年高一上学期12月月考化学试题贵州省黔南布依族苗族自治州龙里中学2019-2020学年高一上学期期末考试化学试题辽宁省大连市一〇三中学2019-2020学年高一下学期期中考试化学试题河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题安徽省芜湖市2021届高三第二次月考化学试题江西省高安中学2020-2021学年高一上学期期末考试化学试题四川省邻水实验学校2020-2021学年高一下学期第一次月考化学试题福建省福州第三中学2020-2021学年高一下学期期中考化学试题(已下线)专题02 氮及其化合物【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 浙江省诸暨市第二高级中学2020-2021学年高二下学期期中考试化学试题内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题重庆市第七中学校2021-2022学年高一下学期3月月考化学试题云南省普洱市镇沅彝族哈尼族拉祜族自治县第一中学2021-2022学年高一下学期4月份考试化学试题
名校
解题方法
4 . 硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:___________ ;向混合溶液中通入热空气的反应的离子方程式是___________ ;可循环利用的物质是___________ (填化学式)。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:___________ 。(氨水用“NH3·H2O”表示)
②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是___________ 。
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:
含 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水 达标
达标
①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程___________ 。
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的___________ (填字母)。
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:
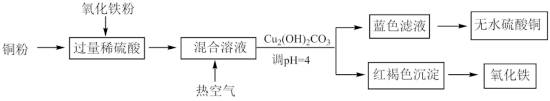
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高。当控制好尾气的流量一定时,调节溶液的pH的方法是
(3)氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图:
的形式存在。某工厂处理氨氮废水的流程如图:含
 的废水
的废水 低浓度氨氮废水
低浓度氨氮废水 含余氯废水
含余氯废水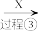 达标
达标①过程②加入NaClO溶液可将氨氮物质(以NH3表示)转化为无毒物质,请用离子方程式表示该转化过程
②含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到将余氯转化为无毒物质的目的
a.KOH b.Na2SO3 c.KMnO4 d.Na2S
您最近一年使用:0次
2024-05-03更新
|
174次组卷
|
2卷引用:湖南省常德市石门县第一中学2023-2024学年高一下学期化学期中考试题
5 . 由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:

已知:Ⅰ.透明氧化铁又称纳米氧化铁,粒子直径微小(10~90 nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
Ⅱ.Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)基态Fe2+的价层电子排布图为_______ 。
(2)“滤渣”中的主要成分是_______ 。
(3)流程中“ ”环节的目的是
”环节的目的是_______ 。
(4)“还原”过程中涉及的离子方程式为_______ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_______ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47 g透明氧化铁,用稀硫酸溶解并定容至1 L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为_______ %(保留小数点后一位);若吸光度A减小,则氧化铁红的含量将_______ (填“增大”或“减小”)。

已知:Ⅰ.透明氧化铁又称纳米氧化铁,粒子直径微小(10~90 nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
Ⅱ.Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)基态Fe2+的价层电子排布图为
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47 g透明氧化铁,用稀硫酸溶解并定容至1 L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为
您最近一年使用:0次
2022-09-30更新
|
221次组卷
|
2卷引用:湖南省长沙市第一中学2022-2023学年高三上学期月考(一)化学试题
名校
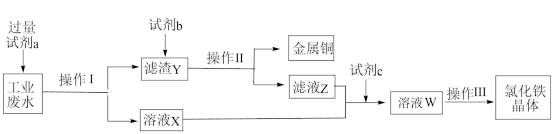
6 . 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是

则下列说法正确的是
| A.试剂a是铁、试剂b是稀盐酸 |
| B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同 |
| C.用KMnO4酸性溶液可检验溶液W中是否含有Fe2+ |
| D.试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl- |
您最近一年使用:0次
2022-01-20更新
|
215次组卷
|
2卷引用:湖南省邵阳市新邵县2021-2022学年高一上学期期末质量检测化学试题
名校
解题方法
7 . 某硫酸厂以硫铁矿焙烧后的烧渣(其主要成分为 、
、 、
、 )为原料来制取铵明矾晶体
)为原料来制取铵明矾晶体 的一种工艺流程如图。
的一种工艺流程如图。
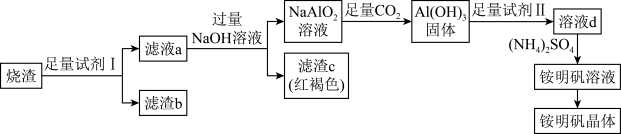
已知:① 是酸性氧化物,难溶于水,酸浸时不发生反应。
是酸性氧化物,难溶于水,酸浸时不发生反应。
② 固体可溶于
固体可溶于 等强碱溶液。
等强碱溶液。
请回答下列问题:
(1)写出 中含有的化学键类型:
中含有的化学键类型:_______ 。
(2)“试剂Ⅰ”为_______ (填试剂名称),“滤渣b”为_______ (填化学式)。
(3)写出“滤液a”和 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 、_______ 。
(4)“滤渣c”的化学式为_______ ,证明铁元素已沉淀完全的实验方法是_______ 。
(5)向 溶液中通入足量
溶液中通入足量 的离子方程式为
的离子方程式为_______ 。
(6)从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、_______ (填操作名称)、洗涤、干燥。
 、
、 、
、 )为原料来制取铵明矾晶体
)为原料来制取铵明矾晶体 的一种工艺流程如图。
的一种工艺流程如图。
已知:①
 是酸性氧化物,难溶于水,酸浸时不发生反应。
是酸性氧化物,难溶于水,酸浸时不发生反应。②
 固体可溶于
固体可溶于 等强碱溶液。
等强碱溶液。请回答下列问题:
(1)写出
 中含有的化学键类型:
中含有的化学键类型:(2)“试剂Ⅰ”为
(3)写出“滤液a”和
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)“滤渣c”的化学式为
(5)向
 溶液中通入足量
溶液中通入足量 的离子方程式为
的离子方程式为(6)从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、
您最近一年使用:0次
8 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性,其中含氯消毒剂在生产生活中有着广泛的用途。
Ⅰ.某化学兴趣小组用如图装置制备家用消毒液。

(1)写出装置B中反应的离子方程式___________ 。
(2)装置A中的溶液是___________ ,长玻璃导管的作用是___________ 。图中装置的连接顺序是B、___________ 。
(3)用化学方程式表示装置D中“84”消毒液的生成过程:___________ 。
(4)居家消毒时,不能将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,原因是___________ 。
(5)某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为1∶3。则该反应中,被氧化的Cl与被还原的Cl的质量之比为
的物质的量之比为1∶3。则该反应中,被氧化的Cl与被还原的Cl的质量之比为___________ 。
Ⅱ.世界卫生组织将定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。
(6)消毒效率是用单位质量的消毒剂得电子数来表示的, 作消毒剂时和
作消毒剂时和 一样,还原产物均为
一样,还原产物均为 。
。 的消毒效率是
的消毒效率是 的
的___________ 倍(保留两位小数)。
Ⅰ.某化学兴趣小组用如图装置制备家用消毒液。

(1)写出装置B中反应的离子方程式
(2)装置A中的溶液是
(3)用化学方程式表示装置D中“84”消毒液的生成过程:
(4)居家消毒时,不能将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,原因是
(5)某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和
 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为1∶3。则该反应中,被氧化的Cl与被还原的Cl的质量之比为
的物质的量之比为1∶3。则该反应中,被氧化的Cl与被还原的Cl的质量之比为Ⅱ.世界卫生组织将定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。
(6)消毒效率是用单位质量的消毒剂得电子数来表示的,
 作消毒剂时和
作消毒剂时和 一样,还原产物均为
一样,还原产物均为 。
。 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
解题方法
9 . 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,与Cl2的氧化性相近,可用于自来水消毒。为检测二氧化氯能否与KI溶液反应,某兴趣小组设计了下述实验(实验装置如图所示,且气密性良好,D中稳定剂不能与Cl2反应)。回答下列问题:

(1)打开B的活塞,A中发生反应,且产物有ClO2、Cl2等,该反应的化学方程式为_______ 。
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时观察到F中溶液的颜色不变,则装置C的作用是_______ 。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并放出ClO2,反应的离子方程式为_______ 。打开E的活塞,D中发生反应,观察到装置F中的溶液变成蓝色,则F的反应中氢化剂与还原剂的物质的量之比为_______ 。
(4)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取300.0mL的水样,酸化,加入足量的碘化钾反应,再用0.2000 Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为:
Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为: ),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为
),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为_______  。
。
(5)该小组同学还制得了ClO2的水溶液,以探究FeI2的还原性。他们进行了如下实验:取一定量的FeI2溶液,向其中滴加少量ClO2的水溶液,振荡后溶液呈黄色,某同学对产生黄色的原因提出了如下假设:
假设1:Fe2+被ClO2氧化;
假设2: 被ClO2氧化。
被ClO2氧化。
为验证假设1,请你完成下表。

(1)打开B的活塞,A中发生反应,且产物有ClO2、Cl2等,该反应的化学方程式为
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时观察到F中溶液的颜色不变,则装置C的作用是
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并放出ClO2,反应的离子方程式为
(4)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取300.0mL的水样,酸化,加入足量的碘化钾反应,再用0.2000
 Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为:
Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为: ),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为
),恰好完全反应时用去25.00mL Na2S2O3溶液,测得该水样中的ClO2含量为 。
。(5)该小组同学还制得了ClO2的水溶液,以探究FeI2的还原性。他们进行了如下实验:取一定量的FeI2溶液,向其中滴加少量ClO2的水溶液,振荡后溶液呈黄色,某同学对产生黄色的原因提出了如下假设:
假设1:Fe2+被ClO2氧化;
假设2:
 被ClO2氧化。
被ClO2氧化。为验证假设1,请你完成下表。
| 实验步骤 | 预期现象 | 结论 |
| 取少量黄色溶液于试管中,滴加几滴 | 假设1正确 |
您最近一年使用:0次
解题方法
10 . 氯气是重要的化工原料,大量用于制造盐酸、有机溶剂和药品等。某小组同学利用下列装置在实验室制备氯气,并进行相关物质性质的探究。回答下列问题:
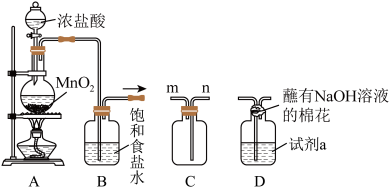
I.连接装置A→B→C,制备并收集 。
。
(1)装置A中发生反应的离子方程式_______ 。
(2)装置B中饱和食盐水的作用是_______ 。
(3)利用装置C收集 时,气体应该从
时,气体应该从_______ 口进(填“m”或“n”)。
Ⅱ.连接装置A→B→D,制备氯水。
(4)装置D中试剂a为 ,通入
,通入 即可制得氯水,则
即可制得氯水,则 与水反应的化学方程式为
与水反应的化学方程式为_______ 。
(5)将装置D制备的氯水转移至三颈烧瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈烧瓶中(图1),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。
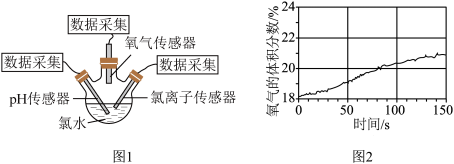
解释图2中曲线变化的原因_______ ,依此可判定实验过程中溶液 的变化趋势是
的变化趋势是_______ (填“增大”、“减小”或“不变”)。
Ⅲ.连接装置A→B→D,探究氯气的性质。
(6)将装置D中试剂a更换为紫色石蕊溶液,通入过量的 实验现象为
实验现象为_______ 。
(7)将装置D中试剂a更换为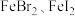 的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图3所示。已知还原性:
的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图3所示。已知还原性: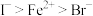 ,线段
,线段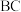 表示
表示_______ (填离子符号)物质的量的变化,原混合溶液中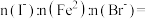
_______ 。


I.连接装置A→B→C,制备并收集
 。
。(1)装置A中发生反应的离子方程式
(2)装置B中饱和食盐水的作用是
(3)利用装置C收集
 时,气体应该从
时,气体应该从Ⅱ.连接装置A→B→D,制备氯水。
(4)装置D中试剂a为
 ,通入
,通入 即可制得氯水,则
即可制得氯水,则 与水反应的化学方程式为
与水反应的化学方程式为(5)将装置D制备的氯水转移至三颈烧瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈烧瓶中(图1),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。

解释图2中曲线变化的原因
 的变化趋势是
的变化趋势是Ⅲ.连接装置A→B→D,探究氯气的性质。
(6)将装置D中试剂a更换为紫色石蕊溶液,通入过量的
 实验现象为
实验现象为(7)将装置D中试剂a更换为
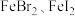 的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图3所示。已知还原性:
的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图3所示。已知还原性: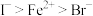 ,线段
,线段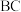 表示
表示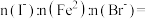

您最近一年使用:0次



