名校
解题方法
1 . 如图为 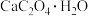 在
在 和
和 气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
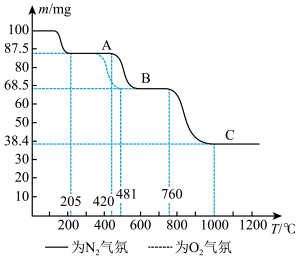
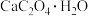 在
在 和
和 气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是
A.无论是 气氛还是 气氛还是 气氛,当 气氛,当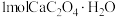 最终转变为 最终转变为 时,转移电子的物质的量相同 时,转移电子的物质的量相同 |
B.无论是 气氛还是 气氛还是 气氛, 气氛, 阶段均发生了氧化还原反应,但两者的气态产物不同 阶段均发生了氧化还原反应,但两者的气态产物不同 |
C.物质 为 为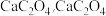 在隔绝空气条件下, 在隔绝空气条件下, 以下热稳定,不会分解 以下热稳定,不会分解 |
D.在酸性 溶液中加入少量 溶液中加入少量 固体样品时,溶液褪色且有少量气泡产生 固体样品时,溶液褪色且有少量气泡产生 |
您最近一年使用:0次
2021-11-24更新
|
738次组卷
|
3卷引用:湖南省长沙市第一中学2022-2023学年高三下学期月考(八)化学试题
湖南省长沙市第一中学2022-2023学年高三下学期月考(八)化学试题重庆市缙云教育联盟2021-2022学年高二11月质量检测化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
9-10高三·湖北荆州·阶段练习
2 . 有一混合溶液,其中只含有Fe2+、Cl-、Br-、I- (忽略水的电离),Cl-、Br-、I- 的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
| A.7:4 | B.7:3 | C.7:2 | D.7:1 |
您最近一年使用:0次
2020-08-20更新
|
1247次组卷
|
33卷引用:湖南省长沙市湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题
湖南省长沙市湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题(已下线)2010年湖北省监利县一中2011届高三八月月考化学试题(已下线)2011届年山东省淄博市重点中学高三上学期期中考试化学试卷(已下线)2010~2011学年河北省唐山一中高二下学期期末考试化学(已下线)2012届河北省唐山一中高三上学期期中考试化学试卷(已下线)2012届辽宁省铁岭中学高三上学期第三次月考化学试卷2014届河北省衡水中学高三上学期一调考试化学试卷(已下线)2014届江西省师大附中高三上学期期中考试化学试卷(已下线)2014届江西省师大附中高三上学期期中考试化学试卷2015届辽宁省丹东市高三总复习质量测试(一)理综化学试卷2016届甘肃省天水市第一中学高三上学期期中测试化学试卷2017届江西省鹰潭一中高三上学期第二次月考化学试卷2017届甘肃省天水一中高三上学期12月月考化学卷2017届甘肃省天水一中高三上12月月考化学试卷江西省鹰潭市2017-2018学年高一上学期期末质量检测化学试题【全国百强校】山东省济南市历城第二中学2019届高三上学期11月调研检测化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (题型专练)山西省晋中市平遥县第二中学2020届高三10月月考化学试题江苏省常州市第一中学2019-2020学年高一上学期期中考试化学试题河南省鹤壁市淇滨高级中学2019-2020学年高一上学期期中考试化学试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第二次月考化学试题2020届高考化学知识点必练——氧化还原反应的规律夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析(基础过关)黑龙江省哈尔滨市第六中学校2021届高三上学期开学考试化学试题天津市南开中学2020届高三第二次月考化学试题吉林省白城市洮南市第一中学2021届高三上学期第一次月考化学试题(已下线)江西省宜丰中学2018_2019学年高一化学上学期期末考试试卷黑龙江省大庆中学2021届高三10月月考化学试题安徽省池州市第一中学2021届高三上学期9月月考化学试题黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题河南省鹤壁高中2021-2022学年高三上学期一轮复习第二次质量检测化学试题
解题方法
3 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
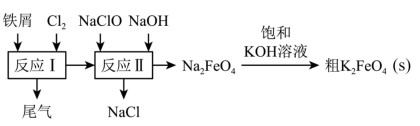
下列叙述不正确的是

下列叙述不正确的是
| A.反应I产生的尾气可通入碱液中吸收 |
| B.反应I生成的FeCl2,在碱性条件下会被NaClO氧化成Na2FeO4 |
| C.反应II中每转移6mol电子会生成166gNa2FeO4 |
| D.Na2FeO4转化成K2FeO4的化学方程式为Na2FeO4+2KOH=K2FeO4↓+2NaOH |
您最近一年使用:0次
名校
4 . 向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1∶6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2016-11-17更新
|
3612次组卷
|
21卷引用:2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷
2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期中考试化学试题湖南省邵东市第一中学2021-2022学年高一下学期第三次月考化学试题2016届辽宁省沈阳市第二中学高三10月月考化学试卷2017届辽宁省瓦房店市高级中学高三上10月月考化学试卷四川省眉山中学2018届高三10月月考理科综合化学试题甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题甘肃省天水市一中2018届高三上学期第三学段考试化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)《2018,我的高考我的教师君》-【临考技能篇】速解高考题——高考化学题型分类技巧指导(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密四川省广安市第二中学2019届高三上学期第一次月考化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)2019年1月16日 《每日一题》高考二轮复习-铁及其化合物浙江省台州市书生中学2021-2022学年高一下学期阶段性测试(3月)化学试题辽宁省实验中学2022-2023学年高三上学期期中考试化学试题江西省宜春市丰城拖船中学2023-2024学年高三上学期11月期中化学试题河南省周口市太康县第一高级中学2023-2024学年高一下学期4月第三次月考化学试题
名校
解题方法
5 . 如图所示的下列物质可用于治疗汞中毒,其中X、W、Y、M、Z是短周期主族元素且原子序数依次增大,Y与Z属于同一主族元素,下列说法错误的是
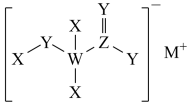
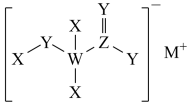
| A.常见离子半径大小:Z>Y>M>X |
| B.M,Z和Y三种元素形成的化合物超过2种 |
| C.最简单氢化物的沸点:Y>W |
| D.该物质中除X以外,其他元素均满足8电子稳定结构 |
您最近一年使用:0次
2021-10-28更新
|
719次组卷
|
7卷引用:湖南省三湘名校教育联盟2021-2022学年高三上学期第一次大联考化学试题
名校
6 . 某小组研究溶液中 与
与 (亚硝酸根)、
(亚硝酸根)、 的反应。
的反应。
资料: 在溶液中呈棕色。
在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用_______ 溶液检出溶液中含有 ,现象是
,现象是_______ 。
②甲认为是 氧化了溶液中的
氧化了溶液中的 .乙对比a、b的实验现象认为
.乙对比a、b的实验现象认为 不是主要原因,理由是
不是主要原因,理由是_______ 。另行设计实验Ⅱ进行验证,确认是酸性条件下 与
与 反应生成了
反应生成了 和NO。写出该反应的离子方程式
和NO。写出该反应的离子方程式_______ 。
(2)研究现象a中的棕色溶液。
提出假设:现象a中溶液变为棕色可能是NO与溶液中的 或
或 发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。
与NO发生了反应。
①实验Ⅲ的操作和现象是_______ 。
②写出该反应的离子方程式_______ 。
(3)研究酸性条件下,溶液中 与
与 、
、 的反应。
的反应。
ⅲ中出现棕色的原因是_______ 。
(4)实验结论:_______ (至少写出两条)
 与
与 (亚硝酸根)、
(亚硝酸根)、 的反应。
的反应。| 实验Ⅰ | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 |   溶液 溶液(  ) ) |   溶液 溶液(  ) ) | a.逐滴加入 溶液至1mL,溶液先变黄,后变为棕色。2小时后,无明显变化 溶液至1mL,溶液先变黄,后变为棕色。2小时后,无明显变化 |
  溶液(加NaOH溶液至 溶液(加NaOH溶液至 ) ) | b.逐滴加入 溶液至1mL,无明显变化。 溶液至1mL,无明显变化。 | ||
 在溶液中呈棕色。
在溶液中呈棕色。(1)研究现象a中的黄色溶液。
①用
 ,现象是
,现象是②甲认为是
 氧化了溶液中的
氧化了溶液中的 .乙对比a、b的实验现象认为
.乙对比a、b的实验现象认为 不是主要原因,理由是
不是主要原因,理由是 与
与 反应生成了
反应生成了 和NO。写出该反应的离子方程式
和NO。写出该反应的离子方程式(2)研究现象a中的棕色溶液。
提出假设:现象a中溶液变为棕色可能是NO与溶液中的
 或
或 发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为
发生了反应。进行实实验Ⅲ,证实溶液呈棕色只是因为 与NO发生了反应。
与NO发生了反应。①实验Ⅲ的操作和现象是
②写出该反应的离子方程式
(3)研究酸性条件下,溶液中
 与
与 、
、 的反应。
的反应。| 序号 | 操作 | 现象 |
| ⅰ | 取 的 的 溶液0.5mL,加醋酸调至体积为1mL,且 溶液0.5mL,加醋酸调至体积为1mL,且 ,再加入 ,再加入  溶液1mL 溶液1mL | 溶液立即变为棕色 |
| ⅱ | 取 的 的 溶液0.5mL,加醋酸调至体积为1mL,且 溶液0.5mL,加醋酸调至体积为1mL,且 ,再加入 ,再加入  溶液1mL 溶液1mL | 无明显变化 |
| ⅲ | 分别取1mL  的 的 溶液与1mL 溶液与1mL  的 的 溶液混合,再加入一滴浓硫酸(混合后溶液 溶液混合,再加入一滴浓硫酸(混合后溶液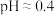 ) ) | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
(4)实验结论:
您最近一年使用:0次
2022-04-04更新
|
688次组卷
|
4卷引用:湖南省五市十校教研教改共同体2021-2022学年高一下学期期末考试化学试题
湖南省五市十校教研教改共同体2021-2022学年高一下学期期末考试化学试题湖南省长沙市实验中学2022-2023学年高二上学期入学考试化学试题北京市一零一中学2021-2022学年高一上学期期末考试化学试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
名校
解题方法
7 . 固体盐X由四种常见元素组成,其中仅含一种金属元素,有如图转化关系:
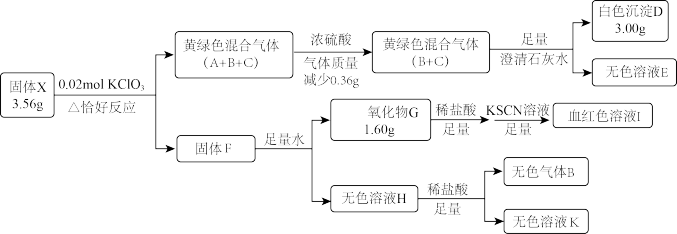
已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为_______ ,固体F成分为_______ 。
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式_______ 。
(3)气体C的化学式为_______ 。将气体C通入KOH溶液,微热,恰好完全反应,生成两种物质的量之比1∶5的盐,写出这两种盐的化学式_______ ,设计定量实验方案验证上述比例关系_______ 。(已知AgClO3溶于水,NaNO2能将ClO3-还原为Cl-)

已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式
(3)气体C的化学式为
您最近一年使用:0次
名校
解题方法
8 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2.某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
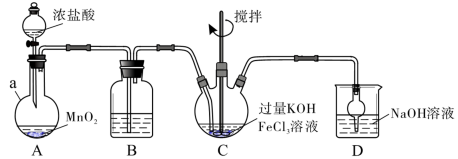
(1)仪器a的名称是___________ ,装置B中除杂质所用试剂是___________ ,装置D的作用是___________ 。
(2)A中发生反应的离子方程式为___________ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为___________ ,反应中KOH必须过量的原因是___________ 。
(4)写出C中总反应的离子方程式:___________ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
(5)根据以上数据,样品中K2FeO4的质量分数为___________ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的离子方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2021-04-07更新
|
757次组卷
|
5卷引用:湖南省长沙市雅礼中学2024届高三上学期月考试卷(一)化学试题
湖南省长沙市雅礼中学2024届高三上学期月考试卷(一)化学试题天津市红桥区2021届高三一模考试化学试题天津市红桥区2020-2021学年高三下学期第一次教学质量调查(一模)化学试题新疆师范大学附属中学2021-2022学年高三9月月考化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)
名校
解题方法
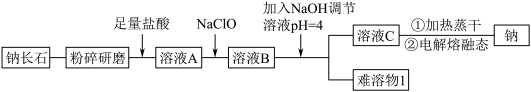
9 . 钠长石是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石富含钠元素,同时还有少量的钙和铁元素,铁元素在矿石中既有+2 价 Fe(II)也有+3 价 Fe(III)。钠长石的化学式为:NaxFe4CaO7,以该矿石为原料制备金属钠的工艺流程如下:
请回答下列问题:
(1)“粉碎研磨”的作用是_______ 。
(2)写出 NaClO 与溶液 A 反应的离子方程式_______ 。下面物质中可以替换 NaClO 的是_______ (填字母)。
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是_______ 。(写化学式)
(4)写出制备金属钠的反应方程式_______ 。
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂_______ (写化学式)除去 Ca2+。
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=_______ 。
| Ca2+ | Fe2+ | Fe3+ | |
| Mn+完全沉淀时的pH | 12.0 | 5.8 | 4.0 |
(1)“粉碎研磨”的作用是
(2)写出 NaClO 与溶液 A 反应的离子方程式
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是
(4)写出制备金属钠的反应方程式
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=
您最近一年使用:0次
2022-12-21更新
|
524次组卷
|
6卷引用:湖南省长沙麓山国际实验学校2023-2024学年高一上学期第二次适应性测试化学试卷
解题方法
10 . 工业上用某矿渣(含有 )提取铜的操作流程如下:
)提取铜的操作流程如下:

已知: 。
。
回答下列问题:
(1)操作I的名称为___________ ;灼烧操作中常用的实验仪器有酒精灯、三脚架,还有___________ (夹持仪器不写)。
(2)固体混合物B的主要成分为___________ (写化学式);滤液A中铁元素的存在形式只能为 ,理由是
,理由是___________ (用离子方程式解释)。检验滤液A中 的试剂为
的试剂为___________ (填试剂名称)。
(3)滤液C中铝元素的主要存在形式为___________ (填离子符号),写出生成该离子的离子方程式:___________ 。
(4)某同学认为滤液 的水解程度是微弱的,
的水解程度是微弱的, 的水解不超过总量的10%,请设计实验验证该同学的观点是否正确:
的水解不超过总量的10%,请设计实验验证该同学的观点是否正确:___________ (所用材料: 试纸、
试纸、 的
的 溶液)。
溶液)。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,主要步骤:称取一定质量的样品→___________ (填缺少的操作步骤,不必描述操作过程的细节)→过滤、洗涤、干燥→称量剩余固体铜的质量。
 )提取铜的操作流程如下:
)提取铜的操作流程如下:
已知:
 。
。回答下列问题:
(1)操作I的名称为
(2)固体混合物B的主要成分为
 ,理由是
,理由是 的试剂为
的试剂为(3)滤液C中铝元素的主要存在形式为
(4)某同学认为滤液
 的水解程度是微弱的,
的水解程度是微弱的, 的水解不超过总量的10%,请设计实验验证该同学的观点是否正确:
的水解不超过总量的10%,请设计实验验证该同学的观点是否正确: 试纸、
试纸、 的
的 溶液)。
溶液)。(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,主要步骤:称取一定质量的样品→
您最近一年使用:0次
2022-10-13更新
|
281次组卷
|
2卷引用:湖南省邵阳市部分校2022-2023学年高三上学期第一次联考化学试题



