名校
解题方法
1 . BTCu是荧光增强型Cu2+荧光分子探针,可对环境和生物体内的微量Cu2+进行有效检测。BTCu识别Cu2+机理如下图:

回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有___________ mol,B原子的杂化轨道类型是___________ 。
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有___________ 个。
②该晶体的化学式是___________ 。
③该晶体的密度是___________ g/cm3 (列出计算式)。

回答下列问题:
(1)基态Cu原子的价电子排布式为
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有
②该晶体的化学式是
③该晶体的密度是
您最近一年使用:0次
名校
解题方法
2 . 下列分子的空间结构是平面三角形的是
| A.CO2 | B.BF3 | C.NH3 | D.SO2 |
您最近一年使用:0次
名校
3 . 研究弱电解质的电离,有重要的实际意义。
I.醋酸是一种常见的有机酸
(1)醋酸的电离方程式为___________ 。
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
(3)将0.1mol·L-1CH3COOH溶液中加水稀释,c(CH3COO-)/c(CH3COOH)的比值将_______ (填“变大”、“不变”或“变小”),溶液导电性_______ (填“变大”、“不变”或“变小”)。
(4)弱电解质达电离平衡说法正确的是___________(填字母)。
II.对比酸性的相对强弱
(5)某些弱酸在25℃时的电离常数如下:
①下列反应可以发生的是_______ (填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL1mol·L-1CH3COOH溶液和20mL1mol·L-1HSCN溶液分别与20mL1mol·L-1NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式_______ 。

I.醋酸是一种常见的有机酸
(1)醋酸的电离方程式为
(2)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
| A.c(CH3COO-) | B.c(H+) |
| C.c(OH-) | D.CH3COOH电离平衡常数 |
(3)将0.1mol·L-1CH3COOH溶液中加水稀释,c(CH3COO-)/c(CH3COOH)的比值将
(4)弱电解质达电离平衡说法正确的是___________(填字母)。
| A.分子和离子的浓度均不再发生变化,所以说电离平衡是静态平衡 |
| B.电解质达到电离平衡后,各离子浓度均相等 |
| C.电离平衡是相对的、暂时的,外界条件改变时平衡可能发生移动 |
| D.弱电解质分子电离产生离子与离子结合生成弱电解质分子速率相等 |
II.对比酸性的相对强弱
(5)某些弱酸在25℃时的电离常数如下:
| 化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
| 电离常数 | 1.8×10-5 | 1.3×10-1 | 4.9×10-10 | 3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL1mol·L-1CH3COOH溶液和20mL1mol·L-1HSCN溶液分别与20mL1mol·L-1NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式

您最近一年使用:0次
名校
解题方法
4 . 合成氨是人类科技发展史上的一项重大突破。已知:在一定条件下,N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
(1)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为___________ mol/(L·min)。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
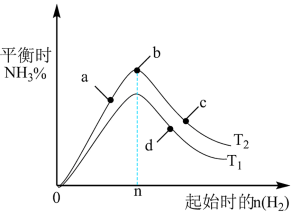
①图象中T2和T1的关系是:T2___________ T1(填“>,<或=”)。
②其他条件不变时,温度升高氨的平衡含量改变的原因是___________ (填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
③a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________ (填字母)
(3)下图是某压强下,密闭容器中,N2和H2按物质的量浓度分别1mol/L和3mol/L投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线。

①图中a点,容器内n(N2)∶n(NH3)=___________ 。
②此条件下该反应的化学平衡常数K=___________ 。(用分数表示)
③图中b点,υ正______ υ逆(填“>”、“<”或“=”)。
 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1(1)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2
②其他条件不变时,温度升高氨的平衡含量改变的原因是
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
③a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(3)下图是某压强下,密闭容器中,N2和H2按物质的量浓度分别1mol/L和3mol/L投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线。

①图中a点,容器内n(N2)∶n(NH3)=
②此条件下该反应的化学平衡常数K=
③图中b点,υ正
您最近一年使用:0次
名校
5 . 一定温度下,在三个1L的恒容密闭容器中分别进行反应:2X(g)+Y(g) Z(g),达到化学平衡状态时,相关数据如下表,下列说法不正确的是
Z(g),达到化学平衡状态时,相关数据如下表,下列说法不正确的是
 Z(g),达到化学平衡状态时,相关数据如下表,下列说法不正确的是
Z(g),达到化学平衡状态时,相关数据如下表,下列说法不正确的是| 实验 | 温度/K | 起始时各物质的浓度/(mol/L) | 平衡时浓度/(mol/L) | ||
| c(X) | c(Y) | c(Z) | c(Z) | ||
| I | 400 | 0.2 | 0.1 | 0 | 0.08 |
| Ⅱ | 400 | 0.4 | 0.2 | 0.2 | a |
| Ⅲ | 500 | 0.2 | 0.1 | 0 | 0.025 |
| A.达到化学平衡时,Ⅱ中X的转化率大于80% |
| B.化学平衡常数:K(Ⅱ)=K(Ⅰ) |
| C.达到化学平衡所需要的时间:IⅢ<I |
| D.按Ⅱ中的起始浓度进行实验,反应逆向进行 |
您最近一年使用:0次
名校
6 . 关于相同体积、相同c(H+)的盐酸和醋酸溶液及其相关实验的说法,正确的是
| A.盐酸和醋酸溶液物质的量浓度相等 |
| B.用等浓度的NaOH溶液中和两种溶液至中性时:所需体积相同 |
| C.均加水冲稀10倍后:盐酸的c(H+)小于醋酸溶液的c(H+) |
| D.均加入足量镁粉,反应完成后产生H2的物质的量:盐酸大于醋酸溶液 |
您最近一年使用:0次
7 . 下列依据热化学方程式得出的结论正确的是
| A.已知C(s)+O2(g)=CO(g) ∆H=-akJmol-1,则1molC(s)完全燃烧放出的热大于akJ·mol-1 |
| B.已知SO2(g)+2H2S(g)=3S(s)+2H2O(l)常温下自发进行,则可推知一定∆H>0 |
| C.已知2H2(g)+O2(g)=2H2O(g) ∆H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ·mol-1 |
| D.已知C(石墨,s)=C(金刚石,s) ∆H>0,则金刚石比石墨稳定 |
您最近一年使用:0次
名校
8 . 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有若重要作用。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。
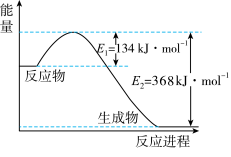
①该反应是___________ (填“吸热”或“放热”)反应。
②请写出反应的热化学方程式___________ 。
③若在反应体系中加入催化剂能使反应热___________ 。(填“增大”、“不变”或"减小")
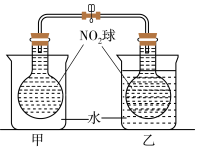
(2)已知,可逆反应2NO2(g) N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会______ (填“变深”、“不变”或“变浅”),能量发生这种变化的原因是______ 。
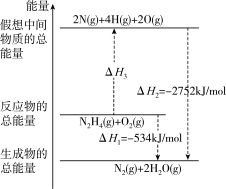
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是___________ kJ。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。

①该反应是
②请写出反应的热化学方程式
③若在反应体系中加入催化剂能使反应热
(2)已知,可逆反应2NO2(g)
 N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是

您最近一年使用:0次
名校
9 . 按下图进行实验,探究H2O2的分解反应。下列说法不正确的是
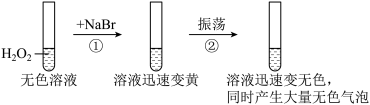

| A.1molH2O2发生分解反应时,转移电子的物质的量是2mol |
| B.NaBr中的Br-加快了H2O2分解速率 |
| C.双氧水既发生氧化反应,又反应了还原反应 |
| D.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑ |
您最近一年使用:0次
名校
10 . 某实验小组同学依据资料深入探究Fe³+在水溶液中的行为。
资料:i.Fe³+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6] 3+发生如下水解反应:[Fe(H2O)6]3+(几乎无色)+nH2O [Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
[Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
ii.[FeCl4(H2O)2]-为黄色。
进行实验:【实验I】

【实验Ⅱ】分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。
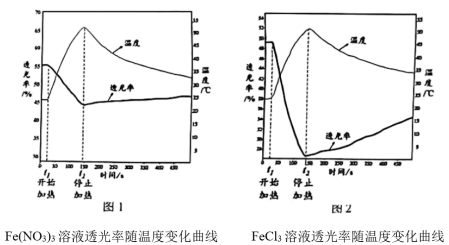
(1)实验1中,试管②溶液变为无色的原因是___________ 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是___________ 。
(3)由实验Ⅱ图1、2可知:加热时,溶液颜色___________ (填“变浅"、“变深”或“不变”)。
(4)由实验Ⅱ,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O=[Fe(H2O)6]³++4Cl-得出此结论的理由是___________ 。
[结论二]结论一中反应的△H___________ (填“>0”或"<0")。
资料:i.Fe³+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6] 3+发生如下水解反应:[Fe(H2O)6]3+(几乎无色)+nH2O
 [Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
[Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。ii.[FeCl4(H2O)2]-为黄色。
进行实验:【实验I】

【实验Ⅱ】分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

(1)实验1中,试管②溶液变为无色的原因是
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是
(3)由实验Ⅱ图1、2可知:加热时,溶液颜色
(4)由实验Ⅱ,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O=[Fe(H2O)6]³++4Cl-得出此结论的理由是
[结论二]结论一中反应的△H
您最近一年使用:0次



