解题方法
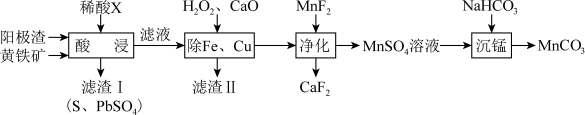
1 . 电解制锰的阳极渣主要成分是 ,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿
,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知常温下,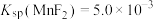 ,
, 。
。
(1)加快“酸浸”速率的措施有___________ (填两条)。稀酸X为___________ (填名称)。“酸浸”时 中的铁元素转化为
中的铁元素转化为 ,则该反应中氧化剂与还原剂的物质的量之比为
,则该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)滤渣Ⅱ的主要成分为 、
、 、
、___________ (填化学式)。
(3)加入 时发生反应的离子方程式为
时发生反应的离子方程式为___________ 。如果“净化”所得溶液中 的浓度为
的浓度为 ,则溶液中
,则溶液中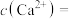
___________  。
。
(4) 溶液中的元素守恒式为
溶液中的元素守恒式为___________ 。加入 溶液进行“沉锰”,写出该反应的离子方程式:
溶液进行“沉锰”,写出该反应的离子方程式:___________ 。
 ,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿
,还含有少量PbO、CuO及铁的氧化物,以阳极渣和黄铁矿 为原料可制备
为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知常温下,
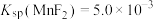 ,
, 。
。(1)加快“酸浸”速率的措施有
 中的铁元素转化为
中的铁元素转化为 ,则该反应中氧化剂与还原剂的物质的量之比为
,则该反应中氧化剂与还原剂的物质的量之比为(2)滤渣Ⅱ的主要成分为
 、
、 、
、(3)加入
 时发生反应的离子方程式为
时发生反应的离子方程式为 的浓度为
的浓度为 ,则溶液中
,则溶液中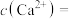
 。
。(4)
 溶液中的元素守恒式为
溶液中的元素守恒式为 溶液进行“沉锰”,写出该反应的离子方程式:
溶液进行“沉锰”,写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 用化学用语表示反应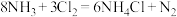 中的相关微粒,其中正确的是
中的相关微粒,其中正确的是
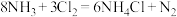 中的相关微粒,其中正确的是
中的相关微粒,其中正确的是A. 的结构式: 的结构式: | B. 的空间填充模型: 的空间填充模型: |
C. 的电子式: 的电子式: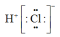 | D. 的结构示意图: 的结构示意图: |
您最近一年使用:0次
2024-03-07更新
|
94次组卷
|
2卷引用:河南省新高中创新联盟/TOP 二十名校计划2023-2024学年高三上学期11月月考化学试题
名校
解题方法
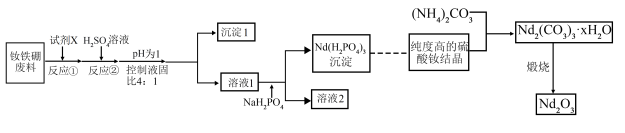
3 . 钕铁硼磁铁因其超强的磁性被誉为“永磁之王”。工业上从废旧钕铁硼合金废料(含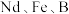 等)中回收、制取氧化钕的流程如图所示:
等)中回收、制取氧化钕的流程如图所示:
已知:① 稳定的化合价为
稳定的化合价为 ;金属钕的活动性较强,能与酸发生置换反应。
;金属钕的活动性较强,能与酸发生置换反应。
②硼不与稀硫酸反应。
③常温下, 。
。
回答下列问题:
(1)反应①的目的是去除废料表面的油脂和污渍,可选用下列中的___________(填标号)作试剂X。
(2)沉淀1的主要成分是___________ (填化学式)。
(3)向溶液1中加入 进行“沉钕”,写出该反应的离子方程式
进行“沉钕”,写出该反应的离子方程式___________ ;已知溶液1中 ,常温下,“沉钕”过程中,控制
,常温下,“沉钕”过程中,控制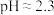 ,使
,使 沉淀完全,通过计算说明是否有
沉淀完全,通过计算说明是否有 沉淀生成
沉淀生成___________ (填“有”或“无”)。
(4)判断 已洗涤干净的实验操作及现象是
已洗涤干净的实验操作及现象是___________ 。
(5)写出煅烧生成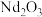 的化学方程式:
的化学方程式:___________ 。
(6)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷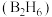 、丁硼烷
、丁硼烷 、己硼烷
、己硼烷 等。
等。
①硼、氮、氧元素的第一电离能由大到小的顺序是___________ 。
②乙硼烷的结构式为 ,分子中B原子通过氢桥键(
,分子中B原子通过氢桥键(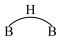 )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式___________ 。
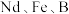 等)中回收、制取氧化钕的流程如图所示:
等)中回收、制取氧化钕的流程如图所示:
已知:①
 稳定的化合价为
稳定的化合价为 ;金属钕的活动性较强,能与酸发生置换反应。
;金属钕的活动性较强,能与酸发生置换反应。②硼不与稀硫酸反应。
③常温下,
 。
。回答下列问题:
(1)反应①的目的是去除废料表面的油脂和污渍,可选用下列中的___________(填标号)作试剂X。
| A.酒精 | B. 溶液 溶液 | C.纯碱溶液 | D.稀硝酸 |
(2)沉淀1的主要成分是
(3)向溶液1中加入
 进行“沉钕”,写出该反应的离子方程式
进行“沉钕”,写出该反应的离子方程式 ,常温下,“沉钕”过程中,控制
,常温下,“沉钕”过程中,控制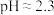 ,使
,使 沉淀完全,通过计算说明是否有
沉淀完全,通过计算说明是否有 沉淀生成
沉淀生成(4)判断
 已洗涤干净的实验操作及现象是
已洗涤干净的实验操作及现象是(5)写出煅烧生成
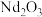 的化学方程式:
的化学方程式:(6)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷
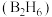 、丁硼烷
、丁硼烷 、己硼烷
、己硼烷 等。
等。①硼、氮、氧元素的第一电离能由大到小的顺序是
②乙硼烷的结构式为
 ,分子中B原子通过氢桥键(
,分子中B原子通过氢桥键( )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式
您最近一年使用:0次
21-22高一·全国·课后作业
名校
4 . 如图为实验室某浓盐酸试剂瓶标签上的部分数据,试根据标签.上的相关数据回答下列问题:.
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:______ ;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:______ 。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是______ 。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-02-22更新
|
86次组卷
|
7卷引用:河南省濮阳市第一高级中学2022-2023学年高一上学期期中质量检测化学试题
名校
解题方法
5 . 蔗糖与浓硫酸发生作用的过程如下图所示。

| A.过程①白色固体变黑,主要体现了浓硫酸的脱水性 |
| B.过程②固体体积膨胀,与产生的大量气体有关 |
| C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性 |
D.过程中发生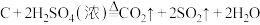 的反应 的反应 |
您最近一年使用:0次
2024-02-19更新
|
694次组卷
|
4卷引用:河南省南阳市邓州市第六高级中学校2023-2024学年高二下学期开学测试化学试题
名校
解题方法
6 . 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的选项是
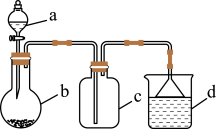
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 |  |  |  |
| B | 70%浓硫酸 |  |  |  溶液 溶液 |
| C | 稀硝酸 |  |  |  |
| D | 浓盐酸 |  |  |  溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-14更新
|
539次组卷
|
7卷引用:河南省南阳市邓州市第一高级中学校2023-2024学年高一上学期期末考试化学试题
7 . 已知:不同量氯气氧化 可能生成
可能生成 、
、 、
、 、
、 。现有编号a、b、c、d的4支试管分别装有
。现有编号a、b、c、d的4支试管分别装有 溶液,分别通入不同量的氯气使每支试管中恰好完全反应且只有一种氧化产物。实验测得结果如图所示。下列叙述错误的是
溶液,分别通入不同量的氯气使每支试管中恰好完全反应且只有一种氧化产物。实验测得结果如图所示。下列叙述错误的是
 可能生成
可能生成 、
、 、
、 、
、 。现有编号a、b、c、d的4支试管分别装有
。现有编号a、b、c、d的4支试管分别装有 溶液,分别通入不同量的氯气使每支试管中恰好完全反应且只有一种氧化产物。实验测得结果如图所示。下列叙述错误的是
溶液,分别通入不同量的氯气使每支试管中恰好完全反应且只有一种氧化产物。实验测得结果如图所示。下列叙述错误的是
| A.a试管中滴加淀粉溶液,溶液变蓝色 |
B.b试管中氧化产物为 |
C.当 为2.5mol时 为2.5mol时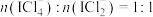 |
D.d试管中总反应的离子反应方程式为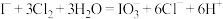 |
您最近一年使用:0次
2024-02-14更新
|
27次组卷
|
2卷引用:河南省南阳市镇平县第一高级中学2023-2024学年高一上学期1月期末化学试题
名校
8 . 为检测某品牌银耳中添加剂亚硫酸盐的含量,取 银耳样品和
银耳样品和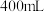 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了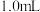 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是
 银耳样品和
银耳样品和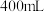 蒸馏水放入三颈瓶中;取
蒸馏水放入三颈瓶中;取 碘标准溶液和
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用
淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了
碘标准溶液滴定,至终点时滴定消耗了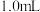 碘标准液。另做空白实验,消耗
碘标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
碘标准溶液。下列说法正确的是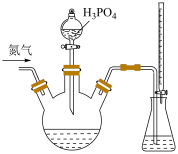
A.选择的三颈瓶规格为 |
| B.滴定终点溶液变为蓝色,读数时应双手上下持滴定管 |
| C.“不通氮气”或者“先加磷酸再通氮气”,这两种做法都会使测定结果偏高 |
D.银耳样品中亚硫酸盐的百分含量(以 质量计)为 质量计)为 |
您最近一年使用:0次
2024-02-06更新
|
372次组卷
|
5卷引用:2024届河南省许昌高级中学高三下学期三模化学试题
9 . 丁香酚存在于丁香花的花荵中,以丁香酚为原料制取有机物 的路线如下:
的路线如下:
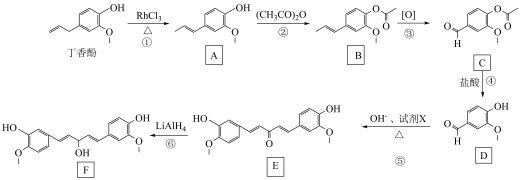
已知: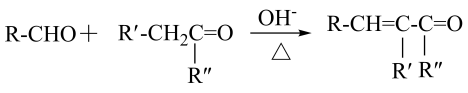
(1)丁香酚的分子式为_______ ,丁香酚分子中碳原子的杂化类型为_______ 。
(2) 中的含氧官能团是
中的含氧官能团是_______ (填名称),⑥的反应类型为_______ 。
(3)写出满足下列条件的 的所有同分异构体的结构简式
的所有同分异构体的结构简式_______ 。
①含苯环且环上只有两个取代基
②属于酯类化合物
③核磁共振氢谱有3组峰,且峰面积之比为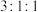
(4)反应⑤的方程式中 与
与 的系数比为
的系数比为 ,试剂
,试剂 的结构简式为
的结构简式为_______ 。 分子中共平面的原子数最多有
分子中共平面的原子数最多有_______ 个。
(5)设计用呋喃甲醛(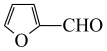 )和环己醇为原料
)和环己醇为原料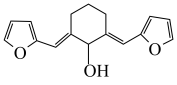 的合成路线
的合成路线_______ (无机试剂任选)。
 的路线如下:
的路线如下:
已知:
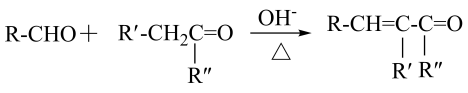
(1)丁香酚的分子式为
(2)
 中的含氧官能团是
中的含氧官能团是(3)写出满足下列条件的
 的所有同分异构体的结构简式
的所有同分异构体的结构简式①含苯环且环上只有两个取代基
②属于酯类化合物
③核磁共振氢谱有3组峰,且峰面积之比为
(4)反应⑤的方程式中
 与
与 的系数比为
的系数比为 ,试剂
,试剂 的结构简式为
的结构简式为 分子中共平面的原子数最多有
分子中共平面的原子数最多有(5)设计用呋喃甲醛(
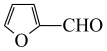 )和环己醇为原料
)和环己醇为原料 的合成路线
的合成路线
您最近一年使用:0次
名校
解题方法
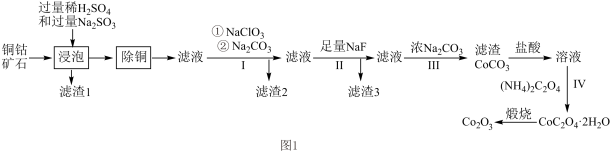
10 . 三氧化二钴( )在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为
)在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为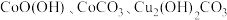 和
和 ,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴(
,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴( )的工艺流程如图1所示。
)的工艺流程如图1所示。
已知:常温下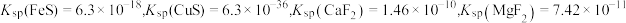 。
。
回答下列问题:
(1)CoO(OH)中Co的化合价为___________ ;“浸泡”过程中CoO(OH)与 反应的离子方程式为
反应的离子方程式为___________ 。
(2)“浸泡”过程中浸出温度和浸出pH对浸出率的影响分别如图2、图3所示。
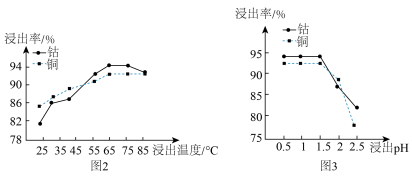
①矿石粉末“浸泡”的适宜条件应是___________ 。
②图3中铜、钴浸出率下降的可能原因是___________ 。
(3)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”反应的离子方程式_______ 。
(4)向“除铜”后的滤液中加入 的主要目的是
的主要目的是___________ 。过程Ⅲ中加入浓 得到滤渣后又加入盐酸溶解,其目的是
得到滤渣后又加入盐酸溶解,其目的是___________ 。
(5)在过程Ⅱ中加入足量的NaF可将 以沉淀形式除去,若所得滤液中
以沉淀形式除去,若所得滤液中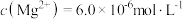 ,则滤液中
,则滤液中 为
为___________ (保留2位有效数字)。
 )在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为
)在工业、电子等领域都有着广阔的应用前景。以铜钴矿石[主要成分为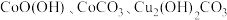 和
和 ,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴(
,还有少量铁、镁、钙的氧化物]为原料制备三氧化二钴( )的工艺流程如图1所示。
)的工艺流程如图1所示。
已知:常温下
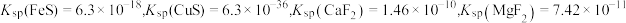 。
。回答下列问题:
(1)CoO(OH)中Co的化合价为
 反应的离子方程式为
反应的离子方程式为(2)“浸泡”过程中浸出温度和浸出pH对浸出率的影响分别如图2、图3所示。

①矿石粉末“浸泡”的适宜条件应是
②图3中铜、钴浸出率下降的可能原因是
(3)“除铜”过程中,加入FeS固体得到更难溶的CuS,写出“除铜”反应的离子方程式
(4)向“除铜”后的滤液中加入
 的主要目的是
的主要目的是 得到滤渣后又加入盐酸溶解,其目的是
得到滤渣后又加入盐酸溶解,其目的是(5)在过程Ⅱ中加入足量的NaF可将
 以沉淀形式除去,若所得滤液中
以沉淀形式除去,若所得滤液中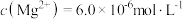 ,则滤液中
,则滤液中 为
为
您最近一年使用:0次



