13-14高三下·山东青岛·阶段练习
名校
解题方法
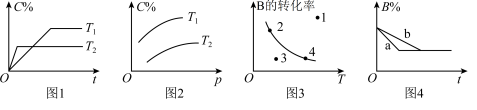
1 . 反应mA(g)+nB(g) pC(g)的速率和平衡图像如下,下列判断正确的是
pC(g)的速率和平衡图像如下,下列判断正确的是
 pC(g)的速率和平衡图像如下,下列判断正确的是
pC(g)的速率和平衡图像如下,下列判断正确的是
| A.图1中,T1<T2,该反应正反应为吸热反应 |
| B.图3中,表示反应速率v正>v逆的是点3 |
| C.图2中,该反应m+n<p |
| D.图4中,若m+n=p,则a曲线一定使用了催化剂 |
您最近一年使用:0次
2024-01-11更新
|
162次组卷
|
97卷引用:重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题
重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题2015-2016学年安徽省六安一中高二上第一阶段测化学试卷2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷2015-2016学年辽宁庄河高中高二下期末化学试卷2016-2017学年陕西西安中学高二平行班上期中化学卷江西省宜春市上高二中2017-2018学年高二第一次月考化学试题云南省玉溪市玉溪一中2017-2018学年高二上学期第二次月考化学试题河南省滑县第二高级中学2017-2018学年高二12月月考化学试题河南省中原名校(即豫南九校)2017-2018学年高二上学期第三次联考化学试题宁夏银川一中2017-2018学年高二上学期期末考试化学试题辽宁省大连市普兰店区第二中学2017-2018学年高二上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高二化学上学期期末考试试题【校级联考】江西省南昌市八一中学、洪都中学七校2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南第一中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 期末学业测评(二)【全国百强校】四川省雅安市雅安中学2018-2019学年高二上学期期中考试化学试题辽宁省大连市第一〇三中学2018-2019学年高二上学期期中考试化学试题江西省奉新县第一中学2019-2020学年高二上学期第一次月考化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题福建省福建师范大学附属中学2019-2020学年高二上学期期中考试化学(选考)试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题新疆昌吉市教育共同体2019-2020学年高二年级上学期期末考试化学试题甘肃省张掖市2019—2020学年高二上学期期末学业水平质量检测化学试题河北省保定市2019-2020学年高二下学期期中考试化学试题江西省宜春市樟树市滨江中学2018-2019学年高二上学期第一次月考化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期开学考试化学试题江西省赣州市赣县区第三中学2020-2021学年高二上学期强化训练(一)化学试题云南省昆明师范专科学校附属中学2020-2021学年高二上学期期中考试化学试题广东省广州市广东实验中学2020-2021学年高二上学期月考化学试题福建省永安市第一中学2020-2021学年高二上学期期中考试化学试题江西省靖安中学2020-2021学年高二上学期第一次月考化学试题四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期期中考试化学试题陕西省泾阳县2020-2021学年高二上学期期中考试化学试题山东省济南市历城第一中学2021-2022学年高二上学期10月月考化学试题吉林省长春市希望高中2021-2022学年高二上学期期中考试化学试题吉林省长春市十一高中2021-2022学年高二上学期期中考试化学试题新疆昌吉州2021-2022学年高二上学期期末考试化学试题河北省盐山中学2021-2022学年高二12月月考化学试题安徽省亳州市第一中学2021-2022学年高二上学期第二次月考化学试题甘肃省永昌县第一高级中学2021-2022学年高二上学期期末考试化学试题江西省山江湖协作体2021-2022学年高二上学期联考(统招班)化学试题陕西省西安市西航一中2021-2022学年高二上学期期末考试化学试题浙江省杭州市浙江大学附属中学2021-2022学年高二上学期期末考试化学试题天津市汇文中学2022-2023学年高二上学期第二次阶段性测试化学试题广东省珠海市斗门区第一中学2022-2023学年高二上学期第一次考试化学试题山东省青岛第二中学2022-2023学年高二上学期10月月考化学试题广东省江门市新会华侨中学2022-2023学年高二上学期期中考试化学试题四川省成都外国语学校2022-2023学年高二上学期期中考试化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题广东省珠海市斗门第一中学2022-2023学年高二上学期期中考试化学试题广东省梅州市兴宁市沐彬中学2022-2023学年高二上学期第二次月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题广东省深圳市第七高级中学2021-2022学年高二上学期期中考试化学试题内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题河北省唐山市开滦第一中学2022-2023学年高二上学期期末考试化学试题甘肃天祝藏族自治县第一中学2022-2023学年高二上学期1月期末考试化学试题广东省大湾区2022-2023学年高二上学期期末联考化学试题四川省内江市第六中学2022-2023学年高二下学期入学考试化学试题 湖北省十堰市部分重点中学2022-2023学年高二下学期3月联考化学试题新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题四川省双流中学2023-2024学年高二上学期10月月考化学试题贵州省龙里中学2022-2023学年高二上学期11月期中考试化学试题广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题山东省青岛第三中学2023-2024学年高二上学期期中考试化学试卷广东省广州市第八十九中学2023-2024学年高二上学期10月月考化学试题四川省仪陇中学校2023-2024学年高二上学期10月月考化学试题四川省成都列五中学2023-2024学年高二上学期10月月考化学试题北京市第一七一中学2022-2023学年高二上学期期中考试化学试题云南省昭通市盐津县第二中学2023-2024学年高二上学期期末考试化学试题(已下线)广西“贵百河”2023-2024学年高二上学期12月份联考化学试题山东省泰安市2023-2024学年高二上学期第四次调研测试化学试题山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题(已下线)2014届山东省青岛市高三3月统一质量检测理综化学试卷2016届辽宁省五校协作体高三上学期期初考试化学试卷2015-2016学年黑龙江大庆市铁人中学高一下期中化学试卷2017届辽宁省铁岭市协作体高三第三次联考化学试卷【全国百强校】福建省三明市第一中学2019届高三上学期第二次月考化学试题2019年秋高三化学复习强化练习—— 化学反应速率及化学平衡夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)山东省滕州市第一中学2019-2020学年高一下学期第一次月考化学试题山东省潍坊市安丘市实验中学2019-2020学年高一下学期期中考试化学试题河北省承德市第一中学2019-2020学年高一下学期第4次周测化学试题河北省石家庄市第二中学2019-2020学年高一7月期末考试百分练习化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)吉林省东北师范大学附属中学2020届高三上学期第二次模拟考试化学试题(已下线)第七单元 化学反应速率与化学平衡(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)江西省丰城中学 2021-2022 学年高三上学期第四次段考化学试题(尖子重点班)福建省南平高级中学2021-2022学年高三上学期12月月考化学试题吉林省吉林市第一中学2021-2022学年高一下学期(平行班)期中考试化学试题河南郑州外国语学校2022-2023学年高三上学期调研考试2化学试题吉林省四平市第一高级中学2022-2023学年高三上学期第三次月考化学试题(已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像河南省郑州外国语学校2022-2023学年高三上学期12月月考化学试题
名校
2 . I.甲醇气相脱水制甲醚(CH3OCH3)的反应可表示为: 2 CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
(2)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如下表:
① 10~30 min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
② CH3OH(g)的平衡转化率为_______ 。
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)。
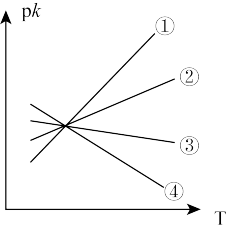
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线_______ 。
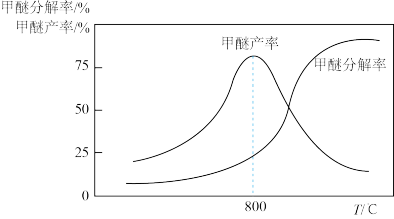
(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为_______ 。
II.在容积可变的密闭容器中发生反应:mA(g)+nB(g) pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
(5)当压强从2×105增加到时5×105,平衡_______ 移动。(填“正向”、“逆向”或“不”)
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =_______ 。
 CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。
CH3OCH3(g) + H2O(g) ΔH=-25 kJ/mol。(1)一定温度下,在恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,能判断反应达到化学平衡状态的是_______。
| A.CH3OCH3(g)和H2O(g)的浓度比保持不变 | B.v正(CH3OH)=2v逆(CH3OCH3) |
| C.容器内压强不再变化 | D.混合气体的平均相对分子质量不再变化 |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
② CH3OH(g)的平衡转化率为
③ 200 ℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.64 | 0.68 | 0.68 |
(3)若其正、逆反应速率分别可表示为v正=k正c2(CH3OH)、v逆=k逆c (CH3OCH3)·c (H2O),k正、k逆 分别为正、逆反应速率常数,只与温度有关。则如图(pk=-lgk)所示①、②、③、④四条斜线中,能表示pk正随温度T变化关系的是斜线

(4)已知:甲醚在一定条件下可分解为CO和H2,甲醚分解率、甲醇脱水制甲醚产率随温度变化关系如下图所示,试解释800 ℃之后甲醇脱水制甲醚产率降低的主要原因为

II.在容积可变的密闭容器中发生反应:mA(g)+nB(g)
 pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/(mol/L) | 0.08 | 0.20 | 0.44 |
(6)当压强为1×106时,写出此时反应的平衡常数表达式:K =
您最近一年使用:0次
名校
解题方法
3 . I. 一定条件下,在容积为 5 L的密闭容器中,A、B、C三种气体的物质的量随时间的变化如图甲所示。已知达到平衡后,降低温度,A的体积分数减小。
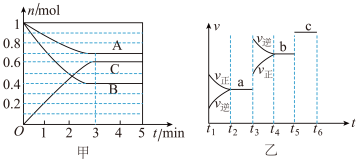
(1)该反应的化学方程式为_______ 。
(2)该反应的反应速率v随时间t的关系如图乙所示。
① 根据图乙判断,在t3时刻改变的外界条件是_______ 。
② a、b、c对应的平衡状态中,c的体积分数最大的是_______ 。
③ 各阶段的平衡常数如下表所示:
K1、K2、K3之间的大小关系为_______ 。
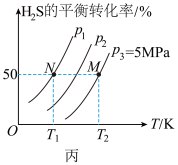
II.在密闭容器中充入一定量的H2S,发生反应: 2H2S(g) 2H2(g)+ S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+ S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
(3)ΔH_______ (填“>”、“<”“=”)0。
(4)图丙中压强(p1、p2、p3)的大小顺序为_______ ,理由为_______ 。
(5)图丙中M 点对应的平衡常数Kp =_______ MPa(用平衡分压代替平衡浓度计算, 分压=总压×物质的量分数)。
(6)恒温恒压下,再次充入H2S,H2S的平衡转化率将_______ (填“增大”、“减小”、“不变”)。


(1)该反应的化学方程式为
(2)该反应的反应速率v随时间t的关系如图乙所示。
① 根据图乙判断,在t3时刻改变的外界条件是
② a、b、c对应的平衡状态中,c的体积分数最大的是
③ 各阶段的平衡常数如下表所示:
| t2~t3 | t3~t4 | t4~t5 |
| K1 | K2 | K3 |
II.在密闭容器中充入一定量的H2S,发生反应: 2H2S(g)
 2H2(g)+ S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+ S2(g) ΔH,如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。(3)ΔH
(4)图丙中压强(p1、p2、p3)的大小顺序为
(5)图丙中M 点对应的平衡常数Kp =
(6)恒温恒压下,再次充入H2S,H2S的平衡转化率将
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)室温下,2 mol H2完全燃烧生成液态水放出a kJ的能量,写出氢气燃烧热的热化学方程式:_______ 。
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO和H2)在催化剂作用下合成甲醇。其常见合成方法为:CO(g)+2H2(g)=CH3OH(g) ΔH,已知反应①中相关的化学键键能数据如下:
由此计算ΔH =_______ kJ/mol;
(3)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol。
现有H2与CH4的混合气体112 L (标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8 kJ,则原混合气体中H2与CH4的物质的量之比是_______ 。
(4)一定条件下,在水溶液中所含离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
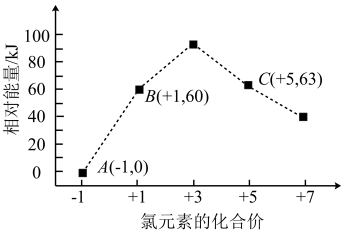
则反应3ClO-(aq) =ClO (aq)+2Cl-(aq)的ΔH=
(aq)+2Cl-(aq)的ΔH=_______ kJ/mol。
(5)乙烷在一定条件可发生反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
ΔH=_______ kJ/mol。
(6)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ/mol
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ/mol
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为_______ 。
(7)在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+ O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
2S(g)=S2(g) ΔH4,则ΔH4的正确表达式为_______ 。
(1)室温下,2 mol H2完全燃烧生成液态水放出a kJ的能量,写出氢气燃烧热的热化学方程式:
(2)甲醇是重要的化工原料,利用合成气(主要成分为CO和H2)在催化剂作用下合成甲醇。其常见合成方法为:CO(g)+2H2(g)=CH3OH(g) ΔH,已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E /(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
(3)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol。
现有H2与CH4的混合气体112 L (标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8 kJ,则原混合气体中H2与CH4的物质的量之比是
(4)一定条件下,在水溶液中所含离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
各1 mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),
则反应3ClO-(aq) =ClO
 (aq)+2Cl-(aq)的ΔH=
(aq)+2Cl-(aq)的ΔH=(5)乙烷在一定条件可发生反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH/(kJ/mol ) | -1560 | -1411 | -286 |
(6)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ/mol
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ/mol
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
(7)在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+
 O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1②2H2S(g)+SO2(g)=
 S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2③H2S(g)+
 O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH32S(g)=S2(g) ΔH4,则ΔH4的正确表达式为
您最近一年使用:0次
名校
5 . I.中和热的测定:测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)仪器a的名称为_______ ,实验中还需要用到的玻璃仪器是_______ 。
(2)取50 mL0.50 mol/L NaOH溶液和30 mL0.50 mol/L稀硫酸进行实验,实验数据如表。
①请填写表中的空白:
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L稀硫酸的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=_______ kJ/mol(保留小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因不可能是_______ (填字母序号)。
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
d.用量筒量取NaOH溶液的体积时仰视读数
II.某同学探究影响硫代硫酸钠溶液与稀硫酸反应速率的因素时,设计如下系列实验:
(3)写出硫代硫酸钠与稀硫酸反应的化学方程式:_______ 。
(4)该实验①、②可探究_______ 对反应速率的影响,因此V1=_______ ;实验①、③可探究_______ 对反应速率的影响,因此V2=_______ 。

(1)仪器a的名称为
(2)取50 mL0.50 mol/L NaOH溶液和30 mL0.50 mol/L稀硫酸进行实验,实验数据如表。
①请填写表中的空白:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| 稀硫酸 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因不可能是
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
d.用量筒量取NaOH溶液的体积时仰视读数
II.某同学探究影响硫代硫酸钠溶液与稀硫酸反应速率的因素时,设计如下系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | 10.0 | 0.10 | 10.0 | 0.50 | V1 |
| ③ | 20 | 10.0 | 0.10 | 4.0 | 0.50 | V2 |
(4)该实验①、②可探究
您最近一年使用:0次
6 . 相同温度下,体积相等的两个恒容密闭容器中发生如下反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:
下列叙述错误的是
 2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表所示:| 容器编号 | 起始时各物质物质的量/mol | 到达平衡时能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:27.78 kJ |
| ② | 0 | 0 | 2 | 吸收热量:Q kJ |
| A.平衡时,容器①中N2的转化率为30% |
| B.平衡后,向容器②再充入N2,氨气的体积分数一定增大 |
| C.容器①达到平衡时,混合气体的密度是同温同压下H2密度的5倍 |
| D.Q = 64.82 |
您最近一年使用:0次
名校
解题方法
7 . 下列有关说法正确的是
A.Ag+(aq)+ Fe2+(aq)  Ag(s)+Fe3+(aq),向平衡体系中加入水,平衡不移动 Ag(s)+Fe3+(aq),向平衡体系中加入水,平衡不移动 |
B.N2O4(g)  2NO2(g),恒温恒容下,充入N2O4,平衡正向移动, N2O4的转化率减小 2NO2(g),恒温恒容下,充入N2O4,平衡正向移动, N2O4的转化率减小 |
C.CaCO3(s)  CaO(s)+CO2(g),一定温度下,压缩体积,达到新平衡后CO2浓度增大 CaO(s)+CO2(g),一定温度下,压缩体积,达到新平衡后CO2浓度增大 |
D.NH2COONH4(s)  2NH3(g)+CO2(g),恒温恒容下,气体平均相对分子质量不再变化,则平衡 2NH3(g)+CO2(g),恒温恒容下,气体平均相对分子质量不再变化,则平衡 |
您最近一年使用:0次
名校
解题方法
8 . 取50 mL过氧化氢水溶液,在少量I-存在下分解:2H2O2 = 2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
下列说法不正确的是
| t/min | 0 | 20 | 40 | 60 | 80 |
| c/(mol·L-1) | 0.80 | 0.40 | 0.20 | 0.10 | 0.050 |
| A.反应20 min时,测得O2体积为224 mL(标准状况) |
| B.第30 min时的瞬时速率小于第50 min时的瞬时速率 |
| C.20~40 min,消耗H2O2的平均速率为0.010 mol·L-1·min-1 |
| D.MnO2或Fe3+代替I-也可以催化H2O2分解 |
您最近一年使用:0次
名校
解题方法
9 . 已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,I1、I2表示中间产物。下列说法正确的是
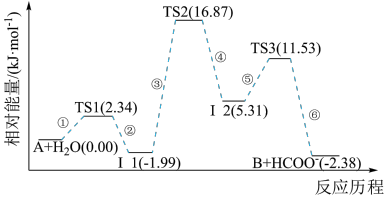

| A.化合物A与H2O之间的碰撞均为有效碰撞 |
| B.该历程中的最大能垒(活化能)E正=16.87 kJ·mol-1 |
| C.改用高活性催化剂,其反应历程一定与上图相同 |
| D.该反应的速率快慢取决于步骤③ |
您最近一年使用:0次
名校
解题方法
10 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究浓度对化学反应速率的影响 |  | 若A组褪色快,则浓度越高,化学反应速率越快 |
| B | 探究温度对化学反应速率的影响 | 取5 mL 0.1 mol/L Na2S2O3溶液和5 mL 0.1 mol/L H2SO4溶液混合后,分别放入冷水和热水中 | 若热水中先出现浑浊,则温度越高,化学反应速率越快 |
| C | 探究温度对化学平衡的影响 | 加热CuCl2溶液,观察颜色变化 | 若溶液由蓝色变为黄绿色,则[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O是吸热反应 [CuCl4]2-(黄色)+4H2O是吸热反应 |
| D | 探究压强对化学平衡的影响 | 用注射器中抽取20 mLNO2和N2O4的混合气体,压缩至10 mL | 若颜色变浅,则增大压强,平衡2NO2 N2O4正向移动 N2O4正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-22更新
|
173次组卷
|
2卷引用:重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题



