1 . 过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论, 的反应历程如下,下列有关说法正确的是
的反应历程如下,下列有关说法正确的是
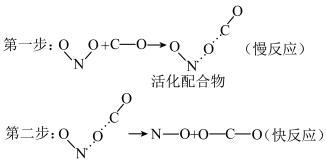
 的反应历程如下,下列有关说法正确的是
的反应历程如下,下列有关说法正确的是
| A.第二步活化配合物之间的碰撞一定是有效碰撞 |
| B.活化配合物的能量越高,第一步的反应速率越快 |
| C.第一步反应需要吸收能量 |
| D.该反应的反应速率主要取决于第二步反应 |
您最近一年使用:0次
2024-01-03更新
|
291次组卷
|
9卷引用:重庆市大足中学2021-2022学年高二上学期第一次月考化学试题
重庆市大足中学2021-2022学年高二上学期第一次月考化学试题浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题浙江省精诚联盟2022-2023学年高二上学期10月联考化学试题山东省济宁市兖州区2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业02 化学反应速率-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)福建省德化一中、永安一中、漳平一中三校协作2021-2022学年高一下学期5月联考化学试题天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率天津市第一中学2022-2023学年高三上学期1月期末质量检测化学试题
名校
2 . 工业上以 和
和 为原料合成甲醇的反应:
为原料合成甲醇的反应: ,在容积为
,在容积为 的恒容容器中,分别在
的恒容容器中,分别在 温度下合成甲醇。如图是不同温度下
温度下合成甲醇。如图是不同温度下 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系。
平衡转化率的关系。
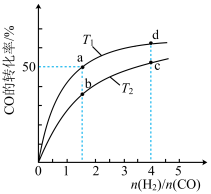
(1)
___________  (选填“<”、“>”或“=”),理由是
(选填“<”、“>”或“=”),理由是___________ 。
(2)若 点达到平衡的时间是
点达到平衡的时间是 ,从反应开始到平衡用
,从反应开始到平衡用 表示的反应速率为
表示的反应速率为
___________ ;
(3) 点的平衡常数
点的平衡常数
___________ 。
(4)a、b、c三点 转化率由大到小的顺序是
转化率由大到小的顺序是___________ 。
(5)a点状态下再通入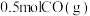 和
和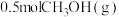 ,达到新平衡时
,达到新平衡时 的转化率将
的转化率将___________ (填“增大”“减小”或“不变”)。
(6)下列有利于提高 平衡转化率的措施有
平衡转化率的措施有___________ 。
a.增大压强(缩小体积) b.降低温度
c.提高原料气中 的比例 d.使用高效催化剂
的比例 d.使用高效催化剂
(7)下列说法不正确的是___________ 。
a.将容器体积变为 ,再次达平衡时,
,再次达平衡时, 的物质的量浓度为原平衡的2倍
的物质的量浓度为原平衡的2倍
b.该反应在任何条件下都能自发进行
c.充分反应后,容器内只存在 分子
分子
d.升高温度, 增大
增大
 和
和 为原料合成甲醇的反应:
为原料合成甲醇的反应: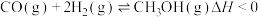 ,在容积为
,在容积为 的恒容容器中,分别在
的恒容容器中,分别在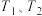 温度下合成甲醇。如图是不同温度下
温度下合成甲醇。如图是不同温度下 和
和 的起始组成比(起始时
的起始组成比(起始时 的物质的量均为
的物质的量均为 )与
)与 平衡转化率的关系。
平衡转化率的关系。
(1)

 (选填“<”、“>”或“=”),理由是
(选填“<”、“>”或“=”),理由是(2)若
 点达到平衡的时间是
点达到平衡的时间是 ,从反应开始到平衡用
,从反应开始到平衡用 表示的反应速率为
表示的反应速率为
(3)
 点的平衡常数
点的平衡常数
(4)a、b、c三点
 转化率由大到小的顺序是
转化率由大到小的顺序是(5)a点状态下再通入
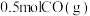 和
和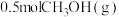 ,达到新平衡时
,达到新平衡时 的转化率将
的转化率将(6)下列有利于提高
 平衡转化率的措施有
平衡转化率的措施有a.增大压强(缩小体积) b.降低温度
c.提高原料气中
 的比例 d.使用高效催化剂
的比例 d.使用高效催化剂(7)下列说法不正确的是
a.将容器体积变为
 ,再次达平衡时,
,再次达平衡时, 的物质的量浓度为原平衡的2倍
的物质的量浓度为原平衡的2倍b.该反应在任何条件下都能自发进行
c.充分反应后,容器内只存在
 分子
分子d.升高温度,
 增大
增大
您最近一年使用:0次
名校
3 . 随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括 SO2、CO、NOx、烃类等等。
(1)在一定条件下,CH4可与 NOx反应除去 NOx,已知有下列热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(1) ΔH =-890.3kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH =+67.0kJ/mol
H2O(1)=H2O(g) ΔH =+41.0kJ/mol
CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) ΔH =__________ kJ/mol
(2)在 2 L 的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,发生反应CO(g)+2H2(g) CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
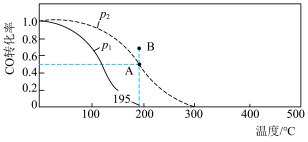
P2及195℃时n(H2)随时间变化
①该反应的ΔH___________ 0(填“>”、“<”或“=”),原因是___________ 。
②在 P2及 195 ℃时,在 0~2 min,平均反应速率 v(CH3OH)=___________ 。
③能说明该反应已达到平衡状态的是___________ 。
a.容器内混合气体压强保持不再变化 b.CO 和 H2的转化率之比不再变化
c.容器内混合气体的平均摩尔质量不再变化 d.容器内混合气体的密度不再变化
④P2及 195℃下,在 B 点时,v(正)___________ v(逆)(填“>”、“<”或“=”)。
⑤下列说法不正确的是___________ 。
a.将容器体积变为 1L,再次达平衡时,CO 的物质的量浓度为原平衡的 2 倍
b.该反应在任何条件下都能自发进行
c.充分反应后,容器内只存在 CH3OH 分子
d.升高温度,n(CH3OH)/n(CO)减小
⑥在 P2及 195 ℃时,该反应的平衡常数 Kp=___________ (用平衡分压代替平衡浓度计算, 分压=总压×物质的量分数,结果用含 P2的分式表示)。
(1)在一定条件下,CH4可与 NOx反应除去 NOx,已知有下列热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(1) ΔH =-890.3kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH =+67.0kJ/mol
H2O(1)=H2O(g) ΔH =+41.0kJ/mol
CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) ΔH =
(2)在 2 L 的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,发生反应CO(g)+2H2(g)
 CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得 CO 的平衡转化率随温度及不同压强的变化如图所示,P2和 195 ℃时 n(H2)随时间的变化结果如表所示。
P2及195℃时n(H2)随时间变化
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2) | 8 | 6 | 5 | 4 | 4 |
②在 P2及 195 ℃时,在 0~2 min,平均反应速率 v(CH3OH)=
③能说明该反应已达到平衡状态的是
a.容器内混合气体压强保持不再变化 b.CO 和 H2的转化率之比不再变化
c.容器内混合气体的平均摩尔质量不再变化 d.容器内混合气体的密度不再变化
④P2及 195℃下,在 B 点时,v(正)
⑤下列说法不正确的是
a.将容器体积变为 1L,再次达平衡时,CO 的物质的量浓度为原平衡的 2 倍
b.该反应在任何条件下都能自发进行
c.充分反应后,容器内只存在 CH3OH 分子
d.升高温度,n(CH3OH)/n(CO)减小
⑥在 P2及 195 ℃时,该反应的平衡常数 Kp=
您最近一年使用:0次
名校
4 . 自热化学链重整制氢 CLR(a)工艺的原理如图所示:
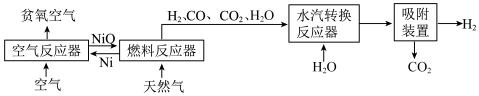
回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为___________ 。
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:___________ 。
②K1、K2、K3之间的关系是:___________ ;
③在___________ (填“高温”或“低温”)情况下有利于反应Ⅲ的自发进行。
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=___________ 。
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:___________ ;
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:___________ ;
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为___________ (结果保留 1 位小数)。

回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:
②K1、K2、K3之间的关系是:
③在
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为
您最近一年使用:0次
名校
解题方法
5 . 汽车尾气里含有的 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在 T ℃时,平衡常数 K=9.0。请回答:
2NO(g) ΔH>0,已知该反应在 T ℃时,平衡常数 K=9.0。请回答:
(1)该反应的平衡常数表达式为:K=___________ ;
(2)某温度下,向 2 L 的密闭容器中充入 N2和 O2各 1 mol,5s 后 O2的物质的量为 0.4 mol, 则 0~5s 内 NO 的反应速率___________ mol·L-1·min-1;
(3)下列为 4 种不同情况下测得的反应速率中,表明该反应进行最快的是____;
(4)将N2、O2混合充入恒温恒容密闭容器中,下列变化趋势正确的是___________ (填字母序号);
A.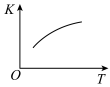 B.
B.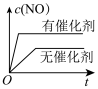 C.
C.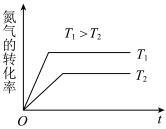
(5)T ℃时,某时刻测得容器内 N2、O2、NO 的浓度分别为 0.20 mol/L、0.20mol/L 和 0.50mol/L, 此时反应 v正(N2)___________ v逆(N2)(填“>”、“=”或“<”)。
 2NO(g) ΔH>0,已知该反应在 T ℃时,平衡常数 K=9.0。请回答:
2NO(g) ΔH>0,已知该反应在 T ℃时,平衡常数 K=9.0。请回答:(1)该反应的平衡常数表达式为:K=
(2)某温度下,向 2 L 的密闭容器中充入 N2和 O2各 1 mol,5s 后 O2的物质的量为 0.4 mol, 则 0~5s 内 NO 的反应速率
(3)下列为 4 种不同情况下测得的反应速率中,表明该反应进行最快的是____;
| A.v(N2)=0.4 mol·L-1·min-1 | B.v(NO)=0.6 mol·L-1·min-1 |
| C.v(O2)=0.3 mol·L-1·s-1 | D.v(NO)=0.4 mol·L-1·s-1 |
A.
 B.
B. C.
C.
(5)T ℃时,某时刻测得容器内 N2、O2、NO 的浓度分别为 0.20 mol/L、0.20mol/L 和 0.50mol/L, 此时反应 v正(N2)
您最近一年使用:0次
名校
6 . 利用如图所示装置测定中和热的实验步骤如下:
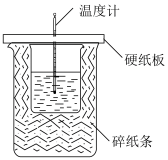
①用量筒量取 50 mL 0.50 mol·L-1 盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并测出其温度;
③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________ 。
(2)烧杯间填满碎纸条的作用是___________ 。
(3)所用 NaOH 溶液要稍过量的原因是___________ 。
(4)倒入 NaOH 溶液的正确操作是___________ (填序号)。
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(5)使盐酸与 NaOH 溶液混合均匀的正确操作是___________(填序号)。
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___________ 。
(7)若用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,测得的中和反应热数值会___________ (填“偏大”、“偏小”或“无影响”)。

①用量筒量取 50 mL 0.50 mol·L-1 盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取 50 mL 0.55 mol·L-1 NaOH 溶液,并测出其温度;
③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是
(3)所用 NaOH 溶液要稍过量的原因是
(4)倒入 NaOH 溶液的正确操作是
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(5)使盐酸与 NaOH 溶液混合均匀的正确操作是___________(填序号)。
| A.用温度计小心搅拌 | B.揭开硬纸片用玻璃棒搅拌 |
| C.轻轻地振荡烧杯 | D.用套在温度计上的环形玻璃搅拌器轻轻地搅动 |
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(7)若用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,测得的中和反应热数值会
您最近一年使用:0次
名校
解题方法
7 . 下列是一些化学键的键能。
根据键能数据估算反应CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热ΔH为
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
| A.1940 kJ·mol-1 | B.-1940 kJ·mol-1 | C.485 kJ·mol-1 | D.-485 kJ·mol-1 |
您最近一年使用:0次
2023-08-19更新
|
598次组卷
|
4卷引用:重庆市大足中学2021-2022学年高二上学期第一次月考化学试题
名校
8 . 在 300mL 的密闭容器中,放入镍粉并充入一定量的 CO 气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知平衡常数与温度的关系如下表:
Ni(CO)4(g),已知平衡常数与温度的关系如下表:
下列说法不正确的是
 Ni(CO)4(g),已知平衡常数与温度的关系如下表:
Ni(CO)4(g),已知平衡常数与温度的关系如下表:| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A.上述生成 Ni(CO)4(g)的反应为放热反应 |
| B.0℃达到平衡时,增大压强(体积变小),平衡正向移动,K 值增大 |
| C.80℃达到平衡时,测得 n(CO)=0.3mol,则 Ni(CO)4的平衡浓度为 2mol/L |
| D.容器中 Ni(s)的质量可以作为判断反应是否达到平衡的标志 |
您最近一年使用:0次
2023-08-19更新
|
153次组卷
|
2卷引用:重庆市大足中学2021-2022学年高二上学期第一次月考化学试题
9 . 依据图示关系,下列说法不正确的是
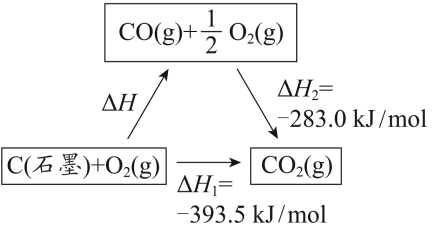

| A.石墨燃烧是放热反应 |
| B.1molC(石墨)和 1molCO 分别在足量 O2中燃烧, 全部转化为 CO2,前者放热多 |
| C.ΔH=ΔH1+ΔH2 |
| D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2023-08-19更新
|
301次组卷
|
3卷引用:重庆市大足中学2021-2022学年高二上学期第一次月考化学试题
重庆市大足中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)福建省龙岩市一级校联盟2023-2024学年高二上学期11月期中考试化学试题
名校
10 . 一定条件下的恒容密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是
2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是

 2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是
2NH3(g),下图表示反应过程中能量 的变化。下列说法不正确的是
| A.加入催化剂不改变该反应的反应热 |
| B.b 曲线是加入催化剂时的能量变化曲线 |
| C.在常温、体积一定的条件下,通入 1 mol N2和 3 mol H2反应后放出的热量为 92 kJ |
| D.温度降低,平衡正向移动,N2转化率增大 |
您最近一年使用:0次
2023-08-19更新
|
209次组卷
|
3卷引用:重庆市大足中学2021-2022学年高二上学期第一次月考化学试题



