名校
解题方法
1 . 化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是
| A.将肉类食品进行低温冷藏,能使其永远不会腐败变质 |
| B.在化学工业中,选用催化剂一定能提高经济效益 |
| C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大 |
| D.茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间 |
您最近一年使用:0次
2023-08-04更新
|
292次组卷
|
22卷引用:三峡名校联盟2021-2022学年高二上学期联考化学试题
三峡名校联盟2021-2022学年高二上学期联考化学试题北京市2019—2020学年高二上学期期中考试化学试题(选修4人教版)黑龙江桦南二中2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评黑龙江省海林市朝鲜族中学2020-2021学年高二上学期第一次月考化学试题广东省东莞市第四高级中学2020-2021学年高二上学期期中考试化学试题天津市静海区第一中学2020-2021学年高二11月考化学试题江苏省华东师范大学盐城实验中学2021-2022学年高二上学期第一次月考化学试题 吉林省长春市榆树市实验高级中学校2021-2022学年高二上学期第一次月考化学试题贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题(已下线)专题2 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)湖南省益阳市箴言中学2021-2022学年高二上学期第三次月考化学试题河南省浉河区新时代学校2021-2022学年高二上学期第二次月考化学试题云南昆明市昆明行知中学2021-2022学年高二上学期期中考试化学试题四川省绵阳市南山中学2022-2023学年高二上学期12月线上测试化学试题辽宁省辽西联合校2023-2024学年高二上学期期中考试化学试题广东省湛江市第二十一中学2023-2024学年高二上学期期中考试化学试题 北京市大兴区第一中学2023-2024学年高二上学期期中考试化学试题甘肃省天水市田家炳中学2019-2020学年高一下学期期中考试化学试题河南省顶级名校2021-2022学年高一下学期6月月考化学试题云南省腾冲市第一中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
2 . 对于可逆反应mA(s)+nB(g)⇌eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是
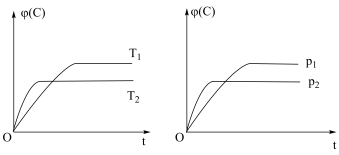

| A.达到平衡后,若使用催化剂,C的体积分数将增大 |
| B.该反应的ΔH<0 |
| C.化学方程式中,n>e+f |
| D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
您最近一年使用:0次
2022-09-19更新
|
892次组卷
|
24卷引用:三峡名校联盟2021-2022学年高二上学期联考化学试题
三峡名校联盟2021-2022学年高二上学期联考化学试题黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期(A)班月考化学试题山东省淄博市淄川中学2019-2020学年高二上学期期中考试化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高二上学期期中考试化学试题湖南省岳阳市平江县第一中学2020-2021学年高二上学期10月联考化学试题甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题天津市武清区杨村第一中学2021-2022学年高二上学期第一次月考化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题天津市静海区四校2021-2022学年高二上学期11月阶段性检测化学试题(已下线)专题2 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题湖南省益阳市箴言中学2021-2022学年高二上学期第三次月考化学试题天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题河南省温县第一高级中学2022-2023学年高二上学期第二次月考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高二上学期期中考试化学试题浙江省杭州市长河高级中学2022-2023学年高二上学期期中考试化学试题章末检测卷(二)化学反应的方向、限度与速率黑龙江省齐齐哈尔市第八中学校2022-2023学年高二上学期11月期中考试化学试题浙江省台州市台州八校联盟2022-2023学年高二上学期11月期中联考化学试题山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第一次质量检测化学试题天津市北辰区2023-2024学年高二上学期期中考试化学试题湖北省部分高中联考协作体2023-2024学年高二上学期期中考试化学试题安徽省蚌埠市怀远禹泽、固镇县汉兴学校2023-2024学年高二上学期12月期末联考化学试题
名校
解题方法
3 . 用 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:
①
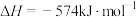
②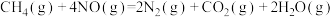
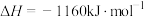
下列说法不正确的是
 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:①

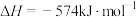
②
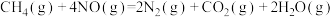
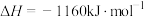
下列说法不正确的是
A.若标准状况下4.48L 与 与 完全反应生成 完全反应生成 、 、 和水蒸气,放出的热量为173.4kJ 和水蒸气,放出的热量为173.4kJ |
B.由反应①可推知: 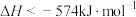 |
C.反应①②中,相同物质的量的 发生反应,转移的电子数相同 发生反应,转移的电子数相同 |
D.反应②中当4.48L 反应完全时转移的电子为1.60mol 反应完全时转移的电子为1.60mol |
您最近一年使用:0次
2022-09-04更新
|
2235次组卷
|
44卷引用:三峡名校联盟2021-2022学年高二上学期联考化学试题
三峡名校联盟2021-2022学年高二上学期联考化学试题2015-2016学年湖南省冷水江一中高二上学期期中(理)化学试卷2016-2017学年河北省唐山市开滦一中高二上10月月考化学试卷 2016-2017学年江苏省泰州中学高二上月考一化学试卷山西省朔州市第一中学2017-2018学年高二8月月考化学试题山东省枣庄市第八中学东校区2017-2018学年高二10月月考化学试题甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二3月月考化学试题山西省朔州市平鲁区李林中学2018-2019学年高二上学期第一次月考化学试题河南省周口市中英文学校2018-2019学年高二上学期第一次月考化学试题(已下线)2018年10月21日 《每日一题》人教选修4-每周一测山西省长治二中2018-2019学年高二上学期第一次月考化学试题高二人教版选修4 第一章 第三节 化学反应热的计算福建省泉州市泉港区第一中学2018-2019学年高二上学期第二次月考化学试题江苏省江阴市第一中学2018-2019学年高二下学期期中考试化学试题步步为赢 高二化学暑假作业:作业七 化学反应与能量甘肃省兰州市第一中学2019-2020学年高二9月月考化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节 化学反应的热效应 课时3 反应焓变的计算高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练(已下线)【南昌新东方】5. 南昌三中 徐钢 吴丹.广东省深圳市第七高级中学2020-2021学年高二上学期第一学段考试化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过综合 章末素养综合检测人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过综合 章末素养综合检测山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题广东省清远市凤霞中学2020-2021学年高二上学期期中考试化学(选科)试题湖北省咸宁市通城二中2020-2021学年高二上学期10月月考化学试题山西省沁县中学2020-2021学年高二上学期第一次月考化学试题选择性必修1(SJ)专题1专题综合检测选择性必修1专题1第一单元 课时2 反应热的测量与计算河南省内乡县第三高级中学2021-2022学年高二上学期第一次月考化学试卷河北省石家庄实验中学2021-2022学年高二上学期10月月考化学试题安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题云南省丽江市第一高级中学2021-2022学年高二上学期期中考试化学试题(已下线)化学反应的热效应——进阶学习第一章化学反应的热效应甘肃省兰州市西固区三校2021-2022学年高二上学期期中联考化学(理科)试题江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题吉林省九台龙成实验学校2022-2023学年高二上学期第一次月考化学试题宁夏石嘴山市第三中学2022-2023学年高二下学期第一次月考化学(理)试题1.1.2反应热的测量与计算 课后重庆市缙云教育联盟2021-2022学年高三8月月度质量检测化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题黑龙江哈尔滨第一中学2023-2024学年高三上学期期中考试化学试题
名校
4 . 回答下列问题:
(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH=-272.0kJ·mol-1;
O2(g)=FeO(s) ΔH=-272.0kJ·mol-1;
②2Al(s)+ O2(g)=A12O3(s) ΔH=-1675.7kJ·mol-1
O2(g)=A12O3(s) ΔH=-1675.7kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是_______ 。某同学认为,铝热反应不能用于工业炼铁,他判断的理由是铝热反应虽然为放热反应但是铝需要用_______ 制备,消耗能量多,同时得到的铁纯度低等。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应过程分别为A、B,如图所示:

①据图判断该反应是_______ (填“吸”或“放”)热反应,ΔH=_______ ;A过程逆反应的活化能为_______ ;
②其中过程B表明此反应采用的条件为_______ (填字母);
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
该条件是因为_______ 而加快了反应速率。
(1)已知:①Fe(s)+
 O2(g)=FeO(s) ΔH=-272.0kJ·mol-1;
O2(g)=FeO(s) ΔH=-272.0kJ·mol-1;②2Al(s)+
 O2(g)=A12O3(s) ΔH=-1675.7kJ·mol-1
O2(g)=A12O3(s) ΔH=-1675.7kJ·mol-1Al和FeO发生铝热反应的热化学方程式是
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应过程分别为A、B,如图所示:

①据图判断该反应是
②其中过程B表明此反应采用的条件为
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
该条件是因为
您最近一年使用:0次
名校
5 . 含铬(+6价)的废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:
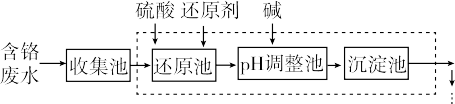
(1)废水中,+6价铬以CrO 或者Cr2O
或者Cr2O 的形式存在,写出其相互转化的离子方程式:
的形式存在,写出其相互转化的离子方程式:_______ ;我国常用NaHSO3作还原剂,写出还原池中主要反应的离子方程式:_______ (还原产物为Cr3+);有人认为Cr3+与A13+性质相似,请写出将CrC13滴入NaCrO2溶液中发生的反应的化学方程式_______ 。
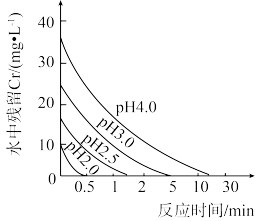
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pIH=2.5~3.0,原因可能是_______ 。
(3)我国规定,工业废水中含Cr(VI)量的排放标准为0.1mg·L-1。已知:Ksp(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO ,达到废水排放标准时,废水中Ba2+浓度最低为
,达到废水排放标准时,废水中Ba2+浓度最低为________ mol·L-1(保留小数点后2位)。用Ba2+除去废水中的CrO (填是或否)可行,原因是
(填是或否)可行,原因是_______ 。
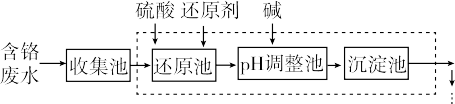
(1)废水中,+6价铬以CrO
 或者Cr2O
或者Cr2O 的形式存在,写出其相互转化的离子方程式:
的形式存在,写出其相互转化的离子方程式:(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pIH=2.5~3.0,原因可能是

(3)我国规定,工业废水中含Cr(VI)量的排放标准为0.1mg·L-1。已知:Ksp(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO
 ,达到废水排放标准时,废水中Ba2+浓度最低为
,达到废水排放标准时,废水中Ba2+浓度最低为 (填是或否)可行,原因是
(填是或否)可行,原因是
您最近一年使用:0次
名校
6 . Cu2O是一种重要的工业原料,广泛用作化工催化剂。
I.制备Cu2O采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O,其装置如图甲、乙。

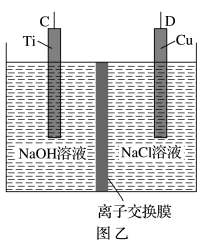
(1)上述装置中D电极应连接肼燃料电池的_______ 极(填“A”或“B”),该电解池中离子交换膜为_______ (填“阴”或“阳”)离子交换膜。
(2)该电解池的阴极反应式为_______ ,肼燃料电池中A极发生的电极反应式为_______ 。
(3)当反应生成14.4gCu2O时,至少需要肼_______ mol。
II.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH=-90.8kJ·mol-1,回答下列问题:
(4)能说明反应CO(g)+2H2(g) CH3OH(g),已达平衡状态的是_______(填字母)。
CH3OH(g),已达平衡状态的是_______(填字母)。
(5)t°C时,在体积为2L的固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g),CO(g)的物质的量随时间的变化如下表:
根据表中数据回答:
①10S内CH3OH(g)的反应速率_______ 。
②氢气平衡转化率为:_______ ;
③t°C时该反应的平衡常数为:_______ 。
④保持其它条件不变,再向平衡体系中再充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正_______ v逆(填“>”“<”或“=”)。
(6)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:_______ 。

I.制备Cu2O采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O,其装置如图甲、乙。


(1)上述装置中D电极应连接肼燃料电池的
(2)该电解池的阴极反应式为
(3)当反应生成14.4gCu2O时,至少需要肼
II.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH=-90.8kJ·mol-1,回答下列问题:
(4)能说明反应CO(g)+2H2(g)
 CH3OH(g),已达平衡状态的是_______(填字母)。
CH3OH(g),已达平衡状态的是_______(填字母)。| A.CO的消耗速率等于CH3OH的生成速率 |
| B.一定条件,CO的转化率不再变化 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.n(CO):n(H2):n(CH3OH)=1:2:1 |
| 时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①10S内CH3OH(g)的反应速率
②氢气平衡转化率为:
③t°C时该反应的平衡常数为:
④保持其它条件不变,再向平衡体系中再充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(6)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:

您最近一年使用:0次
名校
7 . 乙二酸(H2C2O4)俗名草酸,是一种有还原性的有机二元弱酸,在化学上有广泛应用。为测定某乙二酸样品的纯度,实验步骤如下:
①准确称量5.000g乙二酸样品,配成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,加入少量硫酸酸化,用0.1000mol·L-1KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL(杂质不与KMnO4溶液反应)。
回答下列问题:
(1)写出草酸的电离方程式_______ 。
(2)KMnO4标准液应装入_______ (填“酸式”或“碱式”)滴定管,理由是_______ 。
(3)KMnO4溶液滴定草酸过程中发生反应的离子方程为_______ ,滴定终点的现象为_______ 。
(4)计算此样品的纯度为_______ 。
(5)下列操作会导致测定结果偏高的是_______ (填字母)。
a.未用KMnO4标准溶液润洗滴定管
b.滴定前锥形瓶内有少量水
c.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
d.观察读数时,滴定前仰视,滴定后俯视
①准确称量5.000g乙二酸样品,配成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,加入少量硫酸酸化,用0.1000mol·L-1KMnO4溶液滴定至草酸恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL(杂质不与KMnO4溶液反应)。
回答下列问题:
(1)写出草酸的电离方程式
(2)KMnO4标准液应装入
(3)KMnO4溶液滴定草酸过程中发生反应的离子方程为
(4)计算此样品的纯度为
(5)下列操作会导致测定结果偏高的是
a.未用KMnO4标准溶液润洗滴定管
b.滴定前锥形瓶内有少量水
c.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
d.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
2022-02-20更新
|
82次组卷
|
2卷引用:三峡名校联盟2021-2022学年高二上学期联考化学试题
名校
解题方法
8 . 下列关于如图装置说法正确的是


| A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极 |
| B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO |
| C.若M为FeCl2溶液,可以实现石墨上镀铁 |
| D.若M是AlCl3溶液,利用该装置可制备金属铝 |
您最近一年使用:0次
名校
9 . C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②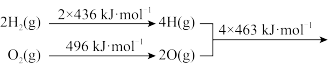 2H2O(g)
2H2O(g)
下列推断正确的是
①2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②
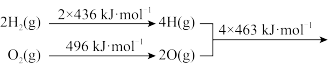 2H2O(g)
2H2O(g)下列推断正确的是
| A.C(s)的燃烧热为110.5kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(g) ΔH>0,ΔS<0,该反应是非自发反应 |
| C.C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ·mol-1 |
| D.将2molH2O(g)分解成H2(g)和O2(g),至少需要提供4×463kJ的热量 |
您最近一年使用:0次
2022-02-20更新
|
1007次组卷
|
5卷引用:三峡名校联盟2021-2022学年高二上学期联考化学试题
名校
解题方法
10 . 对下列图示实验的描述正确的是


| A.图1所示的实验:钢闸门连在外接电源的负极上,可以对其进行保护 |
| B.图2所示的实验:用NaOH溶液滴定盐酸 |
| C.图3所示的实验:用浓硫酸和NaOH溶液反应测定中和反应的反应热 |
| D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)→N2O4(g)正反应是吸热反应 |
您最近一年使用:0次
2022-02-20更新
|
169次组卷
|
5卷引用:三峡名校联盟2021-2022学年高二上学期联考化学试题



