名校
1 . 已知: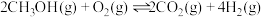 的能量变化如图所示,在绝热恒容的密闭容器中发生该反应,下列说法错误的是
的能量变化如图所示,在绝热恒容的密闭容器中发生该反应,下列说法错误的是
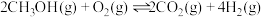 的能量变化如图所示,在绝热恒容的密闭容器中发生该反应,下列说法错误的是
的能量变化如图所示,在绝热恒容的密闭容器中发生该反应,下列说法错误的是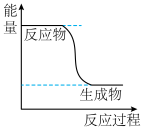
| A.当容器内温度不再变化时,反应处于平衡状态 |
B.反应过程中, 的生成速率与 的生成速率与 的消耗速率之比为2∶1 的消耗速率之比为2∶1 |
| C.当容器内压强不再变化时,反应处于平衡状态 |
| D.1mol甲醇和1mol氧气反应达到平衡状态后,O2(g)的物质的量为0.5mol |
您最近一年使用:0次
2 . 25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)HCOOH、H2CO3、HCN的酸性由强到弱的顺序为___________ 。
(2)向Na2CO3溶液中加入足量HCN,反应的离子方程式为___________ 。
(3)写出HCOONa溶液中的电荷守恒式___________ 。
(4)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.00mol/L的NaOH标准溶液滴定:
①用NaOH固体配置100mL,1.00mol/L的NaOH溶液,需要用到的仪器除托盘天平,药匙,烧杯,玻璃棒,胶头滴管,还必须要___________ 。
②实验过程中,将25.00mLHCOOH放入锥形瓶,滴入酚酞2-3滴;NaOH溶液应装___________ 入(填“酸式滴定管”或“碱式滴定管”);滴定过程中,眼睛应注视___________ 。
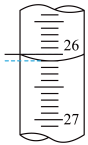
③连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为___________ mL。
④某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算该HCOOH溶液的物质的量浓度为___________ mol/L(计算结果保留到小数点后两位)。
⑤下列操作中可能使所测HCOOH溶液的浓度数值偏低的是___________ (填字母)。
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
| 化学式 | HCOOH | H2CO3 | HCN |
| 电离平衡常数 | 1.5×10-4 | Ka1=4.2×10-7 Ka2=4.9×10-11 | 3.0×10-8 |
(1)HCOOH、H2CO3、HCN的酸性由强到弱的顺序为
(2)向Na2CO3溶液中加入足量HCN,反应的离子方程式为
(3)写出HCOONa溶液中的电荷守恒式
(4)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.00mol/L的NaOH标准溶液滴定:
①用NaOH固体配置100mL,1.00mol/L的NaOH溶液,需要用到的仪器除托盘天平,药匙,烧杯,玻璃棒,胶头滴管,还必须要
②实验过程中,将25.00mLHCOOH放入锥形瓶,滴入酚酞2-3滴;NaOH溶液应装
③连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为

④某学生根据3次实验分别记录有关数据如下表:
| 实验序号 | 待测HCOOH溶液体积/mL | 1.00mol/LNaOH的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液的体积 | ||
| 1 | 25.00 | 0.00 | 12.49 | V1 |
| 2 | 25.00 | 0.56 | 14.56 | V2 |
| 3 | 25.00 | 0.22 | 12.73 | V3 |
⑤下列操作中可能使所测HCOOH溶液的浓度数值偏低的是
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
您最近一年使用:0次
解题方法
3 . 广安代市镇火力发电厂需要燃烧大量的煤,产生大量CO2和SO2等,并留下大量煤渣,对环境有较大影响。其中一种不能继续燃烧的煤渣成分俗名叫“铁甲石”,主要成分为:Al2O3(15%~24%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)、FeO(0.9%~2.0%)、CuO(8.5%~11.0%)以及其他不溶性杂质,铁甲石中的氧化铝难溶于酸,可以通过煅烧改变铁甲石结构,使其溶于酸。铁甲石经过下列化工工艺,可以制取无水CuCl2。

已知Cu2+、Fe2+、Fe3+、Al3+生成沉淀pH范围如下:
(1)第一次过滤的滤渣为___________ 。
(2)加H2O2后发生反应的离子方程式为___________ 。
(3)调节溶液pH需要控制的范围是___________ ,“调节溶液pH”的过程中除添加试剂,还需借助于___________ 测定溶液pH值。
(4)调节pH值用到的试剂或物质是___________(填下列字母)。
(5)从滤液2中得到无水CuCl2的操作为___________ 。

已知Cu2+、Fe2+、Fe3+、Al3+生成沉淀pH范围如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 5.8 | 5.8 | 2.0 | 4.0 |
| 沉淀完成pH | 7.5 | 8.3 | 3.1 | 5.4 |
(1)第一次过滤的滤渣为
(2)加H2O2后发生反应的离子方程式为
(3)调节溶液pH需要控制的范围是
(4)调节pH值用到的试剂或物质是___________(填下列字母)。
| A.氢氧化钠 | B.氨水 | C.CuO | D.AlCl3 |
(5)从滤液2中得到无水CuCl2的操作为
您最近一年使用:0次
4 . 已知NO2(g)+CO(g) NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
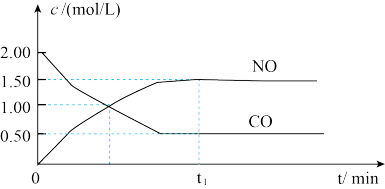
(1)该反应是___________ 反应(填“放热”或“吸热”)。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=___________ 。
(3)此温度下,该反应的平衡常数表达式K=___________ ;温度降低,K___________ (填“变大”、“变小”或“不变”)。
(4)下列条件或者现象能判断该反应一定达到平衡状态的是___________(填下列字母)。
(5)已知:
①CO(g)+ O2(g)=CO2(g) ΔH=−283.0kJ·mol−1
O2(g)=CO2(g) ΔH=−283.0kJ·mol−1
②S(s)+O2(g)=SO2(g) ΔH=−296.0kJ·mol−1
处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质S。此反应的热化学方程式是___________ 。
 NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
NO(g)+CO2(g) ΔH=-230kJ/mol,下图是恒容密闭容器中,该反应CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
(1)该反应是
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=
(3)此温度下,该反应的平衡常数表达式K=
(4)下列条件或者现象能判断该反应一定达到平衡状态的是___________(填下列字母)。
| A.容器内颜色不再改变 | B.当c(NO)=c(CO2)时 |
| C.混合气体平均摩尔质量不再改变 | D.容器内压强不再改变 |
(5)已知:
①CO(g)+
 O2(g)=CO2(g) ΔH=−283.0kJ·mol−1
O2(g)=CO2(g) ΔH=−283.0kJ·mol−1②S(s)+O2(g)=SO2(g) ΔH=−296.0kJ·mol−1
处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质S。此反应的热化学方程式是
您最近一年使用:0次
解题方法
5 . 化学与生活息息相关,下列说法正确的是
| A.干电池电量释放完后,可以继续充电再使用 |
| B.燃烧反应属于放热反应,木材的燃烧化学能全部转化为热能 |
| C.轮船船身常常嵌入铜块保护铁不被海水腐蚀 |
| D.钢铁在潮湿的空气中锈蚀主要是发生了吸氧腐蚀 |
您最近一年使用:0次
名校
解题方法
6 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为______ 。
(2)卤素单质有着相似的化学性质,但同时也有差别。比如 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: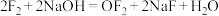 。其中
。其中 的电子式为
的电子式为______ ,用电子式描述NaF的形成过程:______ 。
(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性______ (填“大于”或“小于”)HI的稳定性,AgAt______ (填“易”或“难”)溶于水。
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。
① 与水反应的产物可能为
与水反应的产物可能为______ (填化学式)。
②下列说法不正确的是______ 。
A.HF、HCl、HBr的沸点依次升高
B. 沸点依次升高
沸点依次升高
C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D. (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(1)
 的离子结构示意图为
的离子结构示意图为(2)卤素单质有着相似的化学性质,但同时也有差别。比如
 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: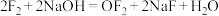 。其中
。其中 的电子式为
的电子式为(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如
 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。①
 与水反应的产物可能为
与水反应的产物可能为②下列说法不正确的是
A.HF、HCl、HBr的沸点依次升高
B.
 沸点依次升高
沸点依次升高C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D.
 (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
您最近一年使用:0次
2024-04-04更新
|
201次组卷
|
2卷引用:四川省广安市华蓥中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
7 . 下列说法正确的是
A.锂(Li)在氧气中剧烈燃烧,产物是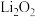 |
| B.由分子构成的物质中一定存在共价键 |
C.明矾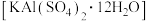 能净水和杀菌 能净水和杀菌 |
D.Fe能与 反应,但液氯可以用钢瓶存储和运输 反应,但液氯可以用钢瓶存储和运输 |
您最近一年使用:0次
名校
8 . 化学处处呈现美。下列说法正确的是
| A.环己烷呈现对称美,是正六边形平面结构 |
B. 分子呈现“皇冠”结构, 分子呈现“皇冠”结构, 属于共价晶体 属于共价晶体 |
| C.霓虹灯发出五颜六色的光,该过程属于化学变化 |
D.锌片在 溶液中生成“银树”,反应中锌被氧化 溶液中生成“银树”,反应中锌被氧化 |
您最近一年使用:0次
2024-03-15更新
|
595次组卷
|
2卷引用:四川省广安市岳池县第一中学2023-2024学年高二下学期第一次月考化学试题
名校
9 . 一种稀磁半导体晶体的晶胞结构如下(部分原子的分数坐标已给出),有关说法正确的是
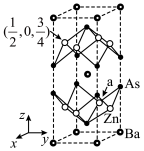
| A.该晶体属于金属晶体,一定条件下可以导电 |
B.a处Zn原子的分数坐标为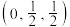 |
| C.该晶体的化学式为BaZn2As2 |
| D.与Zn距离最近且等距的As原子有3个 |
您最近一年使用:0次
2024-03-05更新
|
1182次组卷
|
6卷引用:四川省广安市华蓥中学2023-2024学年高二下学期4月期中考试化学试题
四川省广安市华蓥中学2023-2024学年高二下学期4月期中考试化学试题2024届辽宁省名校联盟(东北三省联考)高三下学期模拟预测化学试题(已下线)选择题11-15河北省石家庄市第二中学2023-2024学年高二下学期3月月考化学试题广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷(已下线)化学(辽宁卷03)-2024年高考押题预测卷
名校
解题方法
10 . 我国长征二号F型运载火箭以偏二甲肼为燃料。偏二甲肼是一种高比冲液体火箭燃料,优点在于有高比冲值,与氧化剂接触即自动着火,发生反应的化学方程式为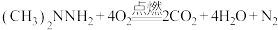 。下列说法正确的是
。下列说法正确的是
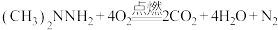 。下列说法正确的是
。下列说法正确的是A.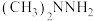 中C的化合价为-4价 中C的化合价为-4价 | B. 为非极性分子 为非极性分子 |
C.1 mol  中含有1 mol孤电子对 中含有1 mol孤电子对 | D. 的电子式为 的电子式为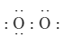 |
您最近一年使用:0次
2024-03-05更新
|
121次组卷
|
3卷引用:四川省广安市岳池县第一中学2023-2024学年高二下学期第一次月考化学试题



