名校
解题方法
1 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为_______ 。将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______(填标号)。
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S+2H2O。H2S在该反应中_______(填标号)。
(5)若e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:_______ 。
(6)若e为酸式盐,将0.1mole的溶液中加入适量H2O2氧化后,稀释成10L溶液进行环保回收,此时稀释后溶液的pH为_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______(填标号)。
| A.溶液中出现白色沉淀 |
| B.溶液没有明显变化 |
| C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀 |
| D.将溶液蒸干后仍然能得到BaCl2 |
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:(6)若e为酸式盐,将0.1mole的溶液中加入适量H2O2氧化后,稀释成10L溶液进行环保回收,此时稀释后溶液的pH为
您最近一年使用:0次
2022-05-18更新
|
127次组卷
|
2卷引用:西藏自治区拉萨市拉萨中学2022届高三第八次月考理综化学试题
名校
2 . 砷(As)与N、P是同主族元素,远古时期人们就开始开发利用砷的性质,现代技术中砷仍然起着非常重要的作用。请回答下列问题:
(1)砷只有一种稳定的同位素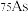 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多_______ (填数值)。
(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
(3)Marsh试砷法和Gutzeit试砷法是法医学上鉴定砷的重要方法。其原理是先将 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。
① 的电子式为
的电子式为_______ 。
②Gutzeit试砷法中 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为_______ ;砷化镓也可用于制造太阳能电池,该电池工作时的能量转化形式为_______ 。
(5)已知 的电离平衡常数分别为
的电离平衡常数分别为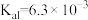 、
、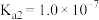 、
、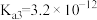 。
。
①25℃时,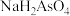 ,溶液中:
,溶液中: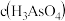
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②25℃时,向 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中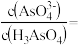
_______ 。
(1)砷只有一种稳定的同位素
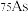 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
A.沸点: |
B.等物质的量浓度溶液的酸性: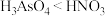 |
C.分解温度: |
D.相对分子质量: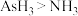 |
 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。①
 的电子式为
的电子式为②Gutzeit试砷法中
 被氧化的离子方程式为
被氧化的离子方程式为(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用
 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为(5)已知
 的电离平衡常数分别为
的电离平衡常数分别为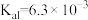 、
、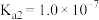 、
、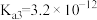 。
。①25℃时,
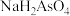 ,溶液中:
,溶液中: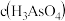
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②25℃时,向
 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中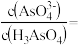
您最近一年使用:0次
2021-12-06更新
|
631次组卷
|
3卷引用:西藏拉萨中学2022届高三第七次月考理综化学试题
名校
3 . 下列说法错误的是
| A.乙烷室温下能与浓盐酸发生取代反应 |
| B.乙烯可以用作生产食品包装材料—聚乙烯的原料 |
| C.乙醇室温下在水中的溶解度大于溴乙烷 |
| D.交通警察检查司机是否醉驾时,利用了乙醇可以被酸性重铬酸钾直接氧化成乙酸的化学性质。 |
您最近一年使用:0次
4 . 硫化氢大量存在于天然气及液化石油气中,近年来发现 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解 包括下列反应:
包括下列反应:
Ⅰ.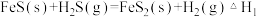
Ⅱ.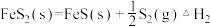
Ⅲ.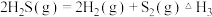
①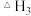 =
=____________ (用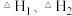 表示)。
表示)。
②已知单质硫气态时以 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339 、E(H-H)=436
、E(H-H)=436 、E(S=S)=225
、E(S=S)=225 ,则
,则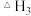 =
=____________  。
。
③ 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价, 的电子式为
的电子式为______________ 。
(2)银器长期露置在含 的空气中表面会生成
的空气中表面会生成 而变黑,该反应的氧化剂为
而变黑,该反应的氧化剂为________ ;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________ 。
(3)实验室用粗锌制取氢气时常含有少量的 ,可用酸性
,可用酸性 溶液(
溶液( 被还原为
被还原为 )将
)将 氧化为S而除去,该反应的离子方程式为
氧化为S而除去,该反应的离子方程式为_______ 。
(4) 与
与 合成硫醇
合成硫醇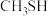 的反应
的反应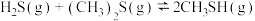 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时 的平衡转化率如图所示:
的平衡转化率如图所示:

①该反应的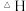
______ 0(填“>”或“<");
_________  (填“>”或“<”)。
(填“>”或“<”)。
②在2L密闭容器中充入0.2mol 和0.1mol
和0.1mol ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________ 。
③为提高 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:(1)D.Berk等学者设计的用FeS催化分解
 包括下列反应:
包括下列反应:Ⅰ.
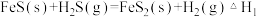
Ⅱ.
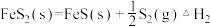
Ⅲ.
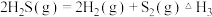
①
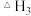 =
=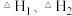 表示)。
表示)。②已知单质硫气态时以
 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339 、E(H-H)=436
、E(H-H)=436 、E(S=S)=225
、E(S=S)=225 ,则
,则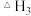 =
= 。
。③
 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价, 的电子式为
的电子式为(2)银器长期露置在含
 的空气中表面会生成
的空气中表面会生成 而变黑,该反应的氧化剂为
而变黑,该反应的氧化剂为(3)实验室用粗锌制取氢气时常含有少量的
 ,可用酸性
,可用酸性 溶液(
溶液( 被还原为
被还原为 )将
)将 氧化为S而除去,该反应的离子方程式为
氧化为S而除去,该反应的离子方程式为(4)
 与
与 合成硫醇
合成硫醇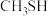 的反应
的反应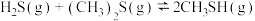 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时 的平衡转化率如图所示:
的平衡转化率如图所示:
①该反应的
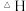

 (填“>”或“<”)。
(填“>”或“<”)。②在2L密闭容器中充入0.2mol
 和0.1mol
和0.1mol ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=③为提高
 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是
您最近一年使用:0次
2020-04-13更新
|
90次组卷
|
2卷引用:西藏昌都市第一高级中学2021届高三上学期期末考试理综化学试题
解题方法
5 . 亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲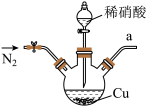 乙
乙 丙
丙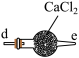 丁
丁
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
甲
 乙
乙 丙
丙 丁
丁
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
| A.甲中滴入稀硝酸前需通入N2 |
| B.仪器的连接顺序为a-f-g-d-e-b |
| C.丙中CaCl2用于干燥NO |
| D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O |
您最近一年使用:0次
2020-04-10更新
|
595次组卷
|
6卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第二次模拟考试理综化学试题
西藏自治区昌都市第一高级中学2020届高三下学期第二次模拟考试理综化学试题四川省成都市2020届高中毕业班第二次诊断性检测理综化学试题湖南省邵阳市重点学校2020届高三综合模拟考试理综化学试题(已下线)第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练(已下线)第26讲 化学实验基本操作及实验安全-2021年高考化学一轮复习名师精讲练福建省龙岩市第一中学锦山学校2021-2022学年高三上学期第三次月考化学试题
名校
6 . 已知乙烯能被酸性高锰酸钾溶液氧化成CO2。既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是( )
| A.通入足量溴水中 | B.在空气中燃烧 |
| C.通入酸性高锰酸钾溶液中 | D.通入氢氧化钠溶液中 |
您最近一年使用:0次
2020-06-04更新
|
104次组卷
|
2卷引用:西藏自治区山南市第二高级中学2019-2020学年高二下学期月考化学试题
7 . 工业上以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如下:

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO 形式存在且易被氧化。
形式存在且易被氧化。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)提高酸浸速率的措施有__________________________________ (答两条)。
(2)滤渣1的主要成分是_____ ;滤渣2的主要成分是_____ ;滤渣3的主要成分是_____ 。
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为___________ ;第一次氧化时反应的离子方程式为_____________________ ;第二次氧化时目的是____________________ 。
(4)流程图中“ ”内的操作是________________ 、洗涤、干燥。
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。该反应的离子方程式为_________________________________ 。

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO
 形式存在且易被氧化。
形式存在且易被氧化。②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.1 | — | — |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 4.7(>10溶解) | 5.6(>9溶解) |
(1)提高酸浸速率的措施有
(2)滤渣1的主要成分是
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为
(4)流程图中“ ”内的操作是
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:
(1)基态Co3+的价电子排布图为____ 。
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N_____ O(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为____ ;
②钴离子周围配位键数目(配位数)是___ ;N03-的空间构型为____ ;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是____ 。
(3)某钴氧化物晶体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是_____

(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的___ 填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为____ ;在该钴的氧化物晶体中原子的空间利用率为____ (均用含a、b的计算表达式表示)。

(1)基态Co3+的价电子排布图为
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N
②钴离子周围配位键数目(配位数)是
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是
(3)某钴氧化物晶体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是

(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,钴原子填在氧原子的

您最近一年使用:0次
2018-03-29更新
|
461次组卷
|
2卷引用:西藏自治区拉萨中学2018届高三第七次月考理综化学试题
9-10高二·西藏拉萨·阶段练习
9 . 下表是A、B、C、D、E五种有机物的有关信息:
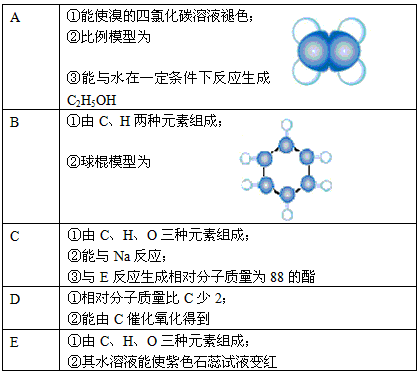
回答下列问题:
(1)A~E中,属于烃的是__________ (填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为__________ 。
(3)C催化氧化生成D的化学方程式为__________ 。
(4)有机物B具有的性质是___________ (填序号)。
①无色无味的液体;
②有毒;
③不溶于水;
④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是 (用化学方程式说明)____________________________________ 。

回答下列问题:
(1)A~E中,属于烃的是
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为
(3)C催化氧化生成D的化学方程式为
(4)有机物B具有的性质是
①无色无味的液体;
②有毒;
③不溶于水;
④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是 (用化学方程式说明)
您最近一年使用:0次
2010-07-07更新
|
1034次组卷
|
3卷引用:09 ~10年拉萨中学高二第七次月考化学卷



