名校
解题方法
1 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如图所示:

①加入Fe粉进行转化反应的离子方程式为____ ,生成的沉淀与硝酸反应,生成____ 后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的方程式为____ ;若反应物用量比为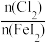 =1.5时,氧化产物为
=1.5时,氧化产物为____ ,当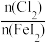 >1.5后,单质碘的收率会降低,原因是
>1.5后,单质碘的收率会降低,原因是____ 。
(2)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少____ mol。
(3)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物,再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总离子反应方程式为____ 。
(1)I2的一种制备方法如图所示:

①加入Fe粉进行转化反应的离子方程式为
②通入Cl2的过程中,若氧化产物只有一种,反应的方程式为
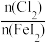 =1.5时,氧化产物为
=1.5时,氧化产物为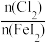 >1.5后,单质碘的收率会降低,原因是
>1.5后,单质碘的收率会降低,原因是(2)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少
(3)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物,再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总离子反应方程式为
您最近一年使用:0次
名校
解题方法
2 . 化学能与热能的转化是当今化学研究的热点。回答下列问题:
(1)卤化镁高温分解的相对能量变化如图所示。

①写出该温度下MgF2(s)分解的热化学方程式:____ 。
②比较热稳定性:MgBr2____ (填“>”或“<”)MgCl2。
③反应MgI2(s)+Br2(g)=MgBr2(s)+I2(g)△H=____ kJ·mol-1。
(2)氢氟酸是一种弱酸,已知25℃时:
HF(aq) H+(aq)+F-(aq) △H=-10.4kJ·mol-1
H+(aq)+F-(aq) △H=-10.4kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1
则表示稀HF溶液与稀NaOH溶液的热化学方程式为____ ,氢氟酸的中和反应反应热的绝对值大于57.3kJ·mol-1的原因可能是____ 。
(3)H2与F2在黑暗中混合也会发生剧烈反应,反应的热化学方程式为H2(g)+F2(g)=2HF(g) △H=-546.6kJ·mol-1,查阅文献,两种化学键键能数据如表:
则F2(g)=2F(g) △H=____ kJ·mol-1。
(1)卤化镁高温分解的相对能量变化如图所示。

①写出该温度下MgF2(s)分解的热化学方程式:
②比较热稳定性:MgBr2
③反应MgI2(s)+Br2(g)=MgBr2(s)+I2(g)△H=
(2)氢氟酸是一种弱酸,已知25℃时:
HF(aq)
 H+(aq)+F-(aq) △H=-10.4kJ·mol-1
H+(aq)+F-(aq) △H=-10.4kJ·mol-1H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1
则表示稀HF溶液与稀NaOH溶液的热化学方程式为
(3)H2与F2在黑暗中混合也会发生剧烈反应,反应的热化学方程式为H2(g)+F2(g)=2HF(g) △H=-546.6kJ·mol-1,查阅文献,两种化学键键能数据如表:
| 化学键 | H—H | F—H |
| E/(kJ·mol-1) | 436 | 565 |
您最近一年使用:0次
2022-07-06更新
|
392次组卷
|
4卷引用:山西长治上党区第一中学校2021-2022学年高一下学期期末考试化学试题
3 . 已知某有机物的分子式为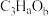 (a、b均是不为0的正整数),关于
(a、b均是不为0的正整数),关于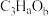 的下列说法不正确的是
的下列说法不正确的是
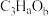 (a、b均是不为0的正整数),关于
(a、b均是不为0的正整数),关于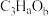 的下列说法不正确的是
的下列说法不正确的是| A.无论b为多少,a一定都是偶数 |
B.当 时,该物质可能能使酸性 时,该物质可能能使酸性 溶液褪色 溶液褪色 |
| C.若分子中含有一个碳碳双键,则a一定等于6 |
D.当 、 、 时,该物质可能含有两种官能团 时,该物质可能含有两种官能团 |
您最近一年使用:0次
名校
解题方法
4 . Co(OH)2在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物(其中Co的化合价为+2,+3),用500mL5.1mol·L-1盐酸将其恰好完全溶解,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是
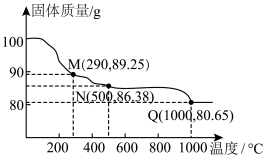

A.290℃时,固体的成分仅有 |
B.400℃时,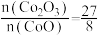 |
| C.500℃时,固体中氧元素总质量分数约为26.6% |
| D.生成的黄绿色气体可用于工业上生产“84”消毒液 |
您最近一年使用:0次
2022-07-03更新
|
571次组卷
|
4卷引用:山西省长治市2021-2022学年高二下学期期末联考化学试题
山西省长治市2021-2022学年高二下学期期末联考化学试题河北省保定市2021-2022学年高二下学期期末考试化学试题江西省南昌市第二中学2022-2023学年高三上学期第三次考试化学试题(已下线)2022年福建省高考真题变式题(选择题6-10)
5 . 工业上常用合成气(主要成分为CO、H2及少量CO2、H2O)制备甲醇,然后再利用甲醇合成其它化工产品,部分合成原理如下图所示:
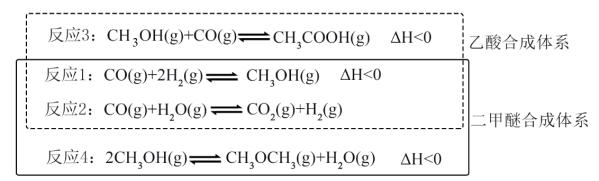
回答下列问题:
(1)反应2为副反应,为了减少该副反应的发生,提高反应1的选择性,要优先考虑_______ ,已知298K时,由稳定态单质生成1mol化合物的焓变叫该物质在此温度下的标准生成焓( )。下表为几种物质的标准生成焓,反应2的ΔH=
)。下表为几种物质的标准生成焓,反应2的ΔH=_______ kJ·mol-1
(2)500K温度下,在2L的刚性容器中充入4molCO和8molH2制备二甲醚(忽略反应2的发生),4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3)。
①从开始到平衡,反应1的v(H2)=_______ mol·L-1·min-1。
②反应4中甲醇的转化率为_______ ,反应1的平衡常数Kc=_______ 。
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH3OH混合气体只发生反应3。反应速率v正-v逆=k正·p(CO)·p(CH3OH)-k逆·p(CH3COOH),k正、k逆分别为正、逆反应的速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,当CO的转化率为20%时, =
=________ 。
(4)对于反应2(不考虑其他反应),若CO和CO2的浓度随时间发生变化的曲线如图所示。则t2时刻改变的条件可能是_______ (任写一种),若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质_________ (假设各物质状态均保持不变)。


回答下列问题:
(1)反应2为副反应,为了减少该副反应的发生,提高反应1的选择性,要优先考虑
 )。下表为几种物质的标准生成焓,反应2的ΔH=
)。下表为几种物质的标准生成焓,反应2的ΔH=| 物质 | CO2(g) | CO(g) | H2O(g) |
 (kJ·mol-1) (kJ·mol-1) | -394 | -111 | -242 |
①从开始到平衡,反应1的v(H2)=
②反应4中甲醇的转化率为
(3)在T2K、1.0×104kPa下,等物质的量的CO与CH3OH混合气体只发生反应3。反应速率v正-v逆=k正·p(CO)·p(CH3OH)-k逆·p(CH3COOH),k正、k逆分别为正、逆反应的速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,当CO的转化率为20%时,
 =
=(4)对于反应2(不考虑其他反应),若CO和CO2的浓度随时间发生变化的曲线如图所示。则t2时刻改变的条件可能是

您最近一年使用:0次
2022-06-13更新
|
533次组卷
|
2卷引用:山西省晋城市2022届高三下学期第二次模拟考试理科综合化学试题
名校
6 . 工业上制取KIO3可采用如下两种方法:
方法1:直接歧化法:将精制I2溶于过量KOH溶液,发生的反应为3I2+6KOH=KIO3+5KI+3H2O。
方法2:电解法:将直接歧化法反应后的溶液,加入阳极区,使KI转化为KIO3(I-+6OH--6e-= +3H2O),在阴极区加入KOH溶液,电解槽用水冷却。
+3H2O),在阴极区加入KOH溶液,电解槽用水冷却。

下列说法正确的是
方法1:直接歧化法:将精制I2溶于过量KOH溶液,发生的反应为3I2+6KOH=KIO3+5KI+3H2O。
方法2:电解法:将直接歧化法反应后的溶液,加入阳极区,使KI转化为KIO3(I-+6OH--6e-=
 +3H2O),在阴极区加入KOH溶液,电解槽用水冷却。
+3H2O),在阴极区加入KOH溶液,电解槽用水冷却。
下列说法正确的是
| A.方法1中,氧化剂与还原剂物质的量之比为1:2 |
| B.当外电路转移1mole-,阴极区溶液质量减少18g |
| C.电解过程中处于阴极区的电极1上会有氧气生成 |
| D.若电流利用率为100%,理论上电解法制KIO3碘原子的利用率是直接歧化法的3倍 |
您最近一年使用:0次
2022-06-13更新
|
642次组卷
|
3卷引用:山西省晋城市2022届高三下学期第二次模拟考试理科综合化学试题
7 . 镍被广泛应用于石油化工、国防、冶金、电子等多个行业,为缓解镍资源的减少、提高资源利用率,一种从废催化剂(含Ni、NiO、CuO、FeO、MgO、ZnO、Al2O3等)中提取镍并回收多种有价金属的工艺流程如图所示:

已知:①常温下,Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Ni(OH)2]=2×10-15,溶液中离子浓度≤1×10-5mol·L-1时认为该离子沉淀完全;
②ZnO是两性氧化物。
回答下列问题:
(1)废催化剂需预先球磨,其目的为____ 。
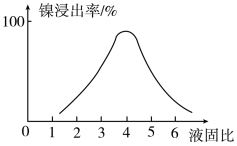
(2)“酸浸”时,硫酸溶液中所含H2SO4溶质的量一定、浸出时间和温度相同时,液固比(液固比=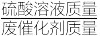 )与镍浸出率的关系如图所示。当液固比大于4:1时镍浸出率下降的原因为
)与镍浸出率的关系如图所示。当液固比大于4:1时镍浸出率下降的原因为____ 。
(3)将“焙烧”所得混合气通入水中可制得“酸浸”液,反应的化学方程式为____ ;用CuO和ZnO的混合物制备胆矾的方法为____ 。
(4)“转化Ⅱ”所得滤渣2的化学式为____ ;若滤液2中c(Ni2+)=0.2mol·L-1,则该工序需控制pH的合理范围为____ 。
(5)滤渣3的主要成分的电子式为____ 。
(6)“电沉积”时,阴极材料最适宜选用____ ,阳极的电极反应式为____ 。

已知:①常温下,Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Ni(OH)2]=2×10-15,溶液中离子浓度≤1×10-5mol·L-1时认为该离子沉淀完全;
②ZnO是两性氧化物。
回答下列问题:
(1)废催化剂需预先球磨,其目的为
(2)“酸浸”时,硫酸溶液中所含H2SO4溶质的量一定、浸出时间和温度相同时,液固比(液固比=
 )与镍浸出率的关系如图所示。当液固比大于4:1时镍浸出率下降的原因为
)与镍浸出率的关系如图所示。当液固比大于4:1时镍浸出率下降的原因为
(3)将“焙烧”所得混合气通入水中可制得“酸浸”液,反应的化学方程式为
(4)“转化Ⅱ”所得滤渣2的化学式为
(5)滤渣3的主要成分的电子式为
(6)“电沉积”时,阴极材料最适宜选用
您最近一年使用:0次
解题方法
8 . 25℃时,在c(HR)+c(R-)=0.1mol·L-1的溶液中-lgc(R-)与-lgc(OH-)、难溶盐MR饱和溶液中-lgc(R-)与-lgc(M+)的关系如图所示(忽略离子浓度调节过程中溶液体积变化)。下列说法正确的是
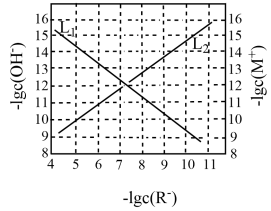

| A.曲线L1表示-lgc(R-)与-lgc(OH-)的关系 |
| B.25℃时,Ksp(MR)的数量级为10-20 |
| C.pH=7时,c(HR)+c(R-)=0.1mol·L-1的溶液中c(HR)<<c(R-) |
| D.加水稀释,两种溶液中的所有离子浓度均减小 |
您最近一年使用:0次
9 . 下列离子方程式正确的是
A. 通入冷的 通入冷的 溶液: 溶液: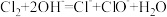 |
B.用醋酸和淀粉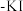 溶液检验加碘盐中的 溶液检验加碘盐中的 : :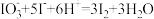 |
C. 溶液中加入 溶液中加入 产生沉淀: 产生沉淀: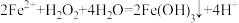 |
D. 溶液与少量的 溶液与少量的 溶液混合: 溶液混合: |
您最近一年使用:0次
2022-06-10更新
|
10928次组卷
|
22卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题2022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(11-14)(已下线)专题03 离子反应-2022年高考真题模拟题分项汇编(已下线)专题03 离子反应-三年(2020-2022)高考真题分项汇编(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第04讲 离子反应 离子方程式(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第02讲 离子反应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第02练 离子反应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题03 离子反应方程式和离子共存(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)题型10 离子方程式正误的判断山东省枣庄市第八中学南校2022-2023学年高一11月疫情返校测试(2-18班)化学试题(已下线)回归教材重难点02 离子反应、离子共存再判断-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)题型5 信息给予型离子方程式的书写-高考必备50个题型(已下线)考点02 离子反应 离子方程式(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 离子方程式与离子共存-2023年高考化学真题题源解密(新高考专用)(已下线)2019年高考海南卷化学试题变式题(不定项选择题)山东省济南市历城第二中学2023届高三上学期一轮复习验收考试化学试题河南省博爱县第一中学2023-2024学年高二上学期9月月考化学试题(已下线)第02讲 离子反应、离子方程式(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)专题08 离子反应-备战2025年高考化学真题题源解密(新高考通用)
解题方法
10 . 我国研究成果“无细胞化学酶系统催化 合成淀粉”相关论文在国际学术期刊《科学》上发表。成功利用光伏发电,将电解水获得的
合成淀粉”相关论文在国际学术期刊《科学》上发表。成功利用光伏发电,将电解水获得的 与
与 反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。回答下列问题:
反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。回答下列问题:
(1) 人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
___________ (填“>”或“<”)0。
②反应

___________ (用含 、
、 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)已知 催化加氢的主要反应如下:
催化加氢的主要反应如下:
反应I.

反应II.
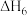
一定温度下,向1 L恒容密闭容器中充入1 mol 和2 mol
和2 mol  ,只发生反应I。当反应达到平衡后,容器内
,只发生反应I。当反应达到平衡后,容器内 (g)为0.5 mol,则
(g)为0.5 mol,则 的平衡转化率为
的平衡转化率为___________ ,反应Ⅰ的平衡常数K=___________  。
。
(3)向恒温恒压反应器中通入3 mol 、1 mol
、1 mol  气体,同时发生(2)中的反应I与反应II,
气体,同时发生(2)中的反应I与反应II, 的平衡转化率及
的平衡转化率及 的平衡产率随温度的变化关系如图a;反应I和反应II的
的平衡产率随温度的变化关系如图a;反应I和反应II的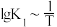 、
、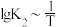 均满足如图b所示线性关系。
均满足如图b所示线性关系。___________ (填标号)达到平衡。
a.只有反应Ⅰ b.只有反应II c.反应I和反应II
②反应I的
___________ (填“>”或“<”)0。
③根据图b,确定直线A表示的反应是___________ (其“反应I”或“反应II”)
(4)230℃时,将 和
和 按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应I和反应II,容器内压强随时间的变化如下表所示。
按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应I和反应II,容器内压强随时间的变化如下表所示。
反应Ⅰ的速率可表示为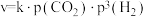 (k为常数),平衡时
(k为常数),平衡时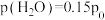 ,则反应在60min时
,则反应在60min时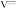
___________ (用含 、k的代数式表示)。
、k的代数式表示)。
 合成淀粉”相关论文在国际学术期刊《科学》上发表。成功利用光伏发电,将电解水获得的
合成淀粉”相关论文在国际学术期刊《科学》上发表。成功利用光伏发电,将电解水获得的 与
与 反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。回答下列问题:
反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。回答下列问题:(1)
 人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。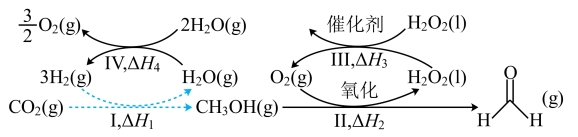

②反应


 、
、 、
、 、
、 的代数式表示)。
的代数式表示)。(2)已知
 催化加氢的主要反应如下:
催化加氢的主要反应如下:反应I.


反应II.

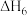
一定温度下,向1 L恒容密闭容器中充入1 mol
 和2 mol
和2 mol  ,只发生反应I。当反应达到平衡后,容器内
,只发生反应I。当反应达到平衡后,容器内 (g)为0.5 mol,则
(g)为0.5 mol,则 的平衡转化率为
的平衡转化率为 。
。(3)向恒温恒压反应器中通入3 mol
 、1 mol
、1 mol  气体,同时发生(2)中的反应I与反应II,
气体,同时发生(2)中的反应I与反应II, 的平衡转化率及
的平衡转化率及 的平衡产率随温度的变化关系如图a;反应I和反应II的
的平衡产率随温度的变化关系如图a;反应I和反应II的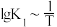 、
、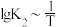 均满足如图b所示线性关系。
均满足如图b所示线性关系。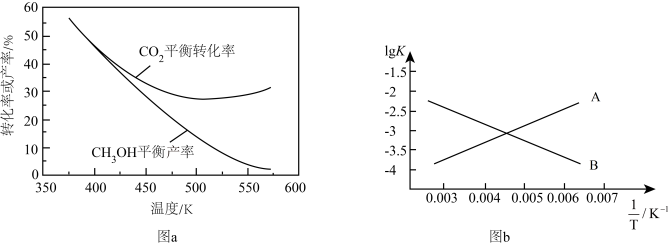
a.只有反应Ⅰ b.只有反应II c.反应I和反应II
②反应I的

③根据图b,确定直线A表示的反应是
(4)230℃时,将
 和
和 按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应I和反应II,容器内压强随时间的变化如下表所示。
按物质的量之比为1:3混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应I和反应II,容器内压强随时间的变化如下表所示。| 时间/min | 0 | 20 | 40 | 60 | 80 |
| 压强/MPa |  | 0.95 | 0.92 | 0.90 | 0.90 |
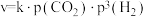 (k为常数),平衡时
(k为常数),平衡时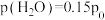 ,则反应在60min时
,则反应在60min时
 、k的代数式表示)。
、k的代数式表示)。
您最近一年使用:0次
2022-06-10更新
|
171次组卷
|
4卷引用:山西省长治市2021-2022学年高二下学期期末联考化学试题



