名校
解题方法
1 . 电子工业中,可用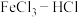 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
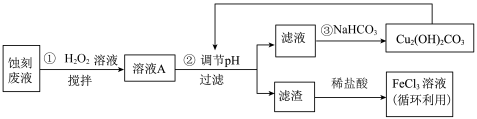
回答下列问题:
(1)把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。(填写化学式)
(2) 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是___________ 。
(3)步骤①中加入 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)___________ 。
(4)已知:生成氢氧化物沉淀的 如下表。
如下表。
根据表中数据推测调节 的范围是
的范围是___________ 。
(5)上述流程路线中,除 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是___________ 。
(6)在 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为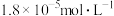 时溶液的
时溶液的 为
为___________ 。(已知 时
时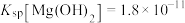 )。
)。
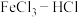 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
回答下列问题:
(1)把
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)
 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是(3)步骤①中加入
 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)(4)已知:生成氢氧化物沉淀的
 如下表。
如下表。| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
 的范围是
的范围是(5)上述流程路线中,除
 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是(6)在
 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为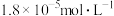 时溶液的
时溶液的 为
为 时
时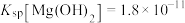 )。
)。
您最近一年使用:0次
2 .  和
和 在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
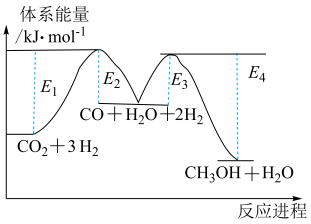
(1)25℃、100kPa二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示(25℃、100kPa)。总反应的焓变
___________  (用
(用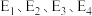 表示),写出决速步骤反应的热化学方程式
表示),写出决速步骤反应的热化学方程式___________ 。
(2)
合成总反应在起始物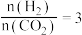 时发生反应
时发生反应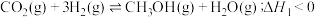 ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 条件下的
条件下的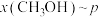 、在
、在 条件下的
条件下的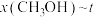 (温度)如图所示。图中对应等温过程的曲线是
(温度)如图所示。图中对应等温过程的曲线是___________ ,原因是___________ 。
(3)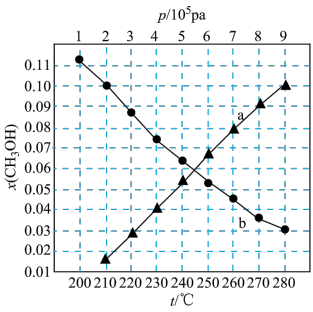
在刚性容器压强为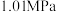 时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应:
时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应: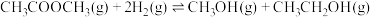 。一定温度下,以
。一定温度下,以
 的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
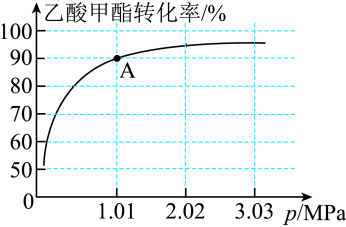
①A点时,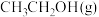 的体积分数为
的体积分数为___________ %(保留一位小数)。
②此温度下,该反应的化学平衡常数
___________  (Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
 和
和 在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:
在催化条件下制备甲醇,有利于减少温室气体系能量体二氧化碳。回答下列问题:(1)25℃、100kPa二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示(25℃、100kPa)。总反应的焓变

 (用
(用 表示),写出决速步骤反应的热化学方程式
表示),写出决速步骤反应的热化学方程式(2)

合成总反应在起始物
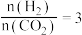 时发生反应
时发生反应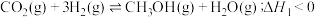 ,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在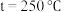 条件下的
条件下的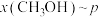 、在
、在 条件下的
条件下的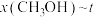 (温度)如图所示。图中对应等温过程的曲线是
(温度)如图所示。图中对应等温过程的曲线是(3)

在刚性容器压强为
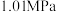 时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应:
时,乙酸甲酯与氢气也可生成甲醇,主要发生如下反应: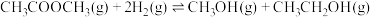 。一定温度下,以
。一定温度下,以
 的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
①A点时,
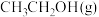 的体积分数为
的体积分数为②此温度下,该反应的化学平衡常数

 (Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
(Kp为以分压表示的平衡常数,列出计算式,不要求计算结果)。
您最近一年使用:0次
名校
解题方法
3 . 电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为___________ 。
②下列方法中,可以使醋酸稀溶液中 电离程度减小的是
电离程度减小的是___________ (填字母序号)。
a.滴加浓盐酸 b.微热溶液 c.加水稀释 d.加入醋酸钠晶体 e.加入冰醋酸
(2)用 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
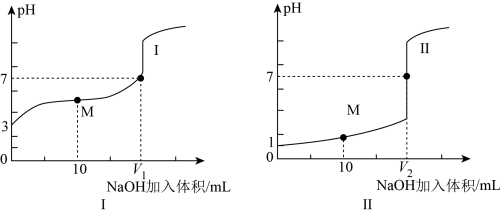
①滴定开始前,三种溶液中由水电离出的 最大的是
最大的是___________ 。
②已知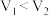 ,则滴定醋酸的曲线是
,则滴定醋酸的曲线是___________ (填“I”或“II”)。
(3)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用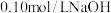 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的标志是___________ 。
②根据上述数据,可计算出该盐酸的浓度约为___________  (保留两位有效数字)。
(保留两位有效数字)。
③在上述实验中,下列操作会造成测定结果偏高的有___________ 。(填字母序号)。
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸稀溶液中
 电离程度减小的是
电离程度减小的是a.滴加浓盐酸 b.微热溶液 c.加水稀释 d.加入醋酸钠晶体 e.加入冰醋酸
(2)用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
①滴定开始前,三种溶液中由水电离出的
 最大的是
最大的是②已知
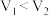 ,则滴定醋酸的曲线是
,则滴定醋酸的曲线是(3)酸碱中和滴定可用于测定酸或碱的物质的量浓度,取
 未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
未知浓度的盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用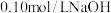 标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mo1·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 25.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
 (保留两位有效数字)。
(保留两位有效数字)。③在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点读数时俯视
B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用待测盐酸润洗
D.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
名校
4 . 下列实验方案中,不能达到相应实验目的的是
 |  |  |  |
| A.研究温度对化学平衡的影响 | B.蒸干AlCl3溶液获得AlCl3晶体 | C.测定酸碱中和的热效应 | D.碱式滴定管排气泡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 .  时,向容积为
时,向容积为 的密闭容器中充入一定量的
的密闭容器中充入一定量的 和
和 ,发生如下反应:
,发生如下反应: 。反应过程中测得的部分数据如表所示,下列说法中,不正确的是
。反应过程中测得的部分数据如表所示,下列说法中,不正确的是
 时,向容积为
时,向容积为 的密闭容器中充入一定量的
的密闭容器中充入一定量的 和
和 ,发生如下反应:
,发生如下反应: 。反应过程中测得的部分数据如表所示,下列说法中,不正确的是
。反应过程中测得的部分数据如表所示,下列说法中,不正确的是| t | 0 | 10 | 20 | 30 |
| n(CO) | 0.10 | 0.04 | 0.02 | |
| n(H2) | 0.20 | 0.04 |
A.反应在前 内的平均速率为 内的平均速率为 |
B. 时,该反应的平衡常数数值为 时,该反应的平衡常数数值为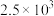 |
C.保持其他条件不变,升高温度,平衡时 ,则反应的 ,则反应的 |
D. 时,平衡时 时,平衡时 |
您最近一年使用:0次
名校
解题方法
6 . 已知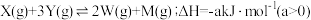 。一定温度下,在体积恒定的密闭容器中,加入
。一定温度下,在体积恒定的密闭容器中,加入 与
与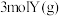 ,下列说法正确的是
,下列说法正确的是
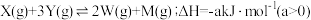 。一定温度下,在体积恒定的密闭容器中,加入
。一定温度下,在体积恒定的密闭容器中,加入 与
与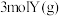 ,下列说法正确的是
,下列说法正确的是| A.升高温度,逆反应速率增大,正反应速率减小 |
| B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2 |
| C.当X的物质的量分数不再改变,表明该反应已达平衡 |
| D.反应的限度越大,说明平衡时产物所占比例越低 |
您最近一年使用:0次
名校
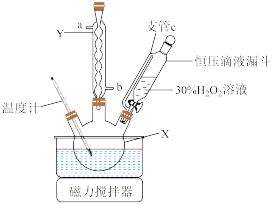
7 . 一种具有漂白、去污、杀菌、除异味等多种功能的氧系清洁产品深受人们喜爱,该氧系清洁产品的主要成分为过碳酸钠 。某兴趣小组设计实验,以工业
。某兴趣小组设计实验,以工业 (含杂质
(含杂质 )为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。
)为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。
实验步骤:
I.制备过碳酸钠。
已知:① ;
;
② 时,
时, 开始分解。
开始分解。
i.将工业碳酸钠精制除杂。
ii.向仪器X中依次加入水、 的乙醇、无水碳酸钠、鳌合剂,控制温度在
的乙醇、无水碳酸钠、鳌合剂,控制温度在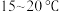 ,边搅拌边向仪器
,边搅拌边向仪器 中滴加
中滴加 的
的 溶液。
溶液。
iii.加入复合稳定剂(氯化镁和硅酸钠),搅拌一段时间。
iv.真空抽滤、干燥得纯产品,冷却称重。
(1)仪器X的名称为___________ 。
(2)支管c的作用为___________ 。仪器Y中冷凝水的出口为___________ (填“a”或“b”)。
(3)实验过程中向仪器X中滴加 的
的 溶液时不能过快,其原因是
溶液时不能过快,其原因是___________ 。
(4)加入的复合稳定剂不能过多,可能的原因是___________ (写一条)。
Ⅱ.活性氧含量测定。
i.称量 于
于 锥形瓶中,用
锥形瓶中,用 完全溶解。
完全溶解。
ii.取一支洁净的___________滴定管,润洗,装液并排气泡。
iii.用 溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗
溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗 溶液的体积)。
溶液的体积)。
iv.平行3次实验,消耗 溶液的平均体积为
溶液的平均体积为 。
。
(5)将ii和iii空白处补充完整。
ii:___________ ;
iii:___________ 。
(6)上述实验测得该样品的活性氧含量为___________ (活性氧含量即杀菌消毒时 分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量
分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量___________ (填“偏高”、“偏低”或“无影响”)。
 。某兴趣小组设计实验,以工业
。某兴趣小组设计实验,以工业 (含杂质
(含杂质 )为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。
)为原料制备过碳酸钠(装置如图,固定仪器已略去)并探究过碳酸钠的性质。实验步骤:
I.制备过碳酸钠。
已知:①
 ;
;②
 时,
时, 开始分解。
开始分解。i.将工业碳酸钠精制除杂。
ii.向仪器X中依次加入水、
 的乙醇、无水碳酸钠、鳌合剂,控制温度在
的乙醇、无水碳酸钠、鳌合剂,控制温度在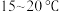 ,边搅拌边向仪器
,边搅拌边向仪器 中滴加
中滴加 的
的 溶液。
溶液。iii.加入复合稳定剂(氯化镁和硅酸钠),搅拌一段时间。

iv.真空抽滤、干燥得纯产品,冷却称重。
(1)仪器X的名称为
(2)支管c的作用为
(3)实验过程中向仪器X中滴加
 的
的 溶液时不能过快,其原因是
溶液时不能过快,其原因是(4)加入的复合稳定剂不能过多,可能的原因是
Ⅱ.活性氧含量测定。
i.称量
 于
于 锥形瓶中,用
锥形瓶中,用 完全溶解。
完全溶解。ii.取一支洁净的___________滴定管,润洗,装液并排气泡。
iii.用
 溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗
溶液滴定样品溶液,至___________,达到滴定终点,记录数据(消耗 溶液的体积)。
溶液的体积)。iv.平行3次实验,消耗
 溶液的平均体积为
溶液的平均体积为 。
。(5)将ii和iii空白处补充完整。
ii:
iii:
(6)上述实验测得该样品的活性氧含量为
 分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量
分解产生的氧气质量占过碳酸钠的质量分数);若滴定前未对滴定管进行润洗,则测得该样品的活性氧含量
您最近一年使用:0次
名校
解题方法
8 . 镍铜合金是由 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。
(1)基态 和基态
和基态 的未成对电子数之比为
的未成对电子数之比为___________ 。
(2) 与
与 的第二电离能较大的是
的第二电离能较大的是___________ (填化学式),主要原因是___________ 。
(3)某种铜的氧化物的立方晶胞结构如图所示,其中 原子位于小正方体的体心。
原子位于小正方体的体心。
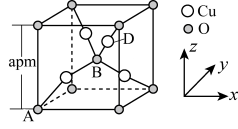
①该铜的氧化物的化学式为___________ ;该晶体结构与 晶体相似,用
晶体相似,用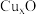 四面体占据
四面体占据 晶体中的
晶体中的 所占位置,则
所占位置,则 所占位置由
所占位置由___________ (填元素符号)原子占据。已知: 的分数坐标依次为
的分数坐标依次为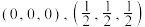 ,则
,则 的分数坐标为
的分数坐标为___________ 。
②已知:该晶体的晶胞边长为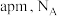 是阿伏加德罗常数的值,则晶胞中
是阿伏加德罗常数的值,则晶胞中 原子的最短距离为
原子的最短距离为___________  ,晶体的密度为
,晶体的密度为___________ (填含 的表达式)
的表达式) 。
。
 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐腐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。(1)基态
 和基态
和基态 的未成对电子数之比为
的未成对电子数之比为(2)
 与
与 的第二电离能较大的是
的第二电离能较大的是(3)某种铜的氧化物的立方晶胞结构如图所示,其中
 原子位于小正方体的体心。
原子位于小正方体的体心。
①该铜的氧化物的化学式为
 晶体相似,用
晶体相似,用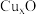 四面体占据
四面体占据 晶体中的
晶体中的 所占位置,则
所占位置,则 所占位置由
所占位置由 的分数坐标依次为
的分数坐标依次为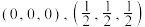 ,则
,则 的分数坐标为
的分数坐标为②已知:该晶体的晶胞边长为
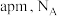 是阿伏加德罗常数的值,则晶胞中
是阿伏加德罗常数的值,则晶胞中 原子的最短距离为
原子的最短距离为 ,晶体的密度为
,晶体的密度为 的表达式)
的表达式) 。
。
您最近一年使用:0次
名校
解题方法
9 . 碱式氧化镍( )可作镍电池的正极材料,现用某含镍废料(含
)可作镍电池的正极材料,现用某含镍废料(含 及少量的
及少量的 )来制备碱式氧化镍,其工艺流程如图:
)来制备碱式氧化镍,其工艺流程如图:
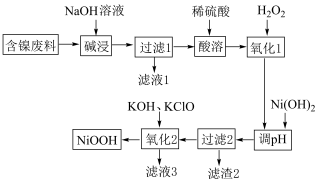
回答下列问题:
(1) 属于
属于___________ 晶体,“碱浸”前将含镍废料粉碎的目的是___________ 。
(2)“碱浸”过程中发生反应的化学方程式是___________ 、___________ 。
(3)用文字说明加入 的目的:
的目的:___________ ;查阅资料得知实际生产中 的用量比理论用量多,试分析其可能的原因:
的用量比理论用量多,试分析其可能的原因:___________ (填一条即可)。
(4)“氧化2”中发生反应的离子方程式为___________ 。
(5)丁二酮肟检验 时生成物质
时生成物质 (结构如图),
(结构如图), 的结构中存在的作用力为
的结构中存在的作用力为___________ (填标号)。
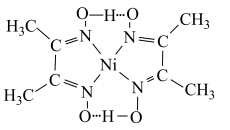
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
 )可作镍电池的正极材料,现用某含镍废料(含
)可作镍电池的正极材料,现用某含镍废料(含 及少量的
及少量的 )来制备碱式氧化镍,其工艺流程如图:
)来制备碱式氧化镍,其工艺流程如图:
回答下列问题:
(1)
 属于
属于(2)“碱浸”过程中发生反应的化学方程式是
(3)用文字说明加入
 的目的:
的目的: 的用量比理论用量多,试分析其可能的原因:
的用量比理论用量多,试分析其可能的原因:(4)“氧化2”中发生反应的离子方程式为
(5)丁二酮肟检验
 时生成物质
时生成物质 (结构如图),
(结构如图), 的结构中存在的作用力为
的结构中存在的作用力为
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
您最近一年使用:0次
名校
10 . a、b、c、d、e、f、g是元素周期表前四周期中的元素,且原子序数依次增大,部分元素的相关信息如表所示。
请回答下列问题:
(1) 在元素周期表中的
在元素周期表中的___________ (填“s”、“p”、“d”或“ ”)区,写出基态
”)区,写出基态 原子的轨道表示式:
原子的轨道表示式:___________ 。
(2)a、b、c的最简单氢化物的沸点由高到低的顺序为___________ (用化学式表示)。
(3)从微观角度分析:为什么 单质的熔、沸点高于
单质的熔、沸点高于 单质的熔、沸点?
单质的熔、沸点?___________ 。
(4)a、b、c三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(5) 常温下呈液态,熔点为
常温下呈液态,熔点为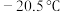 ,沸点为
,沸点为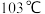 ,易溶于非极性溶剂,
,易溶于非极性溶剂,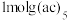 中含有
中含有___________  键,中心原子
键,中心原子 的杂化方式为
的杂化方式为___________ (填标号)。
A. 杂化 B.
杂化 B. 杂化 C.
杂化 C. 杂化 D.
杂化 D. 杂化
杂化
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素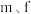 形成的化合物在气态时有单体
形成的化合物在气态时有单体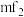 和二聚体
和二聚体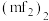 ,在晶体中便形成多聚体
,在晶体中便形成多聚体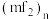 。其中二聚体
。其中二聚体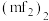 和多聚体
和多聚体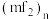 的结构如图所示:
的结构如图所示:
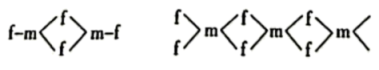
则在二聚体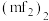 和多聚体
和多聚体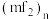 中
中 原子的杂化轨道类型依次为
原子的杂化轨道类型依次为___________ ,单体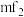 空间结构为
空间结构为___________ 形。
 | 核外电子总数等于 的最外层电子数 的最外层电子数 |
 | 基态原子中 电子总数与 电子总数与 电子总数相等 电子总数相等 |
 | 短周期元素中金属性最强的元素 |
 | 基态原子价层电子排布式为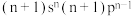 |
 | 基态原子的最外层 轨道有2个电子的自旋状态与其他电子的自旋状态相反 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
 | 其单质是生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(1)
 在元素周期表中的
在元素周期表中的 ”)区,写出基态
”)区,写出基态 原子的轨道表示式:
原子的轨道表示式:(2)a、b、c的最简单氢化物的沸点由高到低的顺序为
(3)从微观角度分析:为什么
 单质的熔、沸点高于
单质的熔、沸点高于 单质的熔、沸点?
单质的熔、沸点?(4)a、b、c三种元素的电负性由高到低的排列次序为
(5)
 常温下呈液态,熔点为
常温下呈液态,熔点为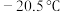 ,沸点为
,沸点为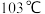 ,易溶于非极性溶剂,
,易溶于非极性溶剂,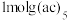 中含有
中含有 键,中心原子
键,中心原子 的杂化方式为
的杂化方式为A.
 杂化 B.
杂化 B. 杂化 C.
杂化 C. 杂化 D.
杂化 D. 杂化
杂化(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素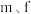 形成的化合物在气态时有单体
形成的化合物在气态时有单体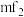 和二聚体
和二聚体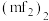 ,在晶体中便形成多聚体
,在晶体中便形成多聚体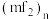 。其中二聚体
。其中二聚体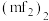 和多聚体
和多聚体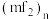 的结构如图所示:
的结构如图所示: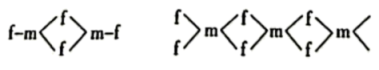
则在二聚体
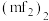 和多聚体
和多聚体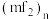 中
中 原子的杂化轨道类型依次为
原子的杂化轨道类型依次为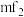 空间结构为
空间结构为
您最近一年使用:0次



