1 . 下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)可以证明醋酸是弱酸的事实是_____ (填字母序号)
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与 溶液反应放出
溶液反应放出 气体
气体
D. 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色
E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸是_____ (用化学式表示)。
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是_____ 。
A.升高温度 B.加水稀释 C.加少量的 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_____ 。
(3)已知水溶液中 和
和 的关系如图所示:
的关系如图所示:
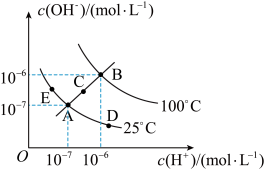
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是_____ 。
②若A点到E点,可采用的措施是_____ (填序号,下同);促进水的电离平衡正向移动的措施是_____ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的 浓度为
浓度为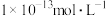 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是_____ 。
a. 、
、 、
、 、
、 b.
b. 、
、 、
、 、
、
c. 、
、 、
、 、
、 d.
d. 、
、 、
、 、
、
e. 、
、 、
、 、
、
| 酸 |  |  | HCN | HClO |
电离平衡常数( ) ) |  |  | 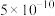 |  |
(1)可以证明醋酸是弱酸的事实是
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与
 溶液反应放出
溶液反应放出 气体
气体D.
 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸是
②下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加水稀释 C.加少量的
 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知水溶液中
 和
和 的关系如图所示:
的关系如图所示:
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是
②若A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的
 浓度为
浓度为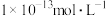 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是a.
 、
、 、
、 、
、 b.
b. 、
、 、
、 、
、
c.
 、
、 、
、 、
、 d.
d. 、
、 、
、 、
、
e.
 、
、 、
、 、
、
您最近一年使用:0次
2 . Ⅰ.
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水放出热量222.5kJ,则甲烷燃烧的热化学方程式为_____ 。
(2)已知:
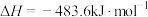 ,查阅文献资料,化学键的键能如下表:
,查阅文献资料,化学键的键能如下表:
氨分解反应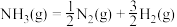 的活化能
的活化能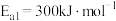 ,则合成氨反应
,则合成氨反应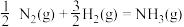 的活化能
的活化能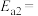
_____  。
。
Ⅱ.氨在国民经济生产中占有重要地位。下图是合成氨的简要流程和反应方程式:

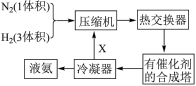
(3)图中X是_____ ,这样操作的目的是_____ 。
(4)T℃时在容积为2L的密闭恒容容器中充入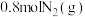 和
和 ,5min后达到平衡,测得
,5min后达到平衡,测得 的浓度为0.2mol/L。
的浓度为0.2mol/L。
①计算此段时间的反应速率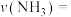
_____ 。
②若向平衡后的体系中同时加入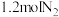 、
、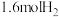 、
、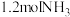 ,平衡将
,平衡将_____ (填“正向移动”、“不移动”或“逆向移动”)。
(5)下列措施可提高 平衡转化率的是
平衡转化率的是_____ (填序号)。
a.恒容时充入 ,使体系总压强增大 b.恒容时将
,使体系总压强增大 b.恒容时将 从体系中分离
从体系中分离
c.恒容时充入He,使体系总压强增大 d.加入合适的催化剂
(6)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在低温、常压、光照条件下, 在催化剂(掺有少量
在催化剂(掺有少量 的
的 )表面与水发生反应:
)表面与水发生反应: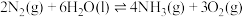
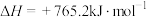 。进一步研究
。进一步研究 生成量与温度的关系,部分实验数据见下表(光照、压强
生成量与温度的关系,部分实验数据见下表(光照、压强 、反应时间3h):
、反应时间3h):
当温度高于323K时, 的生成量反而降低的可能原因是
的生成量反而降低的可能原因是_____ 。
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水放出热量222.5kJ,则甲烷燃烧的热化学方程式为
(2)已知:

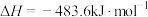 ,查阅文献资料,化学键的键能如下表:
,查阅文献资料,化学键的键能如下表:| 化学键 | H-H键 | N≡N键 | N-H键 |
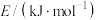 | 436 | 946 | 391 |
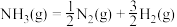 的活化能
的活化能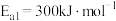 ,则合成氨反应
,则合成氨反应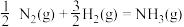 的活化能
的活化能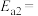
 。
。Ⅱ.氨在国民经济生产中占有重要地位。下图是合成氨的简要流程和反应方程式:



(3)图中X是
(4)T℃时在容积为2L的密闭恒容容器中充入
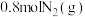 和
和 ,5min后达到平衡,测得
,5min后达到平衡,测得 的浓度为0.2mol/L。
的浓度为0.2mol/L。①计算此段时间的反应速率
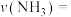
②若向平衡后的体系中同时加入
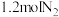 、
、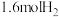 、
、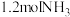 ,平衡将
,平衡将(5)下列措施可提高
 平衡转化率的是
平衡转化率的是a.恒容时充入
 ,使体系总压强增大 b.恒容时将
,使体系总压强增大 b.恒容时将 从体系中分离
从体系中分离c.恒容时充入He,使体系总压强增大 d.加入合适的催化剂
(6)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在低温、常压、光照条件下,
 在催化剂(掺有少量
在催化剂(掺有少量 的
的 )表面与水发生反应:
)表面与水发生反应: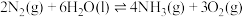
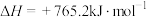 。进一步研究
。进一步研究 生成量与温度的关系,部分实验数据见下表(光照、压强
生成量与温度的关系,部分实验数据见下表(光照、压强 、反应时间3h):
、反应时间3h):| T/K | 303 | 313 | 323 | 353 |
 生成量 生成量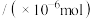 | 4.8 | 5.9 | 6.0 | 2.0 |
 的生成量反而降低的可能原因是
的生成量反而降低的可能原因是
您最近一年使用:0次
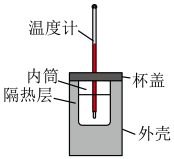
3 . 用如图所示的装置测定中和反应反应热。
实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。
已知弱碱电离时吸热。回答下列问题。
(1)从实验装置上看,还缺少_____ ,其能否用铜质材料替代?_____ (填“能”或“不能”),理由是_____ 。
(2)装置中隔热层的作用是_____ 。
(3)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下:
,测得温度如下:
①两组实验结果存在差异的原因是_____ 。
②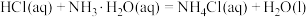 的
的
_____ (保留一位小数)。
③某同学利用上述装置重新做甲组实验,测得反应热 偏大,则可能的原因是
偏大,则可能的原因是_____ (填序号)。
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____ (填“相等”“不相等”),若实验操作均正确,则所求中和热_____ (填“相等”“不相等”)。

实验药品:100mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液、50mL0.50mol/L氨水。
已知弱碱电离时吸热。回答下列问题。
(1)从实验装置上看,还缺少
(2)装置中隔热层的作用是
(3)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下:
,测得温度如下:| 反应物 | 起始温度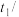 ℃ ℃ | 最高温度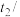 ℃ ℃ |
| 甲组(HCl+NaOH) | 15.0 | 18.3 |
乙组( ) ) | 15.0 | 18.1 |
②
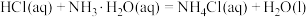 的
的
③某同学利用上述装置重新做甲组实验,测得反应热
 偏大,则可能的原因是
偏大,则可能的原因是A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
④若实验中若改用60mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
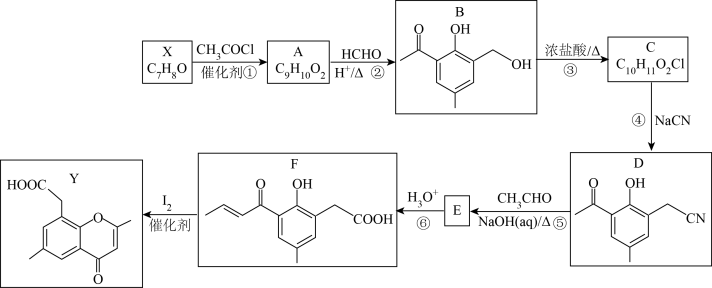
4 . 有机化合物Y有抗菌作用,也是一种医药中间体,由X合成Y的路线图如下:
已知:①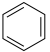
 +HCl
+HCl
②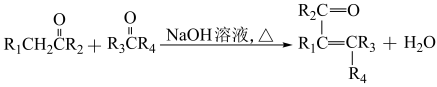
③
请回答下列问题:
(1)根据系统命名法,X的名称为__________________ 。
(2)A中的含氧官能团的名称为______________ ,②和④的反应类型分别为_______________ 。
(3)检验C中官能团Cl所用试剂有稀HNO3和_______________ 。
(4)F在一定条件下,能发生加聚反应,其反应方程式为_______________ 。
(5)G是比D少2个“-CH2-”的同分异构体,同时满足下列条件的G的结构为______________ (不考虑立体异构)。
①结构中含有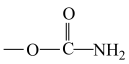 ,只有1个苯环,无其他环状结构。
,只有1个苯环,无其他环状结构。
②核磁共振氢谱中有4组吸收峰,且峰面积之比为2:2:2:1。
(6)参照上述合成路线和信息,以CH3CH2CH(OH)COC1和有机物X为原料(无机试剂任选),设计制备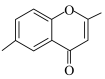 的合成路线
的合成路线_______________ 。

已知:①

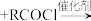
 +HCl
+HCl②
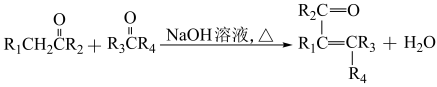
③

请回答下列问题:
(1)根据系统命名法,X的名称为
(2)A中的含氧官能团的名称为
(3)检验C中官能团Cl所用试剂有稀HNO3和
(4)F在一定条件下,能发生加聚反应,其反应方程式为
(5)G是比D少2个“-CH2-”的同分异构体,同时满足下列条件的G的结构为
①结构中含有
 ,只有1个苯环,无其他环状结构。
,只有1个苯环,无其他环状结构。②核磁共振氢谱中有4组吸收峰,且峰面积之比为2:2:2:1。
(6)参照上述合成路线和信息,以CH3CH2CH(OH)COC1和有机物X为原料(无机试剂任选),设计制备
 的合成路线
的合成路线
您最近一年使用:0次
解题方法
5 . 某废镍催化剂的主要成分是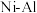 合金,还含有少量
合金,还含有少量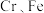 及不溶于酸碱的有机物。采用如下工艺流程回收其中的镍制备镍的氧化物
及不溶于酸碱的有机物。采用如下工艺流程回收其中的镍制备镍的氧化物 :
:
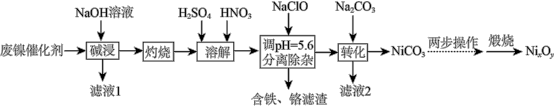
回答下列问题:
(1)“碱浸”所得“滤液1”的主要溶质为 、
、_______ ,“灼烧”的目的是_______ 。
(2)“溶解”后的溶液中,所含金属离子有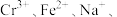
_______ 、_______ 。
(3)“分离除杂”中,发生氧化还原反应生成含铁滤渣的离子方程式为_______ 。
(4)“煅烧”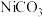 滤渣前需进行的两步操作是
滤渣前需进行的两步操作是_______ 。
(5)在空气中煅烧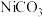 ,其热重曲线如图所示。
,其热重曲线如图所示。 转化为
转化为 ,反应的化学方程式为
,反应的化学方程式为_______ 。

(6)利用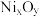 制得
制得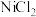 溶液,调节其pH至7.5~12,采用惰性电极进行电解,阳极上可沉淀出用作锌镍电池正极材料的
溶液,调节其pH至7.5~12,采用惰性电极进行电解,阳极上可沉淀出用作锌镍电池正极材料的 。电解时阳极的电极反应式为
。电解时阳极的电极反应式为_______ 。
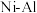 合金,还含有少量
合金,还含有少量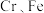 及不溶于酸碱的有机物。采用如下工艺流程回收其中的镍制备镍的氧化物
及不溶于酸碱的有机物。采用如下工艺流程回收其中的镍制备镍的氧化物 :
:
回答下列问题:
(1)“碱浸”所得“滤液1”的主要溶质为
 、
、(2)“溶解”后的溶液中,所含金属离子有
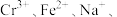
(3)“分离除杂”中,发生氧化还原反应生成含铁滤渣的离子方程式为
(4)“煅烧”
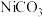 滤渣前需进行的两步操作是
滤渣前需进行的两步操作是(5)在空气中煅烧
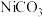 ,其热重曲线如图所示。
,其热重曲线如图所示。 转化为
转化为 ,反应的化学方程式为
,反应的化学方程式为
(6)利用
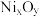 制得
制得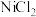 溶液,调节其pH至7.5~12,采用惰性电极进行电解,阳极上可沉淀出用作锌镍电池正极材料的
溶液,调节其pH至7.5~12,采用惰性电极进行电解,阳极上可沉淀出用作锌镍电池正极材料的 。电解时阳极的电极反应式为
。电解时阳极的电极反应式为
您最近一年使用:0次
解题方法
6 . 有机化合物性质多样,下列说法正确的是
| A.酸性条件下,植物油的水解产物所含官能团相同 |
| B.甲苯能发生加成反应,但不能发生取代反应 |
| C.用饱和碳酸钠溶液可以鉴别乙醇和乙酸乙酯 |
D.环成烯(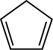 )分子中所有碳原子共平面 )分子中所有碳原子共平面 |
您最近一年使用:0次
解题方法
7 . 2023年7月1日我国开始实施“国六b”标准,研究汽车尾气中 等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用
等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用 将NO氧化为高价态氮氧化物
将NO氧化为高价态氮氧化物 ,反应机理如下:
,反应机理如下:
i)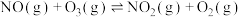
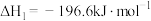
ii)
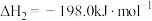
(1)已知反应i的正反应活化能为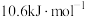 ,则其逆反应的活化能为
,则其逆反应的活化能为_______ 。
(2)在一恒温恒容的容器中发生上述反应i、ii,若增大 的浓度,NO的转化率
的浓度,NO的转化率_______ (填“增大”、“减小”或“不变”);保持恒温恒容,下列描述能说明反应已达到平衡的是_______ 。
A.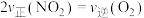
B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中NO与 的物质的量之比为
的物质的量之比为
D.容器中气体的总压强不随时间而变化
(3)将NO、 充入恒容密闭容器中,起始时浓度均为
充入恒容密闭容器中,起始时浓度均为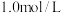 ,若只发生反应i,反应速率
,若只发生反应i,反应速率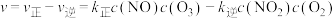 ,其中
,其中 、
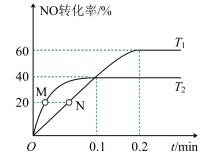
、 只与温度及活化能有关,下图是温度为
只与温度及活化能有关,下图是温度为 、
、 时,
时,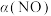 随时间变化图。
随时间变化图。 温度下,
温度下,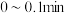 ,反应的平均速率
,反应的平均速率
_______ ,若加入正催化剂, 和
和 均
均_______ (填“变大”、“变小”或“不变”)。M点与N点对应的 的大小关系:M
的大小关系:M_______ N(填“>”、“<”或“=”),N点时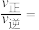
_______ 。
(4)用惰性电极电解食盐水对烟气脱氮,将含NO的烟气通入电解池,其中NO被阳极产生的 氧化为
氧化为 ,则电解池中发生的总的离子反应方程式为
,则电解池中发生的总的离子反应方程式为_______ ;对于任何反应,当 时该反应为自发反应,已知该总反应的
时该反应为自发反应,已知该总反应的 ,则该反应在
,则该反应在_______ (填“高温”或“低温”)下能自发进行。
 等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用
等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用 将NO氧化为高价态氮氧化物
将NO氧化为高价态氮氧化物 ,反应机理如下:
,反应机理如下:i)
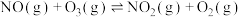
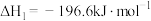
ii)

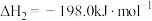
(1)已知反应i的正反应活化能为
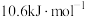 ,则其逆反应的活化能为
,则其逆反应的活化能为(2)在一恒温恒容的容器中发生上述反应i、ii,若增大
 的浓度,NO的转化率
的浓度,NO的转化率A.
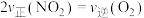
B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中NO与
 的物质的量之比为
的物质的量之比为
D.容器中气体的总压强不随时间而变化
(3)将NO、
 充入恒容密闭容器中,起始时浓度均为
充入恒容密闭容器中,起始时浓度均为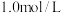 ,若只发生反应i,反应速率
,若只发生反应i,反应速率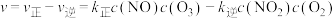 ,其中
,其中 、
、 只与温度及活化能有关,下图是温度为
只与温度及活化能有关,下图是温度为 、
、 时,
时,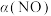 随时间变化图。
随时间变化图。 温度下,
温度下,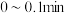 ,反应的平均速率
,反应的平均速率
 和
和 均
均 的大小关系:M
的大小关系:M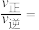

(4)用惰性电极电解食盐水对烟气脱氮,将含NO的烟气通入电解池,其中NO被阳极产生的
 氧化为
氧化为 ,则电解池中发生的总的离子反应方程式为
,则电解池中发生的总的离子反应方程式为 时该反应为自发反应,已知该总反应的
时该反应为自发反应,已知该总反应的 ,则该反应在
,则该反应在
您最近一年使用:0次
2024-03-28更新
|
102次组卷
|
3卷引用:四川省眉山市高中2023-2024学年高三上学期第一次诊断性考试理科综合试题
解题方法
8 .  是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
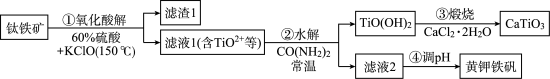
,并回收铁制备难溶于水的黄钾铁矾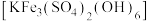 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
(1) 中Ti的化合价为
中Ti的化合价为_______ 。
(2)步骤①滤渣1的主要成分是_______ ,若氧化酸解的氧化剂用 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为_______ ,相同条件下,用 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是_______ 。
(3)已知 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为_______ ;常温下,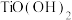
 为
为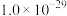 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为_______ 。
(4)步骤③反应的化学方程式为_______ ,若在实验室煅烧,用到的实验仪器除了玻璃棒、酒精灯、三脚架及泥三角外,还需要_______ 。
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
 是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾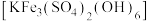 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
| 物质 | 纯碱(99% ) ) | 氢氧化钾(90% ) ) | 碳酸钾(99% ) ) | 液氨(99.9%) |
| 价格(元/吨) | 1800 | 4000 | 4500 | 25000 |
 中Ti的化合价为
中Ti的化合价为(2)步骤①滤渣1的主要成分是
 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是(3)已知
 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为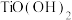
 为
为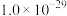 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为(4)步骤③反应的化学方程式为
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
A. | B. | C. | D. |
您最近一年使用:0次
2024-03-28更新
|
120次组卷
|
3卷引用:四川省眉山市高中2023-2024学年高三上学期第一次诊断性考试理科综合试题
解题方法
9 . 伊贝沙坦是一种新型的抗高血压药物,环戊酮是合成伊贝沙坦的中间体,实验室以如下图装置制备环戊酮(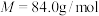 ,加热及夹持装置已省略),其反应原理:
,加热及夹持装置已省略),其反应原理: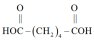

 +CO2↑+H2O。已知:己二酸(M=
+CO2↑+H2O。已知:己二酸(M=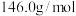 熔点为152℃,330℃左右能升华并开始分解;环戊酮沸点131℃,着火点30℃。
熔点为152℃,330℃左右能升华并开始分解;环戊酮沸点131℃,着火点30℃。
步骤如下:
I.将 己二酸和适量
己二酸和适量 置于如图仪器a中,维持温度285~290℃,加热20分钟;
置于如图仪器a中,维持温度285~290℃,加热20分钟;
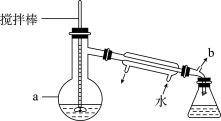
Ⅱ.在馏出液中加入适量的 浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入
浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入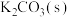 ,振荡分离出有机层;
,振荡分离出有机层;
Ⅲ.组装蒸馏装置,对Ⅱ所得有机层进行蒸馏,收集128~131℃的馏分,称量获得产品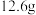 ,计算产率。
,计算产率。
回答下列问题:
(1)仪器a的名称为_______ 。
(2)步骤I加热的最佳方式是_______ (选填“熔融的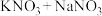 盐浴”、“自来水水浴”或“酒精灯直接加热”);用导管连接b并通向户外,“通向户外”的主要目的是
盐浴”、“自来水水浴”或“酒精灯直接加热”);用导管连接b并通向户外,“通向户外”的主要目的是_______ 。
(3)步骤Ⅲ蒸馏有机层时温度计球泡位置应在_______ 。
(4)步骤Ⅱ中第一次加入 的作用是减小环戊酮的溶解性及
的作用是减小环戊酮的溶解性及_______ ,第二次加入 的作用是
的作用是_______ 。
(5)环戊酮的产率为_______ (结果保留3位有效数字),如果步骤I温度高于330℃,会导致产率_______ (填“升高”、“降低”或“无影响”)。
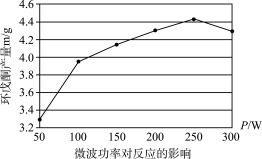
(6)微波辐射具有很高的加热效率,下图表示某研究人员探究相同时间、相同反应条件下微波功率对环戊酮产量的影响。由图可知,微波辐射的最佳功率为_______ W。
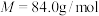 ,加热及夹持装置已省略),其反应原理:
,加热及夹持装置已省略),其反应原理:

 +CO2↑+H2O。已知:己二酸(M=
+CO2↑+H2O。已知:己二酸(M=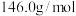 熔点为152℃,330℃左右能升华并开始分解;环戊酮沸点131℃,着火点30℃。
熔点为152℃,330℃左右能升华并开始分解;环戊酮沸点131℃,着火点30℃。步骤如下:
I.将
 己二酸和适量
己二酸和适量 置于如图仪器a中,维持温度285~290℃,加热20分钟;
置于如图仪器a中,维持温度285~290℃,加热20分钟;
Ⅱ.在馏出液中加入适量的
 浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入
浓溶液,振荡锥形瓶、分液除去水层;将有机层转移至干燥锥形瓶,再次加入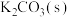 ,振荡分离出有机层;
,振荡分离出有机层;Ⅲ.组装蒸馏装置,对Ⅱ所得有机层进行蒸馏,收集128~131℃的馏分,称量获得产品
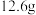 ,计算产率。
,计算产率。回答下列问题:
(1)仪器a的名称为
(2)步骤I加热的最佳方式是
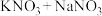 盐浴”、“自来水水浴”或“酒精灯直接加热”);用导管连接b并通向户外,“通向户外”的主要目的是
盐浴”、“自来水水浴”或“酒精灯直接加热”);用导管连接b并通向户外,“通向户外”的主要目的是(3)步骤Ⅲ蒸馏有机层时温度计球泡位置应在
(4)步骤Ⅱ中第一次加入
 的作用是减小环戊酮的溶解性及
的作用是减小环戊酮的溶解性及 的作用是
的作用是(5)环戊酮的产率为
(6)微波辐射具有很高的加热效率,下图表示某研究人员探究相同时间、相同反应条件下微波功率对环戊酮产量的影响。由图可知,微波辐射的最佳功率为

您最近一年使用:0次
2024-03-28更新
|
205次组卷
|
3卷引用:四川省眉山市高中2023-2024学年高三上学期第一次诊断性考试理科综合试题
解题方法
10 . 某合金基体是铁碳合金,还含有一定量的Cr、Ni、Cu、C等元素。回答下列问题:
(1)基态碳原子核外电子所处的最高能层符号为_______ ,基态 的外围电子排布图为
的外围电子排布图为_______ 。
(2)六羰基铬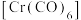 中
中 键和
键和 键的个数比为
键的个数比为_______ ,与CO互为等电子体的是_______ 。
A. B.
B.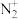 C.
C.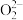 D.
D. E.
E.
(3)完成下列含碳化合物相关分析: 杂化的碳原子有
杂化的碳原子有_______ 个。 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。_______ (填“能”或“不能”)计算出Cu原子的第一电离能, 的晶格能为
的晶格能为_______  。
。
(5) 的晶胞结构如图所示,A的原子坐标参数为
的晶胞结构如图所示,A的原子坐标参数为 ,B为
,B为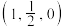 ,则C的原子坐标为
,则C的原子坐标为_______ ;已知该晶体的密度为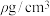 ,
, 和
和 的半径分别为
的半径分别为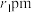 和
和 ,
, 代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为
代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为_______ (用代数式表示)。
(1)基态碳原子核外电子所处的最高能层符号为
 的外围电子排布图为
的外围电子排布图为(2)六羰基铬
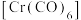 中
中 键和
键和 键的个数比为
键的个数比为A.
 B.
B.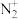 C.
C.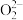 D.
D. E.
E.
(3)完成下列含碳化合物相关分析:
A.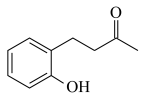 B.
B.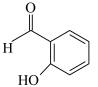
 杂化的碳原子有
杂化的碳原子有②B的沸点低于对羟基苯甲醛( )的沸点,其原因是
)的沸点,其原因是
 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。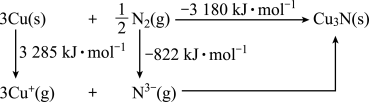
 的晶格能为
的晶格能为 。
。(5)
 的晶胞结构如图所示,A的原子坐标参数为
的晶胞结构如图所示,A的原子坐标参数为 ,B为
,B为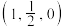 ,则C的原子坐标为
,则C的原子坐标为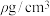 ,
, 和
和 的半径分别为
的半径分别为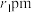 和
和 ,
, 代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为
代表阿伏加德罗常数的值,则该晶胞中离子的空间利用率为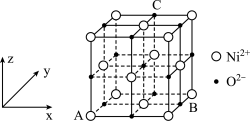
您最近一年使用:0次
2024-03-26更新
|
224次组卷
|
3卷引用:四川省眉山市高中2023-2024学年高三上学期第一次诊断性考试理科综合试题



