1 . 氮化镓( )、碳化硅(
)、碳化硅( )材料是最成熟的第三代半导体的代表,
)材料是最成熟的第三代半导体的代表, 通常以
通常以 为镓源,
为镓源, 为氮源制备,具有出色的抗击穿能力,能耐受更高的电子密度。
为氮源制备,具有出色的抗击穿能力,能耐受更高的电子密度。
(1)离子晶体 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为_____ 。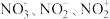 的键角由大到小的顺序是
的键角由大到小的顺序是_____ 。
(2)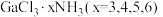 是一系列化合物,向含
是一系列化合物,向含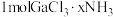 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2.
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2.
① 的
的 模型名称为
模型名称为_____ 。
②能准确表示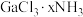 结构的化学式为
结构的化学式为_____ 。
(3)与镓同主族的B具有缺电子性,硼砂(四硼酸钠)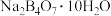 中
中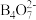 是由两个
是由两个 和两个
和两个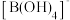 缩合而成的双六元环,应写成
缩合而成的双六元环,应写成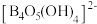 的形式,结构如图所示,则该离子存在的作用力含有
的形式,结构如图所示,则该离子存在的作用力含有_____ (填标号),B原子的杂化方式为_____ 。
(4) 也可采用
也可采用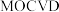 (金属有机物化学气相淀积)技术制得:以合成的
(金属有机物化学气相淀积)技术制得:以合成的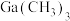 为原料,使其与
为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为
和另一种产物,该过程的化学方程式为_____ 。
(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度: ,则下列物质酸性由强到弱的顺序是
,则下列物质酸性由强到弱的顺序是_____ (填序号)。
A. B.
B. C.
C. D.
D.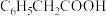
 )、碳化硅(
)、碳化硅( )材料是最成熟的第三代半导体的代表,
)材料是最成熟的第三代半导体的代表, 通常以
通常以 为镓源,
为镓源, 为氮源制备,具有出色的抗击穿能力,能耐受更高的电子密度。
为氮源制备,具有出色的抗击穿能力,能耐受更高的电子密度。(1)离子晶体
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为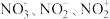 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
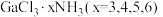 是一系列化合物,向含
是一系列化合物,向含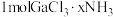 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2.
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2.①
 的
的 模型名称为
模型名称为②能准确表示
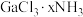 结构的化学式为
结构的化学式为(3)与镓同主族的B具有缺电子性,硼砂(四硼酸钠)
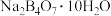 中
中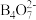 是由两个
是由两个 和两个
和两个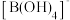 缩合而成的双六元环,应写成
缩合而成的双六元环,应写成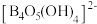 的形式,结构如图所示,则该离子存在的作用力含有
的形式,结构如图所示,则该离子存在的作用力含有
(4)
 也可采用
也可采用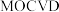 (金属有机物化学气相淀积)技术制得:以合成的
(金属有机物化学气相淀积)技术制得:以合成的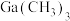 为原料,使其与
为原料,使其与 发生系列反应得到
发生系列反应得到 和另一种产物,该过程的化学方程式为
和另一种产物,该过程的化学方程式为(5)键的极性对物质的化学性质有重要影响。已知一些常见电子基团的吸电子效应的强度:
 ,则下列物质酸性由强到弱的顺序是
,则下列物质酸性由强到弱的顺序是A.
 B.
B. C.
C. D.
D.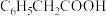
您最近一年使用:0次
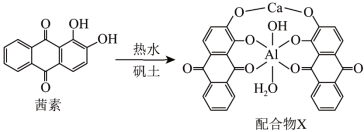
2 . 特比萘芬可用于皮肤浅部真菌感染的治疗。以下为其合成路线之一、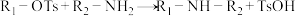 。
。
回答下列问题:
(1)化合物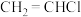 的化学名称为
的化学名称为___________ ,其中氯原子与碳原子形成___________  键(填写轨道重叠方式)。
键(填写轨道重叠方式)。
(2)化合物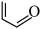 中官能团的名称为
中官能团的名称为___________ 。
(3)E的结构简式为___________ 。
(4)D+F→G的反应类型为___________ 。
(5)A分子中不含有手性碳原子,则A转变为B的化学方程式为___________ 。
(6)在F的同分异构体中,同时满足下列条件的共有___________ 种(不考虑立体异构)。
①是苯的三取代物,且有两个相同取代基。
②每个取代基中均有 杂化的碳原子,且氮原子的杂化方式也为
杂化的碳原子,且氮原子的杂化方式也为 。
。
其中,核磁共振氢谱显示为6组峰,且峰面积比为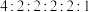 的同分异构体的结构简式为
的同分异构体的结构简式为___________ (有几种,写几种)。

已知:①DMSO为二甲亚砜( ),TsOH为对甲苯磺酸,Et为乙基。
),TsOH为对甲苯磺酸,Et为乙基。
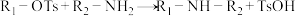 。
。回答下列问题:
(1)化合物
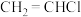 的化学名称为
的化学名称为 键(填写轨道重叠方式)。
键(填写轨道重叠方式)。(2)化合物
 中官能团的名称为
中官能团的名称为(3)E的结构简式为
(4)D+F→G的反应类型为
(5)A分子中不含有手性碳原子,则A转变为B的化学方程式为
(6)在F的同分异构体中,同时满足下列条件的共有
①是苯的三取代物,且有两个相同取代基。
②每个取代基中均有
 杂化的碳原子,且氮原子的杂化方式也为
杂化的碳原子,且氮原子的杂化方式也为 。
。其中,核磁共振氢谱显示为6组峰,且峰面积比为
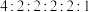 的同分异构体的结构简式为
的同分异构体的结构简式为
您最近一年使用:0次
解题方法
3 . 常温下,用浓度为0.0200mol·L-1的NaOH标准液滴定浓度均为0.0200mol•L-1的HCl和HF的混合待测液,滴定过程中溶液的pH随η[η= ]的变化曲线如图所示(忽略溶液混合引起的体积变化)。下列说法错误的是
]的变化曲线如图所示(忽略溶液混合引起的体积变化)。下列说法错误的是
 ]的变化曲线如图所示(忽略溶液混合引起的体积变化)。下列说法错误的是
]的变化曲线如图所示(忽略溶液混合引起的体积变化)。下列说法错误的是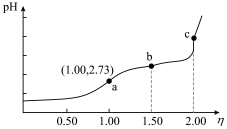
| A.Ka(HF)的数量级为10-4 |
| B.a点:c(Na+)=c(F-)+c(HF) |
| C.b点:c(F-)<c(HF)<c(Cl-) |
D.c点: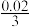 +c(H+)=c(F-)+c(OH-) +c(H+)=c(F-)+c(OH-) |
您最近一年使用:0次
名校
解题方法
4 . 苯甲醛( )是有机制备中的一种重要原料。实验室常用苯甲醛与NaOH反应制备苯甲醇和苯甲酸钠:2
)是有机制备中的一种重要原料。实验室常用苯甲醛与NaOH反应制备苯甲醇和苯甲酸钠:2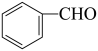 +NaOH→
+NaOH→ +
+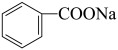 ,再将苯甲酸钠酸化得到苯甲酸。
,再将苯甲酸钠酸化得到苯甲酸。
| 名称 | 性质 | 熔点/℃ | 沸点/℃ | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 苯甲醛 | 无色液体,具有苦杏仁味 | -26 | 178.1 | 微溶 | 混溶 | 混溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 微溶 | 易溶 | 易溶 |
| 苯甲醇 | 无色液体,具有芳香味 | -15.3 | 205.35 | 微溶 | 易溶 | 易溶 |
| 乙醚 | 无色透明液体,具有特殊刺激性气味 | -116.2 | 34.6 | 微溶 | 易溶 | — |
已知:a.RCHO+ ⇌
⇌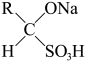 ;
;
实验步骤:

步骤②:搅拌、加热三颈烧瓶c,充分反应后,将c中液体冷却后倒入分液漏斗中,用乙醚萃取、分液,将乙醚层依次用25%亚硫酸氢钠溶液、水洗涤,水层保留待用。
步骤③:将乙醚层倒入盛少量无水MgSO4的锥形瓶中进行干燥,混匀、静置、过滤后采用一定的方法分离,收集苯甲醇。
步骤④:将步骤②中得到的水层和适量浓盐酸混合均匀,析出白色固体。冷却、抽滤得粗产品,将粗产品提纯得n g的苯甲酸。回答下列问题:
(1)步骤①中,冷凝管的作用是
(2)步骤②中,乙醚层用25%亚硫酸氢钠溶液洗涤的作用是
(3)步骤③中,分离出苯甲醇的方法是
(4)步骤④中,水层和浓盐酸混合后产生苯甲酸的离子方程式为
(5)苯甲酸的产率为
您最近一年使用:0次
昨日更新
|
88次组卷
|
3卷引用:福建省龙岩市连城县第一中学2024-2025学年高三上学期开学考试化学试题
解题方法
5 . 回答下列问题。
(1)装置甲中正极反应式为_______ ;若将 换成
换成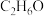 ,则负极反应式为
,则负极反应式为_______ 。_______ 。 )是一种新型水处理剂,强碱性条件下稳定存在。电解法制备
)是一种新型水处理剂,强碱性条件下稳定存在。电解法制备 的工作原理如下装置所示,阳极的电极反应式为
的工作原理如下装置所示,阳极的电极反应式为_______ ,当外电路转移3 mol电子时,阳极区溶液质量增加_______ 克。_______ 。 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______ 。
(1)装置甲中正极反应式为
 换成
换成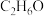 ,则负极反应式为
,则负极反应式为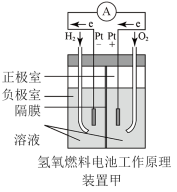
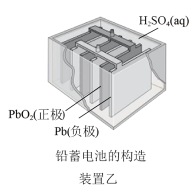
 )是一种新型水处理剂,强碱性条件下稳定存在。电解法制备
)是一种新型水处理剂,强碱性条件下稳定存在。电解法制备 的工作原理如下装置所示,阳极的电极反应式为
的工作原理如下装置所示,阳极的电极反应式为
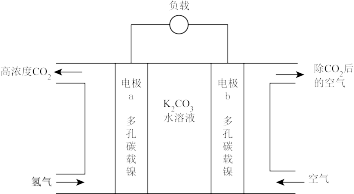
 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
您最近一年使用:0次
名校
解题方法
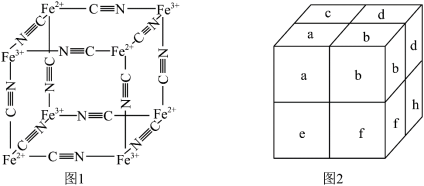
6 . 配合物在许多尖端领域如超导材料、催化剂研制、自组装超分子等方面有广泛的应用。回答下列问题:
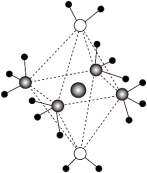
(1)某配合物的阳离子[Cu(NH3)4(H2O)2]2+结构如图所示,铜离子的配位数为_____ ,其中与铜离子形成配位键更强的配体是_____ (填化学式)。_____ g·cm-3.
(4)N4H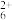 只有一种化学环境的氢原子,结构如图所示,其中的大π键可表示为
只有一种化学环境的氢原子,结构如图所示,其中的大π键可表示为_____ (分子中的大π键可用符号Π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π )。
)。
(1)某配合物的阳离子[Cu(NH3)4(H2O)2]2+结构如图所示,铜离子的配位数为
基态Al原子中自旋状态相反的两种电子的个数比为 外还有
外还有
(4)N4H
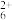 只有一种化学环境的氢原子,结构如图所示,其中的大π键可表示为
只有一种化学环境的氢原子,结构如图所示,其中的大π键可表示为 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π )。
)。
您最近一年使用:0次
名校
7 . 下列说法正确的是
A.乙二胺(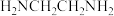 )的沸点低于 )的沸点低于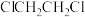 |
B.金刚石晶体中,碳原子数目与碳碳键数目之比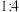 |
| C.NCl3的键角大于NF3的键角 |
D.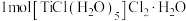 和足量 和足量 溶液反应,能产 溶液反应,能产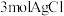 |
您最近一年使用:0次
解题方法
8 . 钛合金是航天航空工业的重要材料。钛铁矿的主要成分为钛酸亚铁 。由钛铁矿制备人造金红石
。由钛铁矿制备人造金红石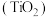 ,发生的反应有:
,发生的反应有:
反应①: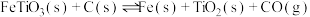

反应②: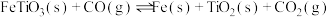
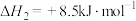
回答下列问题:
(1)已知C(s)的燃烧热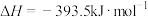 ,则表示CO(g)燃烧热的热化学方程式为
,则表示CO(g)燃烧热的热化学方程式为___________ 。
(2)一定温度下,在V L恒容密闭容器中加入 和
和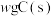 ,经过t min反应达到平衡,测得
,经过t min反应达到平衡,测得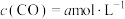 ,
,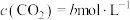 。
。
①用单位时间内固体反应物的物质的量的减小或固体生成物的物质的量的增大来表示固体的平均反应速率,0~t min,反应①中反应物C(s)的平均反应速率为___________  ,平衡时C(s)的转化率为
,平衡时C(s)的转化率为___________ 。
②该条件下,当密闭容器中下列物理量不再发生变化时,不能说明该反应体系达到平衡状态的是___________ (填标号)。
A.混合气体的压强
B.混合气体的密度
C.混合气体的总物质的量
D.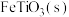 和Fe(s)的反应速率(单位:
和Fe(s)的反应速率(单位: )之比等于化学计量数之比
)之比等于化学计量数之比
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时 为
为___________ (填标号)。
A. B.
B.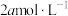
C.大于 ,小于
,小于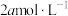 D.大于
D.大于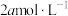
④若该条件下,平衡时压强为100kPa,其体系中隐藏的可逆反应为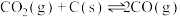 ,则该反应的平衡常数
,则该反应的平衡常数
___________ kPa(列出含a、b的计算式。用各物质的分压代替物质的量浓度计算,分压=总压×物质的量分数)。升高温度,该反应的
___________ (填“增大”“减小”或“不变”),原因是___________ 。
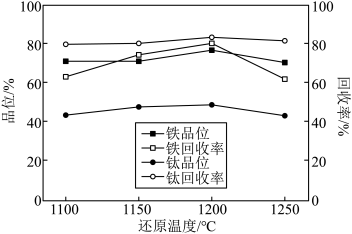
(3)钛铁矿冶炼采用电炉熔融还原,还原温度与铁、钛的品位及回收率的关系如图所示,则还原温度应控制在___________ 。 ,反应②的
,反应②的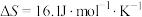 。反应①、反应②能自发进行的最低温度分别为
。反应①、反应②能自发进行的最低温度分别为 、
、 ,则
,则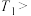
___________ K(保留整数,下同),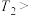
___________ K。
 。由钛铁矿制备人造金红石
。由钛铁矿制备人造金红石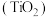 ,发生的反应有:
,发生的反应有:反应①:
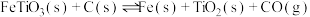

反应②:
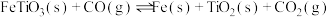
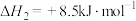
回答下列问题:
(1)已知C(s)的燃烧热
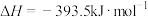 ,则表示CO(g)燃烧热的热化学方程式为
,则表示CO(g)燃烧热的热化学方程式为(2)一定温度下,在V L恒容密闭容器中加入
 和
和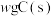 ,经过t min反应达到平衡,测得
,经过t min反应达到平衡,测得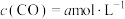 ,
,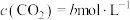 。
。①用单位时间内固体反应物的物质的量的减小或固体生成物的物质的量的增大来表示固体的平均反应速率,0~t min,反应①中反应物C(s)的平均反应速率为
 ,平衡时C(s)的转化率为
,平衡时C(s)的转化率为②该条件下,当密闭容器中下列物理量不再发生变化时,不能说明该反应体系达到平衡状态的是
A.混合气体的压强
B.混合气体的密度
C.混合气体的总物质的量
D.
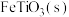 和Fe(s)的反应速率(单位:
和Fe(s)的反应速率(单位: )之比等于化学计量数之比
)之比等于化学计量数之比③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时
 为
为A.
 B.
B.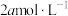
C.大于
 ,小于
,小于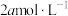 D.大于
D.大于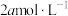
④若该条件下,平衡时压强为100kPa,其体系中隐藏的可逆反应为
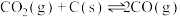 ,则该反应的平衡常数
,则该反应的平衡常数

(3)钛铁矿冶炼采用电炉熔融还原,还原温度与铁、钛的品位及回收率的关系如图所示,则还原温度应控制在
 ,反应②的
,反应②的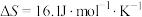 。反应①、反应②能自发进行的最低温度分别为
。反应①、反应②能自发进行的最低温度分别为 、
、 ,则
,则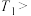
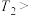
您最近一年使用:0次
9 . 将电能转化为化学能在生活生产和科学研究中具有重要意义。某学习小组用石墨电极持续电解 溶液。
溶液。
(1)t₁时刻,a极析出铜的电极反应式为___________ 。
(2)从a极刮取白色沉淀(含少量红色固体),经检验含CuCl、Cu。
已知: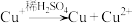 ,CuOH(黄色,不溶)
,CuOH(黄色,不溶) (红色,不溶)
(红色,不溶)___________ 。
②向试管ⅰ中加入NaOH溶液,生成的黄色沉淀很快转变为红色。解释沉淀由黄色变红色发生的化学反应方程式___________ 。
③证实从a极刮取的白色沉淀中含有CuCl的理由是___________ 。
(3)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由电极反应产生: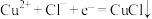 。
。
假设2:除电极反应外,也可由氧化还原反应产生CuCl,请用离子方程式说明:___________ 。
(4) 时a极未产生气体,而
时a极未产生气体,而 时a极产生气体。原因是
时a极产生气体。原因是___________ 。
(5)镀铜工业中,电镀液以 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,写出发生的离子反应方程式
(微溶)固体能有效解决该问题,写出发生的离子反应方程式___________ 。
 溶液。
溶液。| 实验 | 时刻 | 现象 |
|  | a极析出红色固体;b极产生气体用湿润的碘化钾淀粉试纸检验,试纸变蓝。 |
 | a极产生白色沉淀;a极附近溶液变为黄绿色;b极产生气体 | |
| … | … | |
 | a极产生气体;b极产生气体 |
(1)t₁时刻,a极析出铜的电极反应式为
(2)从a极刮取白色沉淀(含少量红色固体),经检验含CuCl、Cu。
已知:
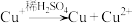 ,CuOH(黄色,不溶)
,CuOH(黄色,不溶)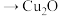 (红色,不溶)
(红色,不溶)
②向试管ⅰ中加入NaOH溶液,生成的黄色沉淀很快转变为红色。解释沉淀由黄色变红色发生的化学反应方程式
③证实从a极刮取的白色沉淀中含有CuCl的理由是
(3)针对CuCl沉淀是如何产生的,小组提出两种假设。
假设1:由电极反应产生:
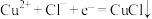 。
。假设2:除电极反应外,也可由氧化还原反应产生CuCl,请用离子方程式说明:
(4)
 时a极未产生气体,而
时a极未产生气体,而 时a极产生气体。原因是
时a极产生气体。原因是(5)镀铜工业中,电镀液以
 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜。电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,写出发生的离子反应方程式
(微溶)固体能有效解决该问题,写出发生的离子反应方程式
您最近一年使用:0次
10 . 利用催化剂将汽车尾气中的NO和CO发生反应:2NO+2CO 2CO2+N2。使用等量的同种催化剂,设计实验探究温度、催化剂比表面积对反应速率的影响,实验结果如表。已知:x>y>z,下列分析错误的是
2CO2+N2。使用等量的同种催化剂,设计实验探究温度、催化剂比表面积对反应速率的影响,实验结果如表。已知:x>y>z,下列分析错误的是
 2CO2+N2。使用等量的同种催化剂,设计实验探究温度、催化剂比表面积对反应速率的影响,实验结果如表。已知:x>y>z,下列分析错误的是
2CO2+N2。使用等量的同种催化剂,设计实验探究温度、催化剂比表面积对反应速率的影响,实验结果如表。已知:x>y>z,下列分析错误的是| 实验编号 | 温度(℃) | NO起始浓度(mol•L-1) | CO起始浓度(mol•L-1) | 催化剂比表面积(m2•g-1) | CO平衡浓度(mol•L-1) | 平衡时间(min) |
| 1 | 280 | 6.5×10-3 | 4.0×10-3 | 80 | a | x |
| 2 | 280 | 6.5×10-3 | 4.0×10-3 | 120 | 1.0×10-3 | y |
| 3 | 360 | 6.5×10-3 | 4.0×10-3 | 80 | 2.0×10-3 | z |
| A.对比实验1、2可知,a=1.0×10-3 |
| B.实验2中,CO平衡转化率为75% |
| C.对比实验1、2可知,增大催化剂比表面积可加快反应速率 |
| D.对比实验1、3可知,该反应的△H>0 |
您最近一年使用:0次




