9-10高一下·河北·期中
名校
解题方法
1 . 下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀硫酸反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的炭与CO2反应 | D.甲烷在O2中的燃烧反应 |
您最近一年使用:0次
2023-12-09更新
|
351次组卷
|
247卷引用:2014-2015学年四川省德阳市第五中学高一下学期期中考试化学试卷
2014-2015学年四川省德阳市第五中学高一下学期期中考试化学试卷(已下线)2009-2010学年乐亭一中高一第二学期期中化学试题(已下线)09—10学年辽中第一私立高一下学期期末考试化学试题(已下线)2010年春季武汉睿升学校高一期中考试化学卷(已下线)09-10学年辽宁本溪一中高一下学期3月月考化学卷(已下线)09~10年黄冈中学高二下学期期末考试化学卷(已下线)2010年山西省汾阳中学高二上学期第二次月考(化学)(已下线)2010—2011学年广东省龙川一中高二3月月考(理科)化学部分(已下线)2010-2011学年广东省深圳高级中学高二下学期期中考试化学试卷(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年云南大理云龙一中高二上学期期末考试化学试卷(已下线)2011-2012学年云南蒙自高中高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省上冈高级中学高二下学期期中考试化学试卷(已下线)2011-2012学年太原五中高一下学期期中考试化学试卷(已下线)2011-2012学年四川省金堂中学高一下学期期中考试化学试卷(已下线)2011-2012学年江苏省盐城中学高一下学期期中考试化学试卷(已下线)2011-2012年湖南衡阳七校高二上学期期末质量检测化学试卷(已下线)2012-2013学年昆明三中、滇池中学高一下期中考试化学卷(滇中)(已下线)2013届河北省石家庄市第二实验中学高二上学期期中考试理科化学试卷(已下线)2012-2013学年江西省白鹭洲中学高一下学期期中考试化学试卷(已下线)2012-2013学年甘肃省兰州一中高一下学期期末考试化学试卷(已下线)2012-2013学年贵州省黔西一中高一第二学期期末检测化学试卷(已下线)2012-2013学年山东省临沂市高二上学期期中考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷(已下线)2013-2014学年江西省新余市高二上学期期末考试化学试卷(已下线)2013-2014云南省玉溪一中高一下学期期末考试化学试卷(已下线)2013-2014宁夏大学附属中学高一下学期期中考试化学试卷2014-2015河北邢台一中高一3月月考化学试卷2014—2015学年福建省厦门市高一下期末质量检测化学试卷2014-2015学年四川眉山市高一第二学期期末教学质量检测化学试卷2015-2016学年河北省容城中学高二上学期第一次月考化学试卷2015-2016学年河北省定兴第三中学高二上学期第一次月考化学试卷2015-2016学年河北省行唐启明中学高二上学期第一次月考化学试卷2015-2016学年山东省淄博市淄川一中高二上学期期中测试化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷2015-2016学年河北省保定一中高二上学期第一次段考化学试卷2015-2016学年内蒙古巴彦淖尔一中高一上期末化学试卷22015-2016学年宁夏银川二中高一下3月月考化学试卷2015-2016学年湖南省岳阳市岳阳一中高一下3月月考化学试卷2015-2016学年贵州省习水一中高一下学期期中考试化学试卷2015-2016学年天津市耀华中学高一下期中化学试卷2015-2016学年广东实验中学高一下期中化学试卷2015-2016学年甘肃省会宁四中高一下学期期中考试化学试卷2015-2016学年广西南宁市八中高二下学期期中段考化学试卷2015-2016学年甘肃省会宁二中高一下学期期中化学试卷2015-2016学年浙江省绍兴一中高一下期中化学试卷2015-2016学年四川省雅安市天全中学高一下学期期中考试化学试卷2015-2016学年山西省右玉一中高一下学期期中考试化学试卷2015-2016学年新疆石河子二中高一下学期第二次月考化学试卷2015-2016学年辽宁省实验中学分校高一下期中化学试卷2015-2016学年河南省洛阳八中高一下学期5月月考化学试卷2015-2016学年湖北省枣阳二中高二下学期期中考试化学试卷2015-2016学年江西省南昌市八一、洪都等五校高一下期末化学试卷2015-2016学年新疆农业大学附中高一下学期期中化学试卷2015-2016学年宁夏中卫市海原一中高一下第二次月考化学试卷2015-2016学年陕西省宝鸡市岐山县高一下期末质检化学试卷2017届吉林省吉林二中高三上学期9月月考化学试卷2016-2017学年福建省三明一中高二上第一次月考化学卷2016-2017学年宁夏育才中学高二上学期期中化学卷2016-2017学年河北省秦皇岛北戴河中学高二上月考化学试卷2016-2017学年江苏省清江中学高二上期中选修化学卷2016-2017学年湖北省孝感市七校教学联盟高一下学期期中考试化学试卷2016-2017学年河南省洛阳市高一下学期期中考试化学试卷黑龙江省伊春市第二中学2016-2017学年高一下学期期中考试(理)化学试题黑龙江省伊春市第二中学2016-2017学年高一下学期期中考试(文)化学试题山西省怀仁县第一中学2016-2017学年高一下学期第三次(5月)月考化学试题云南省曲靖市第一中学2016-2017学年高一下学期期中考试化学试题贵州省遵义航天高级中学2016-2017学年高一下学期第三次月考理科综合化学试题贵州省遵义航天中学2016-2017学年高一下学期第三次月考化学试题山西省汾阳中学2016-2017学年高一下学期期中考试(理)化学试题湖北省孝感市七校教学联盟2016-2017学年高一下学期期末考试化学试题广西宾阳县宾阳中学2016-2017学年高一下学期7月期末考试(文)化学试题新疆呼图壁县一中2016-2017学年高一下学期期末考试化学试题黑龙江省伊春市第二中学2016-2017学年高一下学期期末考试(理)化学试题黑龙江省鹤岗市第一中学2016-2017学年高一下学期期末考试化学试题1黑龙江省鹤岗市第一中学2016-2017学年高一下学期期末考试化学试题2甘肃省武威市第六中学2017-2018学年高二上学期第一次学段考试化学试题云南省姚安县第一中学2017-2018学年高二10月月考化学试题新疆昌吉市2017-2018学年高二上学期期末考试化学试题《课时同步君》2017-2018学年高一化学人教必修2-2.1 化学能与热能甘肃省嘉峪关市一中2017-2018学年高二上学期期末考试化学(理)试题(已下线)《周末培优君》2017-2018学年高一下学期化学-第05周 化学能与热能【全国市级联考】江苏省宿迁市2017-2018学年高一下学期期中考试化学试题海南省热科院两院中学2017-2018高一下学期期中考试化学试题【全国百强校】贵州省铜仁市第一中学2017-2018学年高一下学期期中考试化学试题【全国百强校】新疆生产建设兵团第二中学2017-2018学年高一下学期期中考试化学试题四川省威远中学2017-2018学年高一下学期期中考试化学试题【全国校级联考】河南省商丘市九校2017-2018学年高一下学期期末联考化学试题【全国百强校】黑龙江省双鸭山市第一中学2017-2018学年高一下学期期末考试化学试题安徽师范大学附属中学2017-2018学年高一下学期期末模拟化学试题山西省忻州二中2017-2018学年高一下学期期中考试化学试题甘肃省岷县二中2018-2019学年高二上学期第一次月考化学试题安徽省滁州市定远县育才学校2018-2019学年高二(实验班)上学期第一次月考化学试题河南省鹤壁市淇滨高级中学2018-2019学年高二上学期第一次月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题四川省成都外国语学校2018-2019学年高二上学期半期考试化学试题【全国百强校】贵州省铜仁市第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南第一中学2018-2019学年高二上学期期中考试化学试题甘肃省白银市靖远县第四中学2018-2019学年高二上学期期中考试化学试题江苏省泰州市第二中学2017-2018学年高二上学期期中考试化学试题江西省铅山县第一中学2018-2019学年高二上学期期中考试化学试题浙江省余姚中学2018-2019学年高二上学期10月月考化学试题江西省分宜中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】广东省佛山市第一中学2018-2019学年高二(文)下学期期中考试化学试题吉林省乾安县第七中学2018-2019学年高一下学期第二次质量检测化学试题甘肃省兰州市第一中学2018-2019学年高一下学期期末考试化学试题黑龙江省双鸭山市第一中学2018-2019学年高一下学期期末考试化学试题山西省应县第一中学校2018-2019学年高一下学期期中考试化学试题云南省峨山彝族自治县第一中学2018-2019学年高一下学期期中考试化学试题新疆兵团八师一四三团一中2018-2019学年高一下学期期中考试化学试题山西省大同市铁路第一中学2018-2019学年高一下学期第三次月考化学试题河北省鸡泽县第一中学2019-2020学年高二10月月考化学试题河北省唐山一中2019-2020学年高二上学期10月月考化学试题浙江省台州市五校2020届高三10月联考化学试题贵州省思南中学2019-2020学年高二9月月考化学试题福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题吉林省辽源市田家炳高级中学2019-2020学年高二上学期期中考试化学试题福建省泉州市永春华侨中学2019-2020学年高二上学期期中考试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题新疆阿瓦提县第四中学2019-2020学年高二上学期期中考试化学试卷湖南省怀化市第三中学2018-2019学年高一下学期3月月考化学试题湖北省宜昌市长阳县第一高级中学2019-2020学年高二上学期期中考试化学试题湖北省宜昌市第二中学(人文艺术高级中学)2019-2020学年高二上学期10月月考化学试题广西北海市北海中学2019-2020学年高二上学期期中考试化学试题吉林省普通高中联合体2018-2019学年高二下学期期末联考化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题宁夏吴忠市盐池高级中学2019-2020学年高二上学期期末检测化学试题2019秋人教版高中化学必修2第二章 《化学反应与能量》同步训练题陕西省汉中市龙岗学校2019-2020学年高二上学期期末考试化学试题(文)2020届高考化学知识点必练——氧化还原反应的本质及相关概念辽宁省抚顺市六校协作体2019-2020学年高二上学期期末考试化学试题福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期中考试(选考)化学试题6.1.1 化学反应与热能——2020年春高一新人教版第二册化学一课一练河北省正定中学2019-2020学年高一3月月考化学试题课时1 化学反应与热能——A学习区 夯实基础(人教版(2019)第二册)课时1 化学反应中能量变化的本质及转化形式——A学习区 夯实基础(鲁科版(2019)第二册)课时2 化学键与化学反应中的能量变化——A学习区 夯实基础(鲁科版必修2)甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期中考试理科化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期9月月考化学试题湖北省武汉市第三十九中学2019-2020学年高一下学期线上期中考试化学试题2020年春高一化学新人教版第二册课后同步:6.1.1 化学反应与热能吉林省延边市长白山第一高级中学2019-2020学年高一下学期验收考试化学试题山西省晋中市和诚中学2019-2020学年高一4月月考化学试题湖北省武汉市2019-2020学年高一下学期期中联考化学试卷广东省湛江市第二十一中学2019-2020学年高二下学期开学考试化学试题山西省运城市高中联合体2019-2020学年高一下学期第一次摸底考试化学试题贵州省铜仁市思南中学2019-2020学年高一下学期5月月考化学试题广西壮族自治区田阳高中2019-2020学年高一5月月考化学试题宁夏吴忠中学2019-2020学年高一下学期期中考试化学试题辽宁省大连市普兰店区第一中学2019-2020学年高一下学期5月线上教学质量检测化学试题河北省石家庄市元氏县第四中学2019-2020学年高一下学期摸底考试化学试题宁夏银川市宁夏大学附属中学2019-2020学年高一下学期期中考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高一下学期期末考试化学试题吉林省辽源市田家炳高级中学等友好学校2019-2020学年高一下学期期末考试化学试题河北省衡水市深州市中学2019-2020学年高二下学期期中考试化学试题(已下线)1.1.1 化学反应的反应热 内能变化 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1黑龙江省哈尔滨师范大学青冈实验中学校2019-2020学年高二上学期开学考试(8月)化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第1节 化学反应的热效应四川省广安市北京师范大学广安实验学校2020-2021学年高二上学期9月月考化学试题必修第二册RJ第6章第一节 化学反应与能量变化 课时1宁夏回族自治区青铜峡市高级中学2020-2021学年高二上学期第一次月考化学试题山东省新泰市第一中学北校2020-2021学年高二上学期第一次月考化学试题山东省临沂市费县地区化学2020-2021学年高二上学期9月月考化学试题山西省运城市新绛县第二中学2019-2020学年高一下学期3月月考化学试题广东省东莞市第四高级中学2020-2021学年高二上学期期中考试化学试题安徽省蚌埠第三中学2019-2020学年高一下学期5月月考化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试题浙江省杭州市富阳区第二中学2020-2021学年高二上学期期中考试化学试题浙江省“七彩阳光”新高考研究联盟2020-2021学年高二上学期期中联考化学试题吉林省榆树市第一高级中学2021届高三上学期第三次模拟考试化学试题(已下线)【浙江新东方】绍兴qw126黑龙江嫩江市高级中学2020-2021学年高二上学期期末考试化学试题吉林省白山市抚松县第五中学2020-2021学年高二上学期期中考试化学试题高中化学苏教2019版必修第二册-专题6 第二单元 第1课时 放热反应与吸热反应山东省滨州市阳信县第二高级中学2020-2021学年高二上学期期中考试化学试题甘肃省武威市民勤县第四中学2021届高三上学期期末考试(实验班)化学试题宁夏银川一中2020-2021学年高二上学期期末考试化学试题山西省沁县中学2020-2021学年高二上学期第一次月考化学试题湖南省长沙宁乡市第十高级中学2020-2021学年高二上学期10月月考化学试题吉林省长春市第二十中学2019-2020学年高一下学期期末考试化学试题甘肃省天水市田家炳中学2019-2020学年高一下学期期中考试化学试题浙江省湖州市2020-2021学年高二上学期期末调研测试化学试题浙江省杭州市萧山三中2020-2021学年高一下学期四校4月阶段联考化学试题河北省衡水市安平中学2020-2021学年高一下学期第一次月考化学试题甘肃省酒泉市青海油田第一中学2020-2021学年高一下学期期中考试化学试题(已下线)【浙江新东方】在线化学87高一下江苏省苏州外国语中学2020-2021学年高二下学期3月月考化学试题甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(文)试题辽宁省阜新市第二高级中学2020-2021学年高一下学期期中考试化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题(已下线)【镇江新东方】高一下第一次月考一中镇中联考江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题宁夏长庆高级中学2020-2021学年高一下学期期末考试化学试题吉林省通化县综合高级中学2020-2021学年高一下学期期末考试化学试题甘肃省天水市田家炳中学2020-2021学年高一下学期期末考试化学试题浙江省磐安县第二中学2019-2020学年高二10月竞赛化学试题新疆乌苏市第一中学2021-2022学年高二上学期10月月考化学试题浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(1-4班)化学试题青海省西宁市海湖中学2021-2022学年高二上学期第一次月考化学试题江苏省盐城市实验高级中学(新洋高级中学)2020-2021学年高一下学期期中考试化学试题浙江省宁波市咸祥中学2021-2022学年高二上学期期中考试化学试题湖南省常德市外国语学校2021-2022学年高二上学期期中考试化学试题上海市徐汇中学2021-2022学年高二上学期期中考试化学(等级考)试题河南省驻马店市第一高级中学2021-2022学年高二上学期期中考试化学试题 重庆市朝阳中学2021-2022学年高二上学期期中考试化学试题安徽省六安市新安中学2021-2022学年高二上学期期中考试化学试题(已下线)第03讲 放热反应与吸热反应-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)(已下线)章末培优 第6章 化学反应与能量-2021-2022学年高一化学课后培优练(人教版2019必修第二册)江苏省盐城市伍佑中学2021-2022学年高一下学期学情调研(一)化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期中考试化学试题浙江省杭州市西湖高级中学2021-2022学年高一下学期期中考试化学试题宁夏灵武市第一中学2021-2022学年高一下学期期中考试化学试题福建省漳州市正兴学校等三校2021-2022学年高一下学期期中联考化学试题(已下线)第05练 化学能与热能-2022年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)1.1.1 系统的内能和反应热-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.1.1 系统的内能和反应热-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第24练 反应热-2023年高考化学一轮复习小题多维练(全国通用)安徽省阜阳市临泉县第一中学2021-2022学年高二下学期开学考试化学试题浙江省湖州市三贤联盟2021-2022学年高二上学期期中考试化学试题天津市河东区三校2020-2021学年高一下学期期中联考化学试题(已下线)1.1.1 反应热(一)-同步学习必备知识湖南省邵阳市洞口县第二中学2021-2022学年高一下学期第一次月考化学试题重庆市沙坪坝实验中学校2021-2022学年高二上学期12月月考化学试题湖北省黄冈市麻城市第二中学2021-2022学年高一下学期3月月考化学试题 浙江省舟山市南海实验高中2021-2022学年高一下学期4月月考化学试题甘肃省白银市第九中学2020-2021学年高一下学期期中考试化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高二上学期第一次月考化学试题浙江省玉环市玉城中学2022-2023学年高二上学期第一次月考化学试题 甘肃省靖远县第二中学2021-2022学年高二上学期期中考试(二)化学(理)试题陕西省安康市汉滨区五里高级中学2021-2022学年高二上学期期中考试化学试题陕西省西安市周至县第四中学2021-2022学年高二上学期期中考试化学(理科)试题甘肃省徽县第一中学2021-2022学年高二上学期11月月考化学试题山东省菏泽市成武县第二中学2021-2022学年高一下学期第一次月考化学试题湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题广东省汕头市澄海中学2020-2021学年高一下学期期中考试合格考化学试题黑龙江省鸡西市鸡冠区2022-2023学年高二上学期10月月考化学试题青海省海南藏族自治州高级中学2022-2023学年高二下学期期末考试化学试题贵州省铜仁市松桃民族中学2023-2024学年高二上学期9月月考化学试题海南省海口市长流中学2022-2023学年高一下学期第1次月考化学试题A卷海南省农垦中学2023-2024学年高二上学期期末考试化学试题(A卷)(已下线)FHgkyldyjhx11甘肃省兰州市教育局第四片区2023-2024学年高一下学期期中考试化学试卷名校期末好题汇编-化学反应与能量(选择题)
名校
解题方法
2 . 已知 在酸性溶液中易被还原成
在酸性溶液中易被还原成 ,
, 、
、 、
、 、
、 的氧化性依次减弱。下列反应在水溶液中不可能发生的是
的氧化性依次减弱。下列反应在水溶液中不可能发生的是
 在酸性溶液中易被还原成
在酸性溶液中易被还原成 ,
, 、
、 、
、 、
、 的氧化性依次减弱。下列反应在水溶液中不可能发生的是
的氧化性依次减弱。下列反应在水溶液中不可能发生的是A.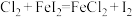 |
B.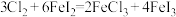 |
C.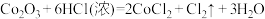 |
D.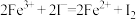 |
您最近一年使用:0次
2023-12-06更新
|
188次组卷
|
62卷引用:四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题
四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题福建省厦门第六中学2019-2020学年高一下学期3月月考化学试题(已下线)【浙江新东方】6广东省东莞市东华高级中学2020-2021学年高一上学期第一次月考化学试题广东省深圳外国语学校2021届高三第二次月考化学试题云南省保山市第九中学2021届高三上学期阶段测试化学试题湖南省长沙市实验中学2020—2021学年高一上学期第一次月考(10月)化学试题(已下线)【浙江新东方】61河南省许昌市建安区第一高级中学2020-2021学年高一上学期阶段性测试(12月)化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题(已下线)练习4 氧化还原反应-2020-2021学年【补习教材·寒假作业】高一化学(人教版)安徽省六安市城南中学2021届高三上学期第二次月考化学试题河南省滑县实验学校2020-2021学年高一上学期11月半月考试化学试题(已下线)专题04 氧化还原反应-备战2021届高考化学二轮复习题型专练甘肃省镇原县第二中学2020-2021学年高一上学期期中考试化学试题云南省保山市第九中学2021届高三上学期期中考试化学试题安徽省江淮名校2020-2021学年高一下学期开学联考化学试题山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题黑龙江省哈尔滨市第三中学2020-2021学年高一上学期期末考试化学试卷(已下线)衔接点07 氧化剂和还原剂-2021年初升高化学无忧衔接(已下线)专题1.3.3 氧化剂、还原剂(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省泗县第一中学2021-2022学年高二上学期开学考试化学试题河南省洛阳市第四十三中学2022届高三上学期开学考试化学试题湖南省益阳市箴言中学2021-2022学年高一上学期10月月考化学试题 黑龙江省鸡西实验中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市第二中学2021-2022学年高一上学期10月月考化学试题湖南省邵阳市邵东创新实验学校2021-2022学年高三上学期第一次月考化学试题湖北省巴东县第一高级中学2021-2022学年高一上学期第一次教学质量检测化学试题(已下线)易错专题08 氧化还原反应规律的应用及相关计算-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)河南省商丘市高级中学2021-2022学年高一上学期期末考试暨学学考试化学试题湖北省问津联合体2021-2022学年高一下学期5月质量检测化学试题陕西省西安高级中学2021-2022学年高一上学期竞赛化学试题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)衔接点12 氧化剂和还原剂-2022年初升高化学无忧衔接?(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)江西省丰城市第九中学(日新班)2021-2022学年高一下学期期末检测化学试题陕西省榆林市定边四中2023届高三上学期第一次月考化学试题(已下线)第一章 物质及其变化(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 陕西省咸阳市武功县普集高级中学2022-2023学年高一上学期第一次月考化学试题安徽省合肥市第六中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市第二中学2022-2023学年高一上学期10月月考化学试题内蒙古呼和浩特市第二中学致远级部2022-2023学年高一上学期第一次月考化学试题重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题安徽省皖北地区2022-2023学年高一上学期期末联考化学试题(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点巩固卷02 化学物质及其变化(3大考点44题)?-2024年高考化学一轮复习考点通关卷(新高考通用)第2课时 氧化剂和还原剂湖南省长沙市长郡中学2023-2024学年高一上学期第一次月考化学试题甘肃省部分学校2023-2024学年高一上学期10月期中考试化学试题天津市南开中学2023-2024学年高三上学期第二次考试化学试题湖南省永州市第一中学2023-2024学年高一上学期第一次月考化学试题北京市第一六一中学2022-2023学年高一上学期12月月考化学试题安徽省亳州市第二完全中学2023-2024学年高一上学期期末考试化学试题海南省琼海市嘉积中学2023-2024学年高一上学期期末考试化学试题A卷黑龙江省哈尔滨市第三中学校2023-2024学年高一下学期寒假验收考试 化学试卷陕西省西安市蓝田县乡镇高中联考2023-2024学年高一上学期11月期中化学试题
名校
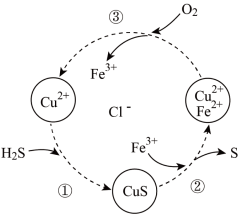
3 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,
的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,不正确 的是
 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,
的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,
A.过程①中,生成CuS的反应为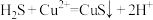 |
B.过程②中, 作氧化剂 作氧化剂 |
| C.过程③中,各元素化合价均未改变 |
D.回收S的总反应为 |
您最近一年使用:0次
2023-11-22更新
|
316次组卷
|
5卷引用:四川省德阳市什邡中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
4 . 常温下,在溶液中可发生以下反应:①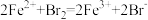 ;②
;② ;③
;③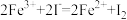 。由此判断下列说法正确的是
。由此判断下列说法正确的是
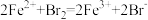 ;②
;② ;③
;③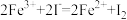 。由此判断下列说法正确的是
。由此判断下列说法正确的是| A.铁元素在反应①中被还原,在反应③中被氧化 |
| B.反应②中Cl2作氧化剂,Br-被还原 |
| C.氧化性强弱顺序为Cl2>I2>Br2>Fe3+ |
| D.Fe3+要转化成Fe2+可以通过加入还原剂来实现 |
您最近一年使用:0次
2023-11-07更新
|
270次组卷
|
4卷引用:四川省德阳市外国语学校1-10班2023-2024学年高一下学期入学考试化学试题
名校
5 . NO的治理是当前生态环境保护中的重要课题之一,某含CeO₂的催化剂(含 Ce化合物的比例系数均未标定)的作用机理如图所示。下列说法错误的是
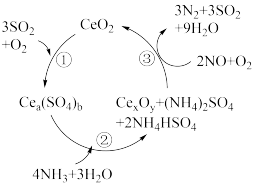

| A.NO可以造成臭氧空洞 |
| B.在反应机理②中,Ce元素的化合价升高 |
| C.加入催化剂能降低反应的活化能,加快反应速率 |
| D.整个反应中被氧化的非金属元素为S和 N |
您最近一年使用:0次
2023-10-31更新
|
209次组卷
|
4卷引用:四川省德阳市第五中学2023-2024学年高三上学期12月月考化学试题
名校
6 . 黄铜矿( )是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物,冶炼铜的反应为
)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物,冶炼铜的反应为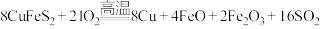 。
。
(1)若 中Fe的化合价为+2价,则反应中的氧化产物是
中Fe的化合价为+2价,则反应中的氧化产物是___________ (填化学式)。
(2)用稀硫酸浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验该溶液中存在 的方法是
的方法是___________ (注明试剂、现象)。
(3)上述冶炼过程中会产生大量 ,下列处理方案中合理的是___________(填字母)。
,下列处理方案中合理的是___________(填字母)。
(4)验证黄铜矿冶炼铜的反应所得气体中含有 的方法是
的方法是___________ 。
(5)实验室制备、收集干燥的 所需装置如图所示。
所需装置如图所示。
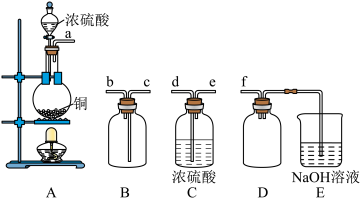
①其中装置A产生 ,反应的化学方程式为
,反应的化学方程式为___________ 。
②请按气流方向连接各仪器接口,顺序为a→___________ →f,装置D的作用是___________ ,装置E中反应的离子方程式为___________ 。
 )是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物,冶炼铜的反应为
)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物,冶炼铜的反应为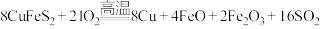 。
。(1)若
 中Fe的化合价为+2价,则反应中的氧化产物是
中Fe的化合价为+2价,则反应中的氧化产物是(2)用稀硫酸浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验该溶液中存在
 的方法是
的方法是(3)上述冶炼过程中会产生大量
 ,下列处理方案中合理的是___________(填字母)。
,下列处理方案中合理的是___________(填字母)。| A.高空排放 | B.用于制备硫酸 |
C.用纯碱溶液吸收制 | D.用浓硫酸吸收 |
 的方法是
的方法是(5)实验室制备、收集干燥的
 所需装置如图所示。
所需装置如图所示。
①其中装置A产生
 ,反应的化学方程式为
,反应的化学方程式为②请按气流方向连接各仪器接口,顺序为a→
您最近一年使用:0次
名校
7 . 实验室用如图方法制备Na2S2O3。
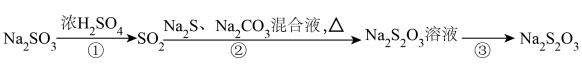
已知:i.Na2SO3+S=Na2S2O3
ii.过程②中溶液先变浑浊再变澄清,|得到Na2S2O3溶油下列说法不正确的是
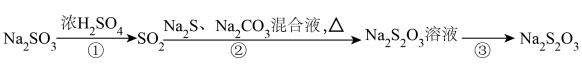
已知:i.Na2SO3+S=Na2S2O3
ii.过程②中溶液先变浑浊再变澄清,|得到Na2S2O3溶油下列说法不正确的是
| A.过程②中溶液先变浑浊可能的原因:2Na2S+3SO2═2Na2SO3+3S↓ |
B.过程②中Na2CO3的作用:SO2+Na2CO3 Na2SO3+CO2 Na2SO3+CO2 |
| C.过程②中通入过量SO2,可增大Na2S2O3的产率 |
| D.过程②中加入适量乙醇可增大S的溶解度,加快反应速率 |
您最近一年使用:0次
2023-10-22更新
|
246次组卷
|
4卷引用:四川省德阳市第五中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
8 . 对物质进行分类,有利于更好的研究和认识物质。完成下列问题
(1)有下列物质:①H2O;②空气;③Mg;④CaO;⑤H2SO4;⑥Ca(OH)2;⑦碘酒;⑧NaHCO3,其中属于混合物的是___________ (填序号,下同);属于盐的是___________ 。
(2)以下为中学化学中常见的几种物质:①CO2;②熔融KCl;③NaHSO4固体;④铜;⑤稀硫酸;⑥澄清石灰水;⑦C2H5OH,其中属于电解质的有___________ (填序号,下同);属于非电解质的有___________ ;能导电的有___________ 。
(3)按要求写出相关方程式:
①Fe2(SO4)3的电离方程式:___________
②将NaHSO4与Ba(OH)2在溶液中按1:1的分子数之比混合发生反应,其离子方程式:___________
③过氧化钠与水反应的化学方程式:___________ 。
(1)有下列物质:①H2O;②空气;③Mg;④CaO;⑤H2SO4;⑥Ca(OH)2;⑦碘酒;⑧NaHCO3,其中属于混合物的是
(2)以下为中学化学中常见的几种物质:①CO2;②熔融KCl;③NaHSO4固体;④铜;⑤稀硫酸;⑥澄清石灰水;⑦C2H5OH,其中属于电解质的有
(3)按要求写出相关方程式:
①Fe2(SO4)3的电离方程式:
②将NaHSO4与Ba(OH)2在溶液中按1:1的分子数之比混合发生反应,其离子方程式:
③过氧化钠与水反应的化学方程式:
您最近一年使用:0次
9 . 回答下列问题
(1)氧化还原反应是一类重要反应,根据以下反应回答问题:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
①该反应中的还原剂是___________ 。
②比较该反应KMnO4和Cl2的氧化性强弱:KMnO4___________ Cl2(填“>”或“<”)。
③用双线桥法标出反应中的电子转移的方向和数目。_________
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
④若产生71gCl2,则被氧化的HCl为___________ g。
(2)加碘食盐中含少量碘添加剂,名为碘酸钾(KIO3)。在酸性条件下,KIO3能与KI发生反应生成碘单质和水,试填空:
①KIO3中,碘元素化合价为___________ 。
②配平:_______

(1)氧化还原反应是一类重要反应,根据以下反应回答问题:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
①该反应中的还原剂是
②比较该反应KMnO4和Cl2的氧化性强弱:KMnO4
③用双线桥法标出反应中的电子转移的方向和数目。
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
④若产生71gCl2,则被氧化的HCl为
(2)加碘食盐中含少量碘添加剂,名为碘酸钾(KIO3)。在酸性条件下,KIO3能与KI发生反应生成碘单质和水,试填空:
①KIO3中,碘元素化合价为
②配平:

您最近一年使用:0次
2023-10-20更新
|
209次组卷
|
2卷引用:四川省德阳市什邡中学2023-2024学年高一上学期10月月考(平行实验班)化学试题
名校
解题方法
10 . 由 Ca2+、Ag+、K+、Fe3+、NO 、SO
、SO 、Cl-、CO
、Cl-、CO 这 8 种离子构成 A、B、C、D 四种可溶性盐(离子在物质中不能重复出现)。现做如下实验:
这 8 种离子构成 A、B、C、D 四种可溶性盐(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈黄色;
②向①的四支试管中分别加入盐酸,A的溶液中有沉淀生成,B的溶液中有无色无味的气体逸出。
回答下列问题:
(1)写出A、C的化学式:A___________ ,C___________
(2)写出足量盐酸与B反应的离子方程式:___________ 。
(3)向C中滴入NaOH溶液的现象:___________ 。
(4)与C含有同一种阳离子的氯化物M,配制M的饱和溶液并进行以下实验:
①在烧杯中加入40mL蒸馏水,加热至沸腾后,向沸水中加入制取的饱和M溶液5~6滴,继续煮沸至液体呈___________ 色,停止加热,用激光笔照射烧杯中的液体,从垂直方向可以观察到液体中___________ 。
②向步骤①的烧杯中逐滴加入足量的盐酸,可以观察到的现象:___________ ,反应的离子方程式:___________ 。
 、SO
、SO 、Cl-、CO
、Cl-、CO 这 8 种离子构成 A、B、C、D 四种可溶性盐(离子在物质中不能重复出现)。现做如下实验:
这 8 种离子构成 A、B、C、D 四种可溶性盐(离子在物质中不能重复出现)。现做如下实验:①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈黄色;
②向①的四支试管中分别加入盐酸,A的溶液中有沉淀生成,B的溶液中有无色无味的气体逸出。
回答下列问题:
(1)写出A、C的化学式:A
(2)写出足量盐酸与B反应的离子方程式:
(3)向C中滴入NaOH溶液的现象:
(4)与C含有同一种阳离子的氯化物M,配制M的饱和溶液并进行以下实验:
①在烧杯中加入40mL蒸馏水,加热至沸腾后,向沸水中加入制取的饱和M溶液5~6滴,继续煮沸至液体呈
②向步骤①的烧杯中逐滴加入足量的盐酸,可以观察到的现象:
您最近一年使用:0次



