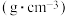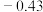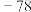名校
1 . 过氧乙酸( )在卫生医疗、食品消毒及漂白剂领域等有广泛应用。实验室利用醋酸(
)在卫生医疗、食品消毒及漂白剂领域等有广泛应用。实验室利用醋酸( )与双氧水
)与双氧水 )共热,在难溶固体酸的催化下制备过氧乙酸(
)共热,在难溶固体酸的催化下制备过氧乙酸( )。同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图所示,请回答下列问题:
)。同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图所示,请回答下列问题:
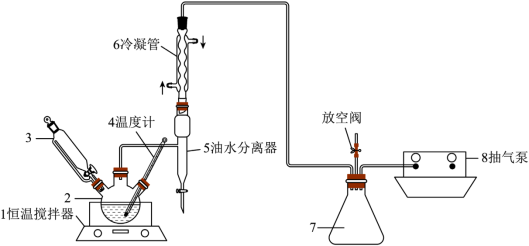
已知:
i.过氧乙酸为无色有刺激性气味液体,易溶于水;极不稳定,遇高热会引起爆炸;氧化性与高锰酸钾相当。
ii.相关物质性质
实验步骤:
①向油水分离器中加入适量蒸馏水,液面低于分水器支管口;
②仪器2中加入冰醋酸、固体酸催化剂和适量乙酸丁酯,仪器6中通冷却水,开通仪器1和8,缓慢关闭仪器7处放空阀,温度维持为55℃;
③待真空度达到反应要求时,打开仪器3的活塞,缓慢逐滴滴入浓度为35%的双氧水;
④当油水分离器中水层液面升高到支管口时,打开放空阀,打开活塞逐滴放出适量……;
⑤待反应结束,冷却后放出油水分离器中下层水,将上层液体从油水分离器上口倒入仪器2,分离仪器2中的混合物,初步得到粗产品。
(1)仪器2的名称是________ ,仪器2中制备过氧乙酸( )的化学反应方程式为
)的化学反应方程式为________ ;
(2)反应体系采用抽气泵抽气减压的目的是________ 。
(3)实验过程中打开油水分离器活塞,分离出水的目的是________ ;
(4)待观察到________ (填现象)时,说明反应已经结束;
(5)反应结束,分离仪器2中的混合物初步得到粗产品的方法是________ ;
(6)粗产品中过氧乙酸( )含量的测定:取一定体积的样品
)含量的测定:取一定体积的样品 ,分成2等份。其中一份用过量KI溶液与过氧化物作用,以
,分成2等份。其中一份用过量KI溶液与过氧化物作用,以 的硫代硫酸钠溶液滴定碘(
的硫代硫酸钠溶液滴定碘( )消耗量为
)消耗量为 ;另一份用
;另一份用 的酸性高锰酸钾溶液滴定,消耗量为
的酸性高锰酸钾溶液滴定,消耗量为 。则样品中的过氧乙酸的浓度为
。则样品中的过氧乙酸的浓度为________  。
。
①过氧乙酸被 还原,还原产物之一为乙酸,其离子方程式为
还原,还原产物之一为乙酸,其离子方程式为________ 。
②用该法测定过氧乙酸含量比实际含量偏高的原因是(不考虑实验操作产生的误差)________ 。
 )在卫生医疗、食品消毒及漂白剂领域等有广泛应用。实验室利用醋酸(
)在卫生医疗、食品消毒及漂白剂领域等有广泛应用。实验室利用醋酸( )与双氧水
)与双氧水 )共热,在难溶固体酸的催化下制备过氧乙酸(
)共热,在难溶固体酸的催化下制备过氧乙酸( )。同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图所示,请回答下列问题:
)。同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图所示,请回答下列问题:
已知:
i.过氧乙酸为无色有刺激性气味液体,易溶于水;极不稳定,遇高热会引起爆炸;氧化性与高锰酸钾相当。
ii.相关物质性质
物质 | 密度/ | 熔点 | 沸点/℃ |
乙酸 | 1.05 | 16.6 | 118 |
过氧化氢 | 1.46 |
| 150.2(分解) |
过氧乙酸 | 0.79 | 0.7 | 105(分解) |
乙酸丁酯 | 0.88 |
| 127 |
①向油水分离器中加入适量蒸馏水,液面低于分水器支管口;
②仪器2中加入冰醋酸、固体酸催化剂和适量乙酸丁酯,仪器6中通冷却水,开通仪器1和8,缓慢关闭仪器7处放空阀,温度维持为55℃;
③待真空度达到反应要求时,打开仪器3的活塞,缓慢逐滴滴入浓度为35%的双氧水;
④当油水分离器中水层液面升高到支管口时,打开放空阀,打开活塞逐滴放出适量……;
⑤待反应结束,冷却后放出油水分离器中下层水,将上层液体从油水分离器上口倒入仪器2,分离仪器2中的混合物,初步得到粗产品。
(1)仪器2的名称是
 )的化学反应方程式为
)的化学反应方程式为(2)反应体系采用抽气泵抽气减压的目的是
(3)实验过程中打开油水分离器活塞,分离出水的目的是
(4)待观察到
(5)反应结束,分离仪器2中的混合物初步得到粗产品的方法是
(6)粗产品中过氧乙酸(
 )含量的测定:取一定体积的样品
)含量的测定:取一定体积的样品 ,分成2等份。其中一份用过量KI溶液与过氧化物作用,以
,分成2等份。其中一份用过量KI溶液与过氧化物作用,以 的硫代硫酸钠溶液滴定碘(
的硫代硫酸钠溶液滴定碘( )消耗量为
)消耗量为 ;另一份用
;另一份用 的酸性高锰酸钾溶液滴定,消耗量为
的酸性高锰酸钾溶液滴定,消耗量为 。则样品中的过氧乙酸的浓度为
。则样品中的过氧乙酸的浓度为 。
。①过氧乙酸被
 还原,还原产物之一为乙酸,其离子方程式为
还原,还原产物之一为乙酸,其离子方程式为②用该法测定过氧乙酸含量比实际含量偏高的原因是(不考虑实验操作产生的误差)
您最近一年使用:0次
解题方法
2 . 某煤化工厂废水含有大量有机物、氨氮、氰化物、悬浮颗粒等有害物质。处理流程如图所示。
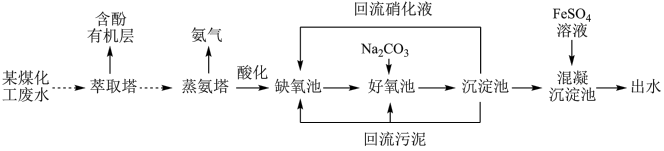
(1)萃取塔中经过_______ (填写操作名称)可将含酚有机层分离出来。
(2)蒸氨塔中需要连续加入碱液并保持较高温度。请从化学平衡角度解释回答下列问题。
①写出蒸氨塔中主要的化学平衡的离子方程式:_______ 。
②加入碱液以及保持较高温度的原因:_______ 。
(3)缺氧池中含有 及CN-,其中CN-(C为+2价)可被回流硝化液中的
及CN-,其中CN-(C为+2价)可被回流硝化液中的 氧化为无毒气体。请预测CN-反应后的产物为
氧化为无毒气体。请预测CN-反应后的产物为_______ 和_______ 。请分析由蒸氨塔到缺氧池工序酸化的目的:_______ 。
(4)好氧池中富含O2与 反应后的产物为
反应后的产物为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(5)下列关于混凝沉淀池中的说法合理的是_______ (填写序号)。
a.混凝沉淀池溶液的pH控制在8.3左右
b.FeSO4水解产生Fe(OH)2胶体,吸附水中的悬浮颗粒
c.相同条件下,使用Fe2(SO4)3可获得相同的混凝效果
(6)出水检测
甲醛法可以测定水样中 的含量,其反应原理为
的含量,其反应原理为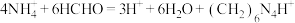 ,然后用NaOH标准溶液滴定反应生成的酸[滴定时,
,然后用NaOH标准溶液滴定反应生成的酸[滴定时,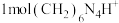 与1molH+相当]。
与1molH+相当]。
实验步骤:
i.移取VmL出水样品,以酚酞为指示剂,用cmol/LNaOH标准液滴定至终点,中和样品中的酸。消耗NaOH溶液的体积为V1mL;
ii.另取同样体积的样品,加入足量的中性甲醛溶液,摇匀,静置5min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V2mL。
①步骤ii中滴定至终点的现象为_______ 。
②该水样中残留 浓度为
浓度为_______ mol/L。

| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe2+ | 6.3 | 8.3 |
| Fe3+ | 2.7 | 3.7 |
(2)蒸氨塔中需要连续加入碱液并保持较高温度。请从化学平衡角度解释回答下列问题。
①写出蒸氨塔中主要的化学平衡的离子方程式:
②加入碱液以及保持较高温度的原因:
(3)缺氧池中含有
 及CN-,其中CN-(C为+2价)可被回流硝化液中的
及CN-,其中CN-(C为+2价)可被回流硝化液中的 氧化为无毒气体。请预测CN-反应后的产物为
氧化为无毒气体。请预测CN-反应后的产物为(4)好氧池中富含O2与
 反应后的产物为
反应后的产物为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)下列关于混凝沉淀池中的说法合理的是
a.混凝沉淀池溶液的pH控制在8.3左右
b.FeSO4水解产生Fe(OH)2胶体,吸附水中的悬浮颗粒
c.相同条件下,使用Fe2(SO4)3可获得相同的混凝效果
(6)出水检测
甲醛法可以测定水样中
 的含量,其反应原理为
的含量,其反应原理为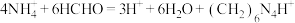 ,然后用NaOH标准溶液滴定反应生成的酸[滴定时,
,然后用NaOH标准溶液滴定反应生成的酸[滴定时,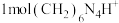 与1molH+相当]。
与1molH+相当]。实验步骤:
i.移取VmL出水样品,以酚酞为指示剂,用cmol/LNaOH标准液滴定至终点,中和样品中的酸。消耗NaOH溶液的体积为V1mL;
ii.另取同样体积的样品,加入足量的中性甲醛溶液,摇匀,静置5min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为V2mL。
①步骤ii中滴定至终点的现象为
②该水样中残留
 浓度为
浓度为
您最近一年使用:0次
解题方法
3 .  (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用 作感光剂,以
作感光剂,以 溶液为显色剂。其光解反应的化学方程式为
溶液为显色剂。其光解反应的化学方程式为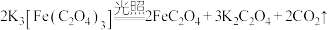 ;显色反应中生成的蓝色物质的化学式为
;显色反应中生成的蓝色物质的化学式为___________ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
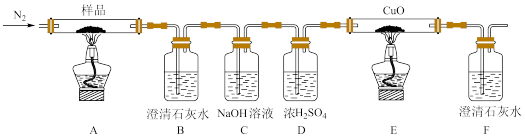
①通入氮气的目的是___________ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________ 、___________ 。
③为防止倒吸,停止实验时应进行的操作是___________ 。
④样品完全分解后,装置A中的残留物含有FeO和 ,检验
,检验 存在的方法是:
存在的方法是:___________ 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀 酸化,用c
酸化,用c
 溶液滴定至终点。滴定终点的现象是
溶液滴定至终点。滴定终点的现象是___________ 。
②向上述溶液中加入适量还原剂将 完全还原为
完全还原为 ,加入稀
,加入稀 酸化后,用c
酸化后,用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液VmL。该晶体中铁的质量分数的表达式为
溶液VmL。该晶体中铁的质量分数的表达式为___________ 。若滴定前滴定管尖嘴内无气泡,终点读数时滴定管尖嘴内留有气泡,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:(1)晒制蓝图时,用
 作感光剂,以
作感光剂,以 溶液为显色剂。其光解反应的化学方程式为
溶液为显色剂。其光解反应的化学方程式为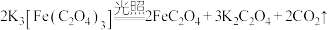 ;显色反应中生成的蓝色物质的化学式为
;显色反应中生成的蓝色物质的化学式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和
 ,检验
,检验 存在的方法是:
存在的方法是:(3)测定三草酸合铁酸钾中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀
 酸化,用c
酸化,用c
 溶液滴定至终点。滴定终点的现象是
溶液滴定至终点。滴定终点的现象是②向上述溶液中加入适量还原剂将
 完全还原为
完全还原为 ,加入稀
,加入稀 酸化后,用c
酸化后,用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液VmL。该晶体中铁的质量分数的表达式为
溶液VmL。该晶体中铁的质量分数的表达式为
您最近一年使用:0次
名校
解题方法
4 . 六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3,并测定所得产品中氯的含量
(一)制备MgCl2•6NH3
I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
(1)滴液漏斗中支管的作用为___________ 。
(2)三颈瓶中发生反应的化学方程式为___________ 。
(3)该实验装置中的不足之处为___________ 。
II.将NH3通入无水MgCl2的乙二醇溶液中,充分反应(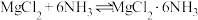 )后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
)后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
(4)生成MgCl2•6NH3的反应需在冰水浴中进行,其可能原因有___________(填字母)。
(5)洗涤产品时,应选择的洗涤剂为___________(填字母)。
(二)测定产品中氯的含量,步骤如下:
步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20 的AgNO3标准液滴定溶液中
的AgNO3标准液滴定溶液中 ,记录消耗标准液的体积;
,记录消耗标准液的体积;
步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(6)步骒1中,用稀硝酸溶解样品的目的为___________ 。
(7)该品中氯的质量分数为___________ (保留小数点后2位);该实验值与理论值(36.04%)有偏差,造成该偏差的可能原因是(已知滴定操作均正确)___________ 。
(一)制备MgCl2•6NH3
I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点
 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。(1)滴液漏斗中支管的作用为
(2)三颈瓶中发生反应的化学方程式为
(3)该实验装置中的不足之处为
II.将NH3通入无水MgCl2的乙二醇溶液中,充分反应(
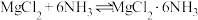 )后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
)后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
| NH3 | MgCl2 | MgCl2•NH3 |
| 水 | 易溶 | 易溶 | 易溶 |
| 甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
| 乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
| A.反应吸热,促进反应正向进行 | B.加快反应速率 |
| C.防止氨气挥发,提高氨气利用率 | D.降低产物的溶解度 |
| A.冰浓氨水 | B.乙二醇和水的混合液 |
| C.氨气饱和的甲醇溶液 | D.氨气饱和的乙二醇溶液 |
(二)测定产品中氯的含量,步骤如下:
步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20
 的AgNO3标准液滴定溶液中
的AgNO3标准液滴定溶液中 ,记录消耗标准液的体积;
,记录消耗标准液的体积;步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(6)步骒1中,用稀硝酸溶解样品的目的为
(7)该品中氯的质量分数为
您最近一年使用:0次
2022-05-10更新
|
465次组卷
|
7卷引用:天津市耀华中学2022-2023学年高三上学期第三次月考化学试题
天津市耀华中学2022-2023学年高三上学期第三次月考化学试题河南省商丘市2022届高三下学期第三次模拟考试化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)(已下线)化学(福建B卷)-学易金卷:2023年高考第一次模拟考试湖南省株洲市北附高级中学2022-2023学年高三上学期第五次月考化学试题
名校
解题方法
5 . 常温下, 的电离平衡常数
的电离平衡常数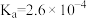 。亚硝酸钠
。亚硝酸钠 是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
Ⅰ、亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,
(1)则反应的化学方程式为_______ 。
Ⅱ、为了测定样品中亚硝酸钠的含量,称取 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 的酸性
的酸性 溶液进行滴定,实验所得数据如下表。
溶液进行滴定,实验所得数据如下表。
(2)第一组实验数据出现较明显异常,造成异常的原因可能是_______(填字母序号)。
(3)  溶液应用
溶液应用_______ 滴定管盛装(填“酸式”或者“碱式”),滴定过程中,眼睛应注视_______ ;
(4)根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为_______ 。
 的电离平衡常数
的电离平衡常数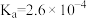 。亚硝酸钠
。亚硝酸钠 是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。Ⅰ、亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,
(1)则反应的化学方程式为
Ⅱ、为了测定样品中亚硝酸钠的含量,称取
 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 的酸性
的酸性 溶液进行滴定,实验所得数据如下表。
溶液进行滴定,实验所得数据如下表。| 滴定次数 | 1 | 2 | 3 | 4 |
 溶液体积/ 溶液体积/ | 20.60 | 20.02 | 20.00 | 19.98 |
| A.酸式滴定管用蒸馏水洗净后未用标准液润洗 |
| B.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡 |
C.判断终点时,滴入一滴酸性 溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色 溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色 |
| D.观察滴定终点时俯视读数 |
 溶液应用
溶液应用(4)根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为
您最近一年使用:0次
解题方法
6 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下。

回答下列问题:
(1)步骤①中得到的氧化产物是_______ 。
(2)步骤②过滤中需要用到的玻璃仪器有_______ 。
(3)步骤③中主要反应的离子方程式为_______ 。
(4)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_______ (写名称)。
(5)上述工艺中,步骤⑥醇洗的目的是_______ 。
(6)准确称取所制备的CuCl样品m g,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的
溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液b mL,反应中
溶液b mL,反应中 被还原为
被还原为 。
。
①用 溶液滴定时发生反应的离子方程式为
溶液滴定时发生反应的离子方程式为_______ 。
②样品中CuCl的质量分数为_______ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)步骤②过滤中需要用到的玻璃仪器有
(3)步骤③中主要反应的离子方程式为
(4)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(5)上述工艺中,步骤⑥醇洗的目的是
(6)准确称取所制备的CuCl样品m g,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的
溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液b mL,反应中
溶液b mL,反应中 被还原为
被还原为 。
。①用
 溶液滴定时发生反应的离子方程式为
溶液滴定时发生反应的离子方程式为②样品中CuCl的质量分数为
您最近一年使用:0次
解题方法
7 . 二氯化钒(VCl2)有强还原性和吸湿性,熔点为425℃、沸点为900℃,是制备多种医药、催化剂、含钒化合物的中间体。学习小组在实验室制备VCl2并进行相关探究。回答下列问题:

(1)小组同学通过VCl3分解制备VCl2,并检验气体产物。
①按气流方向,上述装置合理的连接顺序为___ (用小写字母填空)。
②A中盛放NaNO2溶液的仪器名称为___ ,其中发生反应的离子方程式为__ ;m管的作用为___ 。
③实验过程中需持续通入N2,其作用为___ 。
④实验后,选用D中所得溶液和其他合理试剂,设计实验方案证明C处有Cl2生成___ 。
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量1.3775g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol·L-1AgNO3标准溶液滴定Cl-达到滴定终点时消耗标准液体积为46.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为___ 。
②产品中VCl3与VCl2的物质的量之比为___ 。

(1)小组同学通过VCl3分解制备VCl2,并检验气体产物。
①按气流方向,上述装置合理的连接顺序为
②A中盛放NaNO2溶液的仪器名称为
③实验过程中需持续通入N2,其作用为
④实验后,选用D中所得溶液和其他合理试剂,设计实验方案证明C处有Cl2生成
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量1.3775g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol·L-1AgNO3标准溶液滴定Cl-达到滴定终点时消耗标准液体积为46.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为
②产品中VCl3与VCl2的物质的量之比为
您最近一年使用:0次
2021-05-03更新
|
369次组卷
|
3卷引用:天津市和平区2021届高三第二次模拟考试化学试题
天津市和平区2021届高三第二次模拟考试化学试题天津市和平区2020-2021学年高三下学期第二次质量调查(二模)化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)
8 . 化学上常用燃烧法确定有机物的组成。这种方法是在电炉里加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。如图所列装置是用燃烧法确定有机物分子式常用的装置。
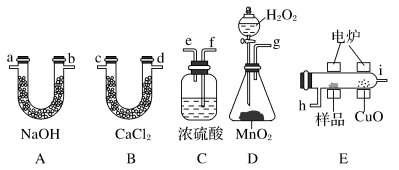
回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是__ 。
(2)C装置中浓H2SO4的作用是___ 。
(3)D装置中MnO2的作用是__ 。
(4)燃烧管中CuO的作用是___ 。
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为___ 。
(6)要确定该有机物的分子式,还要___ 。

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是
(2)C装置中浓H2SO4的作用是
(3)D装置中MnO2的作用是
(4)燃烧管中CuO的作用是
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
(6)要确定该有机物的分子式,还要
您最近一年使用:0次
2021-01-03更新
|
447次组卷
|
12卷引用:天津市南开中学人教版高中化学选修5预习练习:第一章 第四节 研究有机化合物的一般步骤和方法 第2课时
天津市南开中学人教版高中化学选修5预习练习:第一章 第四节 研究有机化合物的一般步骤和方法 第2课时(已下线)2011-2012年新疆乌鲁木齐市第八中学高一下学期期末考试化学卷2015-2016学年辽宁大连经济技术开发区得胜高中高二下期中化学试卷2018版化学(苏教版)高考总复习专题十二课时跟踪训练--认识有机化合物【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题3.2有机化合物结构的测定能力提升宁夏石嘴山市第三中学2019-2020学年高二10月月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二下学期第二次月考化学试题江西省南昌市新建区第二中学2020-2021学年高二上学期“新星计划”体验营10月考化学试题(已下线)1.4 研究有机化合物的一般步骤和方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)1.2 研究有机化合物的一般方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)1.2.2 确定有机化合物的实验式与分子结构-2020-2021学年高二化学课时同步练(人教版2019选择性必修3)
9 . 实验室使用的纯度较高的NaCl可用含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、 等杂质的海盐为原料制备,实验室模拟工业制备流程如下图
等杂质的海盐为原料制备,实验室模拟工业制备流程如下图
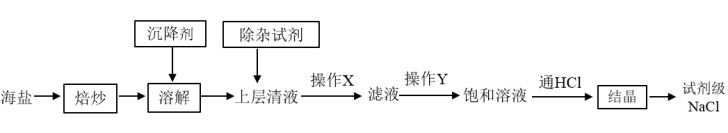
(1)焙炒海盐的目的是___________
(2)溶解时,为吸附水中的悬浮物应加入沉降剂,下列哪种沉降剂最佳___________
A.明矾B.硫酸铁C.硫酸铝D.氯化铁
(3)操作X为___________
(4)根据除杂原理,在下表中填写除杂时依次添加的试剂及预期沉淀的离子。
(5)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
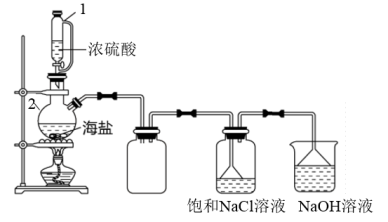
①写出制备HCl气体的化学反应方程式(产物之一为正盐)___________
②相比分液漏斗,选用仪器1的优点是___________
③写出仪器2的名称___________
④盛放NaOH溶液的烧杯的用途是___________
(6)已知 ;
;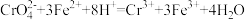 设计如下实验测定NaCl产品中
设计如下实验测定NaCl产品中 的含量,填写下列表格。
的含量,填写下列表格。
 等杂质的海盐为原料制备,实验室模拟工业制备流程如下图
等杂质的海盐为原料制备,实验室模拟工业制备流程如下图
(1)焙炒海盐的目的是
(2)溶解时,为吸附水中的悬浮物应加入沉降剂,下列哪种沉降剂最佳
A.明矾B.硫酸铁C.硫酸铝D.氯化铁
(3)操作X为
(4)根据除杂原理,在下表中填写除杂时依次添加的试剂及预期沉淀的离子。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | NaOH溶液 | Mg2+、Fe3+ |
| 步骤2 | ||
| 步骤3 |
(5)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①写出制备HCl气体的化学反应方程式(产物之一为正盐)
②相比分液漏斗,选用仪器1的优点是
③写出仪器2的名称
④盛放NaOH溶液的烧杯的用途是
(6)已知
 ;
;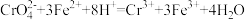 设计如下实验测定NaCl产品中
设计如下实验测定NaCl产品中 的含量,填写下列表格。
的含量,填写下列表格。| 操作 | 现象 | 目的/结论 |
| 称取样品m1g加水溶解,加盐酸调至弱酸性,滴加过最c1 mol·L-1BaCl2溶液V1mL | 稍显浑浊 | 目的: |
| 继续滴加过量c2 mol·L-1K2CrO4溶液V2 mL | 黄色沉淀 | 目的:沉淀过量的Ba2+ |
| 过滤洗涤,将魂液加水至200.00mL,取25.00mL滤液于锥形瓶中,用c3 mol·L-1FeSO4溶液滴定3次。平均消耗FeSO4溶液V3 mL. | 结论:测定 的质量分数 的质量分数 | |
| 若某次滴定,FeSO4溶液不小心溅出2滴。 | 计算得到的 的含量 的含量 |
您最近一年使用:0次
名校
解题方法
10 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O 作感光剂,以K3[Fe(CN)6 ]溶液为显色剂。其光解反应的化学方程式为:2 K3[Fe(C2O4)3] 2FeC2O4 +3K2C2O4 +2CO2↑;显色反应的化学方程式为
2FeC2O4 +3K2C2O4 +2CO2↑;显色反应的化学方程式为___________ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是___________ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________ 、___________ 。
③为防止倒吸,停止实验时应进行的操作是___________ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是___________ 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量16. 80 g样品于锥形瓶中,溶解后加稀H2SO4酸化,用一定浓度KMnO4溶液滴定至终点。滴定终点的现象是___________ 。
②向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用0.3000 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液20. 00 mL。该晶体中铁的质量分数为___________ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O 作感光剂,以K3[Fe(CN)6 ]溶液为显色剂。其光解反应的化学方程式为:2 K3[Fe(C2O4)3]
 2FeC2O4 +3K2C2O4 +2CO2↑;显色反应的化学方程式为
2FeC2O4 +3K2C2O4 +2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
(3)测定三草酸合铁酸钾中铁的含量。
①称量16. 80 g样品于锥形瓶中,溶解后加稀H2SO4酸化,用一定浓度KMnO4溶液滴定至终点。滴定终点的现象是
②向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用0.3000 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液20. 00 mL。该晶体中铁的质量分数为
您最近一年使用:0次