名校
解题方法
1 . 过氧化钠因吸收空气中的二氧化碳和水而变质,某兴趣小组对久置的过氧化钠样品M进行实验探究。
实验Ⅰ:甲同学设计下图所示装置探究样品M的变质情况。
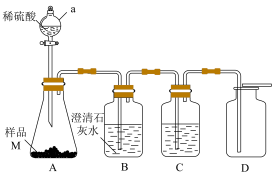
(1)仪器a的名称是___________ 。
(2)装置C中的溶液是___________ ,其作用是___________ 。
(3)若B中___________ ,D中___________ ,则样品M部分变质。(填B、D中验证实验的反应现象)
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为___________ 。
资料显示, 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物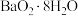 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入溶液。
(5)该实验证明 与水反应有
与水反应有 生成,则滴入
生成,则滴入 溶液后观察到的现象是
溶液后观察到的现象是___________ ,此反应的离子方程式为___________ 。
丙同学利用如图装置进行实验,排除了 的干扰。
的干扰。
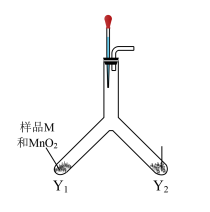
实验Ⅳ:往Y型管中加入相应药品,塞紧橡胶塞,滴入蒸馏水……产生白色沉淀,说明样品M已变质。
(6)请补充完整上述实验的操作过程:___________ 。
实验Ⅰ:甲同学设计下图所示装置探究样品M的变质情况。

(1)仪器a的名称是
(2)装置C中的溶液是
(3)若B中
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为
资料显示,
 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物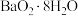 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入溶液。
(5)该实验证明
 与水反应有
与水反应有 生成,则滴入
生成,则滴入 溶液后观察到的现象是
溶液后观察到的现象是丙同学利用如图装置进行实验,排除了
 的干扰。
的干扰。
实验Ⅳ:往Y型管中加入相应药品,塞紧橡胶塞,滴入蒸馏水……产生白色沉淀,说明样品M已变质。
(6)请补充完整上述实验的操作过程:
您最近一年使用:0次
名校
2 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究金属钠在氧气中受热所剩固体的成分 | 取少量固体粉末,加入 蒸馏水 蒸馏水 | 若无气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 |
| B | 探究 与 与 反应的限度 反应的限度 | 取 溶液于试管中,加入 溶液于试管中,加入 溶液,充分反应后滴入几滴 溶液,充分反应后滴入几滴 溶液 溶液 | 若溶液变红,则 与 与 的反应有一定限度 的反应有一定限度 |
| C | 检验某无色溶液中是否含有 | 取少量该溶液于试管中,滴加稀氢氧化钠溶液,用湿润的红色石蕊试纸放试管口 | 试纸不变蓝,证明溶液中无铵根离子 |
| D | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液 溶液 | 若有白色沉淀产生,则样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-13更新
|
234次组卷
|
4卷引用:福建省永春第一中学2023届高三下学期期初考试化学试题
名校
解题方法
3 . 下列实验操作及现象(或结论)描述正确的是
A.为了检验 晶体已氧化变质,将 晶体已氧化变质,将 样品溶于稀 样品溶于稀 后,滴加 后,滴加 溶液,发现溶液变红 溶液,发现溶液变红 |
| B.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来 |
C.将镁条点燃后迅速伸入集满 的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生 的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生 |
D.将 沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水 沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水 固体 固体 |
您最近一年使用:0次
2023-08-01更新
|
153次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高三暑期复习检测化学试题
名校
解题方法
4 . 氨基甲酸铵(H2NCOONH4)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置制取氨基甲酸铵。
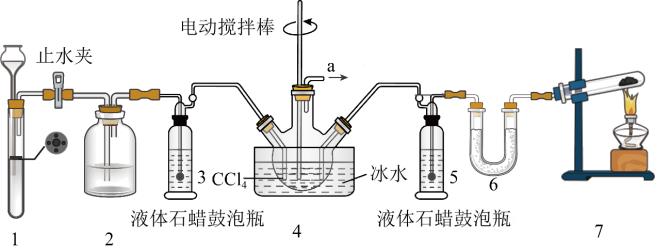
已知:①制取氨基甲酸铵反应为:2NH3(g)+CO2(g) H2NCOONH4(s) △H<0。
H2NCOONH4(s) △H<0。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
回答下列问题:
(1)检查装置1气密性的操作是_______ 。
(2)装置6中的试剂是_______ ,导管a出口直接与尾气处理装置连接,该尾气处理装置中的试剂是_______ 。
(3)三颈烧瓶需用冰水浴冷却,其目的是_______ 。
(4)CCl4液体中产生较多晶体悬浮物时,即停止反应。停止反应的操作是_______ ,从三颈烧瓶中分离出粗产品的操作是_______ 。
(5)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。写出石灰水与氨基甲酸铵反应转化为碳酸钙的反应方程式_______ 。样品中氨基甲酸铵的质量分数是_______ 。(计算结果保留小数点后两位)[Mr(H2NCOONH4)=78、Mr(NH4HCO3)=79]

已知:①制取氨基甲酸铵反应为:2NH3(g)+CO2(g)
 H2NCOONH4(s) △H<0。
H2NCOONH4(s) △H<0。②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
回答下列问题:
(1)检查装置1气密性的操作是
(2)装置6中的试剂是
(3)三颈烧瓶需用冰水浴冷却,其目的是
(4)CCl4液体中产生较多晶体悬浮物时,即停止反应。停止反应的操作是
(5)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。写出石灰水与氨基甲酸铵反应转化为碳酸钙的反应方程式
您最近一年使用:0次
解题方法
5 . 过氧化钠因吸收空气里的二氧化碳和水而变质,某兴趣小组对久置的过氧化钠样品M进行实验探究。
实验Ⅰ:甲同学设计下图所示装置探究样品M的变质情况。
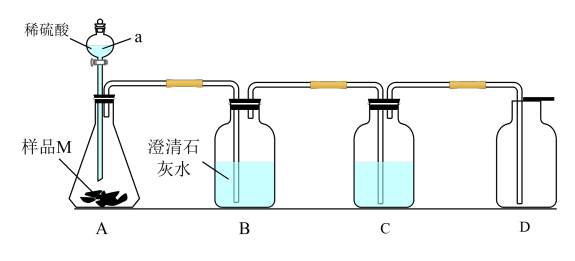
(1)仪器a的名称是_______ 。
(2)装置C中的溶液是_______ ,其作用是_______ 。
(3)如果装置B中出现浑浊,D中收集到的气体能使带火星的木条复燃,则样品M的变质情况为_______ 。
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为_______ 。
资料显示, 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物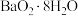 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入 溶液。实验证明
溶液。实验证明 与水反应有
与水反应有 生成。
生成。
(5)滴入 溶液后观察到的现象是
溶液后观察到的现象是_______ ,此反应的离子方程式为_______ 。
丙同学利用如图装置进行实验,排除了 的干扰。
的干扰。
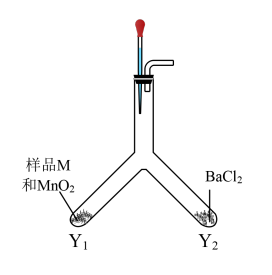
实验Ⅳ:往Y型管中加入相应药品,塞紧橡胶塞,滴入蒸馏水……产生白色沉淀,说明样品M已变质。
(6)请补充完整上述实验的操作过程:_______ 。
实验Ⅰ:甲同学设计下图所示装置探究样品M的变质情况。

(1)仪器a的名称是
(2)装置C中的溶液是
(3)如果装置B中出现浑浊,D中收集到的气体能使带火星的木条复燃,则样品M的变质情况为
实验Ⅱ:乙同学用氯化钡溶液作为检验试剂进行实验。
(4)根据产生白色沉淀,乙同学认为样品M已变质,该反应的离子方程式为
资料显示,
 能与
能与 、NaOH溶液反应生成白色不溶物
、NaOH溶液反应生成白色不溶物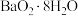 。据此,丙同学对乙同学的检验结果提出质疑并进行实验。
。据此,丙同学对乙同学的检验结果提出质疑并进行实验。实验Ⅲ:取少量纯净的过氧化钠固体溶于蒸馏水,先加入过量稀硫酸,再滴入
 溶液。实验证明
溶液。实验证明 与水反应有
与水反应有 生成。
生成。(5)滴入
 溶液后观察到的现象是
溶液后观察到的现象是丙同学利用如图装置进行实验,排除了
 的干扰。
的干扰。
实验Ⅳ:往Y型管中加入相应药品,塞紧橡胶塞,滴入蒸馏水……产生白色沉淀,说明样品M已变质。
(6)请补充完整上述实验的操作过程:
您最近一年使用:0次
名校
解题方法
6 . 过氧化钠常作漂白剂、杀菌剂、消毒剂,保存不当容易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______ 溶液,若充分振荡后有白色沉淀,则证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。

① 装置出来的气体是否需要干燥
装置出来的气体是否需要干燥_______ (填“是”或“否”);请写出 中发生的化学反应方程式
中发生的化学反应方程式_______ 。
②实验结束时,读取实验中生成气体的体积时,不合理的是_______ (填字母)。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得 、
、 中液面高度相同
中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
③读出量筒内水的体积后,折算成氧气的质量为mg,则样品中过氧化钠的质量分数为_______ (用a、m表示)。
④实验完成后, 到
到 之间导管内残留水会使测量结果
之间导管内残留水会使测量结果_______ (填“偏大”偏小”或“不影响”)。
(3)2020年“新冠肺炎”疫情让人们认识到正确使用消毒剂的重要性,其中漂白粉也是常用消毒剂之一。
①工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是_______ (填化学式)。
②漂白粉溶于水后,受空气中的 作用,产生有漂白、杀菌作用的次氯酸,其化学方程式为:
作用,产生有漂白、杀菌作用的次氯酸,其化学方程式为:_______ 。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。

①
 装置出来的气体是否需要干燥
装置出来的气体是否需要干燥 中发生的化学反应方程式
中发生的化学反应方程式②实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得
 、
、 中液面高度相同
中液面高度相同c.视线与凹液面的最低点相平读取量筒中水的体积
③读出量筒内水的体积后,折算成氧气的质量为mg,则样品中过氧化钠的质量分数为
④实验完成后,
 到
到 之间导管内残留水会使测量结果
之间导管内残留水会使测量结果(3)2020年“新冠肺炎”疫情让人们认识到正确使用消毒剂的重要性,其中漂白粉也是常用消毒剂之一。
①工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是
②漂白粉溶于水后,受空气中的
 作用,产生有漂白、杀菌作用的次氯酸,其化学方程式为:
作用,产生有漂白、杀菌作用的次氯酸,其化学方程式为:
您最近一年使用:0次
名校
解题方法
7 . 过氧化钠保存不当容易变质,生成Na2CO3.
(1)某过氧化钠样品已经部分变质,请你将实验过程填写完整,证明过氧化钠已经变质 (试剂:a.水b.盐酸溶液c.氯化钡溶液)取少量样品于试管中,滴加___________ (选填试剂)若看到试管中有___________ (填现象)则说明过氧化钠已变质
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
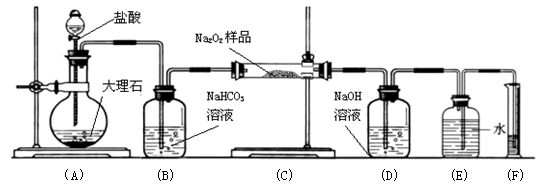
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和C中发生反应的化学方程式:
装置A:___________
装置C:___________
②NaOH的作用是___________
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________ (用字母表示)
(1)某过氧化钠样品已经部分变质,请你将实验过程填写完整,证明过氧化钠已经变质 (试剂:a.水b.盐酸溶液c.氯化钡溶液)取少量样品于试管中,滴加
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和C中发生反应的化学方程式:
装置A:
装置C:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
2021-04-15更新
|
199次组卷
|
2卷引用:福建省南平市浦城县2019-2020学年高一上学期第一次月考化学试题
名校
8 . 吊白块( ,
,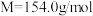 )在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
 的制备:如图,在广口瓶中加入一定量
的制备:如图,在广口瓶中加入一定量 和水,振荡溶解,缓慢通入
和水,振荡溶解,缓慢通入 ,至广口瓶中液体pH约为4,制得
,至广口瓶中液体pH约为4,制得 溶液。
溶液。

(1)装置I中产生气体的化学反应方程式为_______ ;II中多孔球泡的作用是_______ 。
(2)实验室检测 晶体在空气中是否发生氧化变质的实验方案是
晶体在空气中是否发生氧化变质的实验方案是_______ 。
吊白块的制备:如图,向仪器A中加入上述 溶液、稍过量的锌粉和一定量甲醛,在80~90℃下,反应约3h,冷却过滤。
溶液、稍过量的锌粉和一定量甲醛,在80~90℃下,反应约3h,冷却过滤。

(3)仪器A的名称为_______ ;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是_______ 。
(4)将仪器A中的反应温度恒定在80~90℃的目的是_______ 。
吊白块纯度的测定:将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含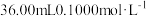 酸性
酸性 吸收甲醛(不考虑
吸收甲醛(不考虑 的有影响,
的有影响, ),再用
),再用 的草酸标准溶液滴定酸性
的草酸标准溶液滴定酸性 ,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)吊白块样品的纯度为_______ %(保留思维有效数字);若 标准溶液久置释放出
标准溶液久置释放出 而变质,会导致测量结果
而变质,会导致测量结果_______ (填“偏高”、“偏低”或“无影响”)
 ,
,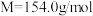 )在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下: 的制备:如图,在广口瓶中加入一定量
的制备:如图,在广口瓶中加入一定量 和水,振荡溶解,缓慢通入
和水,振荡溶解,缓慢通入 ,至广口瓶中液体pH约为4,制得
,至广口瓶中液体pH约为4,制得 溶液。
溶液。
(1)装置I中产生气体的化学反应方程式为
(2)实验室检测
 晶体在空气中是否发生氧化变质的实验方案是
晶体在空气中是否发生氧化变质的实验方案是吊白块的制备:如图,向仪器A中加入上述
 溶液、稍过量的锌粉和一定量甲醛,在80~90℃下,反应约3h,冷却过滤。
溶液、稍过量的锌粉和一定量甲醛,在80~90℃下,反应约3h,冷却过滤。
(3)仪器A的名称为
(4)将仪器A中的反应温度恒定在80~90℃的目的是
吊白块纯度的测定:将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含
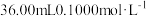 酸性
酸性 吸收甲醛(不考虑
吸收甲醛(不考虑 的有影响,
的有影响, ),再用
),再用 的草酸标准溶液滴定酸性
的草酸标准溶液滴定酸性 ,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。(5)吊白块样品的纯度为
 标准溶液久置释放出
标准溶液久置释放出 而变质,会导致测量结果
而变质,会导致测量结果
您最近一年使用:0次
解题方法
9 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验,请回答以下问题:
(1)纯净的Na2O2是________ 色固体,其中氧元素的化合价为_________ 价。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了20.0 g样品,并设计用如图装置通过排水法测定E中收集到的O2的体积,来测定过氧化钠的质量分数。
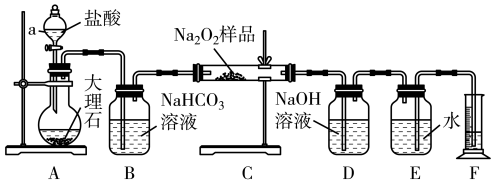
①将仪器连接好以后、加药品之前必须进行的一步操作_____ ,A中主要反应的离子方程式:_____ ;
②装置B的作用是除去二氧化碳气体中的______ 气体,写出相应的化学方程式_____ 。读出量筒内水的体积后,将其折算成标准状况下氧气的体积为2.24L,则样品中过氧化钠的质量分数为_____ 。
(1)纯净的Na2O2是
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了20.0 g样品,并设计用如图装置通过排水法测定E中收集到的O2的体积,来测定过氧化钠的质量分数。

①将仪器连接好以后、加药品之前必须进行的一步操作
②装置B的作用是除去二氧化碳气体中的
您最近一年使用:0次
名校
解题方法
10 . 过氧化钠常做漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______ 溶液,若充分振荡后有白色沉淀,则证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步是_________ 。
②请写出A中发生的化学反应方程式___________ ;B装置出来的气体是否需要干燥______ (填“是”或“否”)。
③D中NaOH溶液的作用________ 。
④实验结束时,读取实验中生成气体的体积时,不合理的是__________ 。(填字母)
a 直接读取气体体积,不需冷却到室温
b 上下移动量筒,使得E、F中液面高度相同
c 视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为____ (用a、V表示)。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果_____ (填“偏大”“偏小”或“不影响”)。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步是
②请写出A中发生的化学反应方程式
③D中NaOH溶液的作用
④实验结束时,读取实验中生成气体的体积时,不合理的是
a 直接读取气体体积,不需冷却到室温
b 上下移动量筒,使得E、F中液面高度相同
c 视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为
⑥实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次



