名校
解题方法
1 . 过氧化钠常做漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______ 溶液,若充分振荡后有白色沉淀,则证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步是_________ 。
②请写出A中发生的化学反应方程式___________ ;B装置出来的气体是否需要干燥______ (填“是”或“否”)。
③D中NaOH溶液的作用________ 。
④实验结束时,读取实验中生成气体的体积时,不合理的是__________ 。(填字母)
a 直接读取气体体积,不需冷却到室温
b 上下移动量筒,使得E、F中液面高度相同
c 视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为____ (用a、V表示)。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果_____ (填“偏大”“偏小”或“不影响”)。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步是
②请写出A中发生的化学反应方程式
③D中NaOH溶液的作用
④实验结束时,读取实验中生成气体的体积时,不合理的是
a 直接读取气体体积,不需冷却到室温
b 上下移动量筒,使得E、F中液面高度相同
c 视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为
⑥实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
名校
解题方法
2 . 化学兴趣小组设定以下实验方案,测定某已部分变质为Na2CO3的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:______________________________
(2)实验中需加热至恒重的目的是:________________________________
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量BaCl2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_________________
(4)该实验过程中发生的离子方程式为_____________________________________
方案三:按如图装置进行实验:

(5)B装置内所盛试剂是______________ ;D装置的作用是_________________ ;分液漏斗中________ (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(6)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为_________________ 。(用百分数表示,保留小数点后一位)
(7)根据此实验测得的数据,与方案一、二测定结果相比明显偏小,因为实验装置还存在一个明显缺陷是:_______________________________________ 。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中需加热至恒重的目的是:
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量BaCl2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(4)该实验过程中发生的离子方程式为
方案三:按如图装置进行实验:

(5)B装置内所盛试剂是
(6)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为
(7)根据此实验测得的数据,与方案一、二测定结果相比明显偏小,因为实验装置还存在一个明显缺陷是:
您最近一年使用:0次
名校
3 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用如图装置来测定过氧化钠的质量分数。

①装置中仪器a的名称是_________ ,装置D的作用是________________ ;
②将仪器连接好以后,必须进行的第一步操作是_____________________ ;
③写出装置C中发生主要反应的化学方程式_______________________ ;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是________ (填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________ 。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用如图装置来测定过氧化钠的质量分数。

①装置中仪器a的名称是
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生主要反应的化学方程式
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
2020-01-22更新
|
548次组卷
|
5卷引用:【校级联考】福建省八县(市)一中2018-2019学年高一上学期期末考试化学试题
4 . 下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 鉴别NO2、溴蒸气 | 用湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝则该气体为溴蒸气 |
| B | 验证I-还原性强于Cl- | 向NaI溶液中依次滴入少量新制氯水和苯,振荡、静置,上层溶液呈紫红色 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验SO2的漂白性 | 将SO2气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-28更新
|
402次组卷
|
4卷引用:福建省长汀、连城一中等六校2020届高三上学期期中考联考化学试题
名校
解题方法
5 . 砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
步骤I:反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
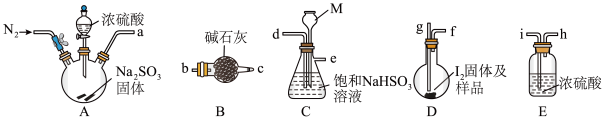
(1)装置连接的顺序为a→_____________ (填接口字母顺序);M仪器在实验过程中的作用是:_________________ ;
(2)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________ ;③关闭弹簧夹,打开分液漏斗塞子及活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,……
步骤④中继续通入N2的目的是______________________
步骤II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(3)Na2S2O3标准液应装在_____________ (填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________ ;
(4)用Na2S2O3溶液滴定I2时,应用___________ 作为指示剂。滴定终点的现象是:___________
(5)滴定实验重复四次得到数据如下:
①若实验开始时,向D装置中加入10.00g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________ %。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________ (填“偏高”、“偏低”或“不变”)。
步骤I:反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:

(1)装置连接的顺序为a→
(2)操作步骤为:①连接装置并检查装置气密性,②装入药品,
步骤④中继续通入N2的目的是
步骤II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(3)Na2S2O3标准液应装在
(4)用Na2S2O3溶液滴定I2时,应用
(5)滴定实验重复四次得到数据如下:
| 实验 | ① | ② | ③ | ④ |
| 消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将
您最近一年使用:0次
名校
解题方法
6 . 下列有关实验、现象、及结论等叙述正确的有
①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,X具有强氧化性
②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有S2O32-
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有Fe2+
⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,酸性:硼酸<碳酸
⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,X具有强氧化性
②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有S2O32-
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有Fe2+
⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,酸性:硼酸<碳酸
⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
| A.1条 | B.2条 | C.3条 | D.4条 |
您最近一年使用:0次
2019-12-10更新
|
998次组卷
|
3卷引用:福建泉州实验中学、惠安一中、安溪一中、养正中学2021-2022高三上学期期中考试化学试题
7 . 高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
【资料】K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
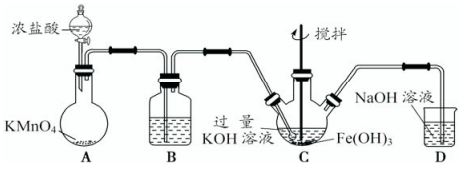
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________ 。
②除杂装置B中的试剂为___________ 。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________ 。
④D为尾气处理装置,发生反应的离子方程式为___________ 。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有___________ 。该离子的产生___________ (填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________ 。方案Ⅱ得出氧化性:Cl2___________ FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________ 。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
【资料】K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。

①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为
②除杂装置B中的试剂为
③C为制备K2FeO4装置,KOH溶液过量的原因是
④D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②方案Ⅱ用KOH溶液洗涤的目的是
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)
您最近一年使用:0次
2019-02-05更新
|
1428次组卷
|
3卷引用:【市级联考】福建省南平市2019届高三上学期第一次质量检查理科综合化学试题
【市级联考】福建省南平市2019届高三上学期第一次质量检查理科综合化学试题(已下线)2019年高考总复习巅峰冲刺-专题08 常见无机物及其应用应试策略2020届二轮复习 氧化还原反应 专题卷(全国通用)
8 . 根据下列实验操作和实验现象所得到的实验结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
| B | 向氯仿样品中加入硝酸银溶液 | 有白色沉淀产生 | 样品已变质 |
| C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
| D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 下列说法正确的是
| A.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用滴管滴加蒸馏水到刻度线 |
| B.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 |
| C.利用澄清石灰水可以鉴别NaHCO3溶液和Na2CO3溶液 |
| D.用BaCl2溶液来检验暴露在空气中的Na2SO3样品是否变质 |
您最近一年使用:0次
10 . 研究钠及其化合物有重要意义。
(1)实验室配制0.1mol•L-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是_________ 。
②实验中需用托盘天平(带砝码)称量碳酸钠固体_______________ g。
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有___________ 。
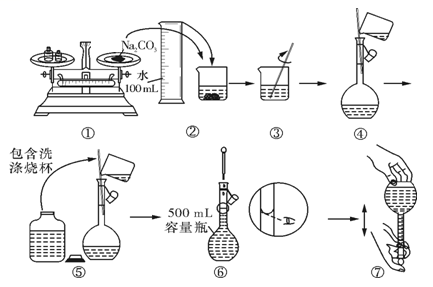
A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是___________ 。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:_________________ (说明操作、现象和结论)。
(1)实验室配制0.1mol•L-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是
②实验中需用托盘天平(带砝码)称量碳酸钠固体
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有

A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:
您最近一年使用:0次
2017-12-25更新
|
614次组卷
|
4卷引用:福建省永安一中、德化一中、漳平一中2017-2018学年高一上学期第二次联考化学试题



