名校
解题方法
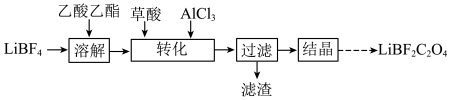
1 . 在无水无氧条件下制备新型锂离子电池电解质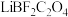 ,其过程可表示为:
,其过程可表示为:
(1)草酸的结构简式为 ,
,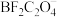 具有五元环结构,
具有五元环结构, 原子的轨道杂化类型是
原子的轨道杂化类型是 ,其结构式可表示为
,其结构式可表示为___________ 。
(2)实验室可以在 用浓硝酸在硝酸汞催化下氧化乙炔(
用浓硝酸在硝酸汞催化下氧化乙炔( )气体来制备草酸,主要装置如图所示。
)气体来制备草酸,主要装置如图所示。
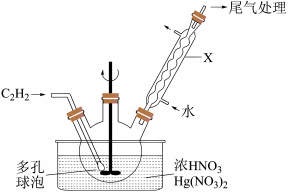
①仪器 的名称为
的名称为___________ ;
②用电石制得的 含有
含有 杂质,通过计算平衡常数说明用
杂质,通过计算平衡常数说明用 溶液除去
溶液除去 气体的可行性
气体的可行性___________ ;(常温下, ,
, 的
的 ,
,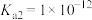 )
)
③装置中浓硝酸的还原产物为 ,生成草酸的化学方程式为
,生成草酸的化学方程式为___________ ,当硝酸的质量分数超过 或温度高于
或温度高于 ,草酸的产率开始下降,其原因分别是
,草酸的产率开始下降,其原因分别是___________ 。
(3) 遇水剧烈水解。
遇水剧烈水解。 和
和 混合加热制取无水
混合加热制取无水 时,
时, 的作用是
的作用是___________ 。
(4)“溶解”和“转化”操作在如图所示装置中进行。“溶解”时的操作依次为:称取一定质量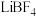 置于三颈瓶中→
置于三颈瓶中→___________ →搅拌直至完全溶解(填字母)。
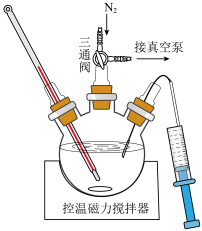
a.注入乙酸乙酯→充入→抽真空
b.抽真空→注入乙酸乙酯→充入
c.抽真空→充入 →注入乙酸乙酯
→注入乙酸乙酯
(5)产品(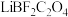 )纯度的测定
)纯度的测定
步骤1:称取 样品(假设只含
样品(假设只含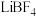 杂质)配制成
杂质)配制成 溶液。(
溶液。(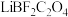 在水中可分解出草酸根,
在水中可分解出草酸根,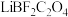 相对分子质量为144)
相对分子质量为144)
步骤2:量取 所配制的溶液于锥形瓶中,用
所配制的溶液于锥形瓶中,用 酸性
酸性 溶液滴定三次,平均消耗体积为
溶液滴定三次,平均消耗体积为 。产品(
。产品(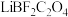 )的质量分数为
)的质量分数为___________ (列式即可,不用化简)。
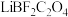 ,其过程可表示为:
,其过程可表示为:
(1)草酸的结构简式为
 ,
,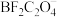 具有五元环结构,
具有五元环结构, 原子的轨道杂化类型是
原子的轨道杂化类型是 ,其结构式可表示为
,其结构式可表示为(2)实验室可以在
 用浓硝酸在硝酸汞催化下氧化乙炔(
用浓硝酸在硝酸汞催化下氧化乙炔( )气体来制备草酸,主要装置如图所示。
)气体来制备草酸,主要装置如图所示。
①仪器
 的名称为
的名称为②用电石制得的
 含有
含有 杂质,通过计算平衡常数说明用
杂质,通过计算平衡常数说明用 溶液除去
溶液除去 气体的可行性
气体的可行性 ,
, 的
的 ,
,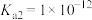 )
)③装置中浓硝酸的还原产物为
 ,生成草酸的化学方程式为
,生成草酸的化学方程式为 或温度高于
或温度高于 ,草酸的产率开始下降,其原因分别是
,草酸的产率开始下降,其原因分别是(3)
 遇水剧烈水解。
遇水剧烈水解。 和
和 混合加热制取无水
混合加热制取无水 时,
时, 的作用是
的作用是(4)“溶解”和“转化”操作在如图所示装置中进行。“溶解”时的操作依次为:称取一定质量
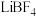 置于三颈瓶中→
置于三颈瓶中→
a.注入乙酸乙酯→充入→抽真空
b.抽真空→注入乙酸乙酯→充入

c.抽真空→充入
 →注入乙酸乙酯
→注入乙酸乙酯(5)产品(
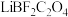 )纯度的测定
)纯度的测定步骤1:称取
 样品(假设只含
样品(假设只含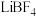 杂质)配制成
杂质)配制成 溶液。(
溶液。(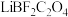 在水中可分解出草酸根,
在水中可分解出草酸根,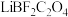 相对分子质量为144)
相对分子质量为144)步骤2:量取
 所配制的溶液于锥形瓶中,用
所配制的溶液于锥形瓶中,用 酸性
酸性 溶液滴定三次,平均消耗体积为
溶液滴定三次,平均消耗体积为 。产品(
。产品(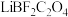 )的质量分数为
)的质量分数为
您最近一年使用:0次
名校
2 . 四氮化四硫( ,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。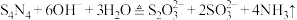 ,回答下列问题:
,回答下列问题:
(1)仪器a的名称为________ ;装置D的作用是________ 。
(2)四氮化四硫( )为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题:
)为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题: 的双楔形笼状结构可通过
的双楔形笼状结构可通过________ 实验测得。
② 分子中正、负电荷的重心完全重合,则为分子
分子中正、负电荷的重心完全重合,则为分子________ (填“极性”或“非极性”)。
③已知:多原子分子中相互平行的多条p轨道,连贯重叠构成一个整体,p电子在多个原子间运动形成大π键,如苯分子存在 型大π键。有研究者提出
型大π键。有研究者提出 的另一种平面八元环结构,如上图(b),S原子的杂化方式为
的另一种平面八元环结构,如上图(b),S原子的杂化方式为________ ;请写出平面 中的大π键类型
中的大π键类型________ 。
(3)装置C中生成 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为________ ;证明 反应完全的现象是
反应完全的现象是________ 。
(4)分离产物后测定产品纯度:
i.取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出 ;
;
ii.将蒸出的 通入含甲基橙的
通入含甲基橙的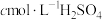 标准溶液中,消耗
标准溶液中,消耗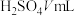 。
。
根据上述实验,计算样品中 的纯度
的纯度________ (列出表达式)。
 ,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
,S为+2价)是重要的硫一氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。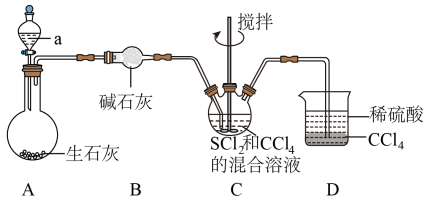
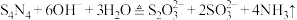 ,回答下列问题:
,回答下列问题:(1)仪器a的名称为
(2)四氮化四硫(
 )为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题:
)为双楔形笼状结构,如下图(a)所示。S和N原子交替构成一个假想的八元环,各S-N键长几乎相等。请回答以下问题: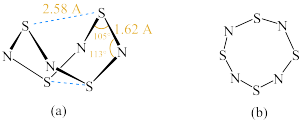
 的双楔形笼状结构可通过
的双楔形笼状结构可通过②
 分子中正、负电荷的重心完全重合,则为分子
分子中正、负电荷的重心完全重合,则为分子③已知:多原子分子中相互平行的多条p轨道,连贯重叠构成一个整体,p电子在多个原子间运动形成大π键,如苯分子存在
 型大π键。有研究者提出
型大π键。有研究者提出 的另一种平面八元环结构,如上图(b),S原子的杂化方式为
的另一种平面八元环结构,如上图(b),S原子的杂化方式为 中的大π键类型
中的大π键类型(3)装置C中生成
 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为 反应完全的现象是
反应完全的现象是(4)分离产物后测定产品纯度:
i.取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出
 ;
;ii.将蒸出的
 通入含甲基橙的
通入含甲基橙的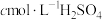 标准溶液中,消耗
标准溶液中,消耗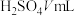 。
。根据上述实验,计算样品中
 的纯度
的纯度
您最近一年使用:0次
2024-04-11更新
|
126次组卷
|
2卷引用:福建省宁德市福安市第一中学2023-2024学年高二下学期3月月考化学试题
3 .  溶液常用作氧化还原反应滴定的标准液,由于
溶液常用作氧化还原反应滴定的标准液,由于 的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质
的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质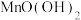 。
。
Ⅰ.配制 标准溶液的操作是:
标准溶液的操作是:
a.称取稍多于所需量的 固体溶于水,将溶液加热并保持微沸1h;
固体溶于水,将溶液加热并保持微沸1h;
b.用微孔玻璃漏斗过滤除去难溶的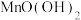 ;
;
c.过滤得到的 溶液贮存于棕色试剂瓶放在暗处;
溶液贮存于棕色试剂瓶放在暗处;
d.利用氧化还原滴定方法,在70°C-80°C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是___________ 。
(2)准确量取一定体积的 溶液用
溶液用___________ 。(填“酸式滴定管”或“碱式滴定管”)
(3)在下列物质中,用于标定 溶液的基准试剂最好选用___________。(填序号)
溶液的基准试剂最好选用___________。(填序号)
Ⅱ.氧化还原滴定原理与中和滴定原理相似:为测定某亚硝酸钠( )样品的纯度,进行如下实验:
)样品的纯度,进行如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,再向瓶中滴加少量 酸化,用
酸化,用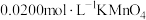 标准溶液进行滴定(还原产物为
标准溶液进行滴定(还原产物为 ,滴定至终点时消耗
,滴定至终点时消耗 溶液VmL。
溶液VmL。
(4)上述实验①所需玻璃仪器除玻璃棒、胶头滴管、烧杯之外还有___________ (填一种)。
(5)判断该实验达到滴定终点的现象是:___________ 。
(6)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为___________ mL。

(7)下列叙述正确的是___________ 。
A.滴定过程中发现溶液颜色变化立即读数,测定结果偏大
B.若用放置两周的 标准溶液滴定,测得的浓度值将偏小
标准溶液滴定,测得的浓度值将偏小
C.滴定前装有标准液的滴定管尖嘴处有气泡,滴定后气泡消失,测定结果偏大
D.装有标准液的滴定管滴定前读数正确,滴定后仰视滴定管读数,测定结果偏小
E.锥形瓶用蒸馏水洗涤后直接加入 溶液,用
溶液,用 溶液滴定,对实验无影响
溶液滴定,对实验无影响
(8)滴定过程中反应的离子方程式为:___________ ,该样品中 的质量分数为
的质量分数为___________ (用含字母a、V的最简式表示)。
 溶液常用作氧化还原反应滴定的标准液,由于
溶液常用作氧化还原反应滴定的标准液,由于 的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质
的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质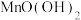 。
。Ⅰ.配制
 标准溶液的操作是:
标准溶液的操作是:a.称取稍多于所需量的
 固体溶于水,将溶液加热并保持微沸1h;
固体溶于水,将溶液加热并保持微沸1h;b.用微孔玻璃漏斗过滤除去难溶的
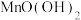 ;
;c.过滤得到的
 溶液贮存于棕色试剂瓶放在暗处;
溶液贮存于棕色试剂瓶放在暗处;d.利用氧化还原滴定方法,在70°C-80°C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是
(2)准确量取一定体积的
 溶液用
溶液用(3)在下列物质中,用于标定
 溶液的基准试剂最好选用___________。(填序号)
溶液的基准试剂最好选用___________。(填序号)A. | B. | C.浓盐酸 | D. |
Ⅱ.氧化还原滴定原理与中和滴定原理相似:为测定某亚硝酸钠(
 )样品的纯度,进行如下实验:
)样品的纯度,进行如下实验:①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,再向瓶中滴加少量
 酸化,用
酸化,用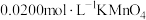 标准溶液进行滴定(还原产物为
标准溶液进行滴定(还原产物为 ,滴定至终点时消耗
,滴定至终点时消耗 溶液VmL。
溶液VmL。(4)上述实验①所需玻璃仪器除玻璃棒、胶头滴管、烧杯之外还有
(5)判断该实验达到滴定终点的现象是:
(6)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为

(7)下列叙述正确的是
A.滴定过程中发现溶液颜色变化立即读数,测定结果偏大
B.若用放置两周的
 标准溶液滴定,测得的浓度值将偏小
标准溶液滴定,测得的浓度值将偏小C.滴定前装有标准液的滴定管尖嘴处有气泡,滴定后气泡消失,测定结果偏大
D.装有标准液的滴定管滴定前读数正确,滴定后仰视滴定管读数,测定结果偏小
E.锥形瓶用蒸馏水洗涤后直接加入
 溶液,用
溶液,用 溶液滴定,对实验无影响
溶液滴定,对实验无影响(8)滴定过程中反应的离子方程式为:
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 为探究Na与CO2反应产物,某化学兴趣小组按如图装置进行实验。已知PdCl2能被CO还原得到银白色的Pd。

请回答下列问题:
(1)仪器X的名称是_____ 。
(2)B、C装置的目的是使进入D装置中的气体为干燥、纯净的CO2,则装置B和装置C所盛装的液体分别是饱和NaHCO3溶液、_____ 。
(3)先称量硬质玻璃管的质量为m1g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量为m2g。再进行下列实验操作,其正确顺序是_____ (标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
a.点燃酒精灯,加热b.熄灭酒精灯c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊e.关闭K1和K2 f.冷却到室温
(4)加热D装置中硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和日色物质产生。
③F中试管内壁有银白物质产生。
探究硬质玻璃管中,白色固体产物所含钠元素的存在形式;
假设一:只有Na2CO3;假设二:只有Na2O;假设三:_____ 。
完成下列实验设计,验证上述假设:
步骤2和步骤3的顺序不能调换,理由是_____ 。
(5)查阅资料发现,上述实验中产生的黑色固体成分为碳单质,Na与CO2反应的化学方程式为_____ 。

请回答下列问题:
(1)仪器X的名称是
(2)B、C装置的目的是使进入D装置中的气体为干燥、纯净的CO2,则装置B和装置C所盛装的液体分别是饱和NaHCO3溶液、
(3)先称量硬质玻璃管的质量为m1g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量为m2g。再进行下列实验操作,其正确顺序是
a.点燃酒精灯,加热b.熄灭酒精灯c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊e.关闭K1和K2 f.冷却到室温
(4)加热D装置中硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和日色物质产生。
③F中试管内壁有银白物质产生。
探究硬质玻璃管中,白色固体产物所含钠元素的存在形式;
假设一:只有Na2CO3;假设二:只有Na2O;假设三:
完成下列实验设计,验证上述假设:
| 操作 | 现象 | 结论 |
| 1.将硬质玻璃管中的固体产物溶于水后过滤,取滤液; 2.往步骤1所得滤液中加入足量的 3.往步骤2所得滤液中滴加几滴酚酞试液。 | 有白色沉淀产生,酚酞 | 假设-成立 |
(5)查阅资料发现,上述实验中产生的黑色固体成分为碳单质,Na与CO2反应的化学方程式为
您最近一年使用:0次
5 . 为探究不同价态铜的氧化物对电化学还原CO2产生的影响,某兴趣小组进行以下活动。
Ⅰ.制备过氧化铜(CuO2)
在含有0.5 gPVP(做稳定剂)的5 mL 0.01 mmol·L−1的CuCl2水溶液中,加入5 mL 0.03 mmol·L−1的NaOH溶液反应得到Cu(OH)2。随后在强磁力搅拌和0℃条件下,逐滴加入1 mL 30% H2O2反应0.5h,经一系列操作得到黄褐色的CuO2沉淀。
(1)由Cu(OH)2生成CuO2的化学方程式为___________ 。
(2)反应控制在0℃,原因是___________ 。
(3)为了探究CuO2的性质,分别向一定量的KMnO4溶液中缓慢加入(滴入)CuO2样品或H2O2溶液,实验结果如下 (已知:实验4与实验7均恰好反应完全):
CuO2样品和H2O2与酸性KMnO4溶液反应的用量及现象
①1mg CuO2样品与___________ μL的H2O2溶液还原能力相当
②若CuO2纯度为96%,过氧化氢物质的量浓度约为___________ mol·L−1.(1μL = 10−6L)
③“实验4”中,最终溶液的颜色是___________ 。
Ⅱ.制备CuO
将CuO2置于管式炉中(如下图所示),在O2气氛下300℃处理2 h,得到黑色的CuO。

已知:a. 加热时试管内会产生少量黄绿色单质气体
b. 高温下有如下反应:4CuO(s) 2Cu2O(s) + O2(g)。
2Cu2O(s) + O2(g)。
(4)装置D中盛放的试剂为___________ 。
(5)管式炉中CuO2反应的化学方程式为___________ 。
(6)通入氧气的目的是___________ 。
Ⅲ.探究CuO2催化电化学还原CO2的结果
(7)以KHCO3溶液为电解液,在指定的电势区间,利用CuO2催化还原CO2,测得阴极产物组成及电流效率( )如下表所示:(
)如下表所示:( =
= )
)
①该条件下,CO2还原产物有___________ 种
②CH4与C2H4物质的量之比为___________ 。
Ⅰ.制备过氧化铜(CuO2)
在含有0.5 gPVP(做稳定剂)的5 mL 0.01 mmol·L−1的CuCl2水溶液中,加入5 mL 0.03 mmol·L−1的NaOH溶液反应得到Cu(OH)2。随后在强磁力搅拌和0℃条件下,逐滴加入1 mL 30% H2O2反应0.5h,经一系列操作得到黄褐色的CuO2沉淀。
(1)由Cu(OH)2生成CuO2的化学方程式为
(2)反应控制在0℃,原因是
(3)为了探究CuO2的性质,分别向一定量的KMnO4溶液中缓慢加入(滴入)CuO2样品或H2O2溶液,实验结果如下 (已知:实验4与实验7均恰好反应完全):
CuO2样品和H2O2与酸性KMnO4溶液反应的用量及现象
| 编号 | m(CuO2)/mg | V(H2O2)/ μL | V(H2SO4)/mL | V(KMnO4)/ μL | 实验结束时溶液的颜色 |
| 1 | - | - | 2 | 10 | 紫色 |
| 2 | 1 | - | 2 | 10 | 浅紫色 |
| 3 | 2 | - | 2 | 10 | 浅紫色 |
| 4 | 4 | - | 2 | 10 | - |
| 5 | - | 10 | 2 | 10 | 浅紫色 |
| 6 | - | 20 | 2 | 10 | 浅紫色 |
| 7 | - | 40 | 2 | 10 | 无色 |
②若CuO2纯度为96%,过氧化氢物质的量浓度约为
③“实验4”中,最终溶液的颜色是
Ⅱ.制备CuO
将CuO2置于管式炉中(如下图所示),在O2气氛下300℃处理2 h,得到黑色的CuO。

已知:a. 加热时试管内会产生少量黄绿色单质气体
b. 高温下有如下反应:4CuO(s)
 2Cu2O(s) + O2(g)。
2Cu2O(s) + O2(g)。 (4)装置D中盛放的试剂为
(5)管式炉中CuO2反应的化学方程式为
(6)通入氧气的目的是
Ⅲ.探究CuO2催化电化学还原CO2的结果
(7)以KHCO3溶液为电解液,在指定的电势区间,利用CuO2催化还原CO2,测得阴极产物组成及电流效率(
 )如下表所示:(
)如下表所示:( =
= )
)| 阴极产物 | CO | CH4 | C2H4 | H2 |
| 电流效率/% | 5 | 18 | 30 | 15 |
②CH4与C2H4物质的量之比为
您最近一年使用:0次
2023-05-09更新
|
335次组卷
|
2卷引用:福建省龙岩市2023届高中毕业班五月教学质量检测化学试题
名校
解题方法
6 . 亚硝酰氯(NOCl)常温下是气体,呈黄色,有恶臭,液态时呈红褐色(熔点:-64.5℃,沸点:-6℃),易水解,可用于合成清洁剂、触媒剂及中间体等。
I.实验室可用如图装置由氯气(沸点:-34℃)与一氧化氮(沸点:-152℃)在常温常压下合成。
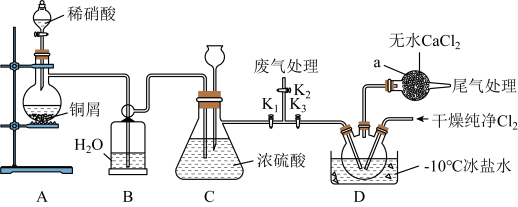
简要步骤如下:实验开始时,关闭 ,打开
,打开 、
、 ,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭
,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭 ,打开
,打开 ,打开分液漏斗塞子,向烧瓶中滴入适量稀硝酸;待装置C中某一现象发生时,关闭
,打开分液漏斗塞子,向烧瓶中滴入适量稀硝酸;待装置C中某一现象发生时,关闭 ,打开
,打开 ,在三颈烧瓶中制备亚硝酰氯。请回答:
,在三颈烧瓶中制备亚硝酰氯。请回答:
(1)仪器a的名称是_____________ ,装置B的作用是_______________ 。
(2)步骤划线处,装置C出现的现象是_______________________________________ 。
(3)该实验用高锰酸钾和浓盐酸来制取氯气,写出该反应的离子方程式:__________ 。
(4)写出亚硝酰氯与NaOH溶液反应生成亚硝酸钠的化学方程式:___________ 。
(5)不列说法不正确的是
Ⅱ.NOCl的制备,也可以由下列装置(夹持仪器已省略)来实现。
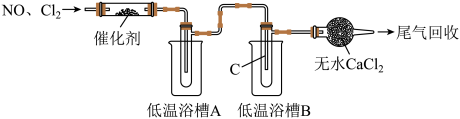
(6)①将催化剂负载在玻璃棉上的目的是_________ 。
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在_________ (填字母)。
A.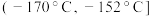 B.
B.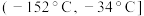 C.
C.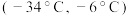
(7)NOCl样品中NOCl的质量分数测定。取m g NOCl样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用c 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。NOCl的质量分数为
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。NOCl的质量分数为_________ 。
I.实验室可用如图装置由氯气(沸点:-34℃)与一氧化氮(沸点:-152℃)在常温常压下合成。

简要步骤如下:实验开始时,关闭
 ,打开
,打开 、
、 ,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭
,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭 ,打开
,打开 ,打开分液漏斗塞子,向烧瓶中滴入适量稀硝酸;待装置C中某一现象发生时,关闭
,打开分液漏斗塞子,向烧瓶中滴入适量稀硝酸;待装置C中某一现象发生时,关闭 ,打开
,打开 ,在三颈烧瓶中制备亚硝酰氯。请回答:
,在三颈烧瓶中制备亚硝酰氯。请回答:(1)仪器a的名称是
(2)步骤划线处,装置C出现的现象是
(3)该实验用高锰酸钾和浓盐酸来制取氯气,写出该反应的离子方程式:
(4)写出亚硝酰氯与NaOH溶液反应生成亚硝酸钠的化学方程式:
(5)不列说法不正确的是
| A.从安全或避免环境污染方面考虑,宜在通风橱内进行实验 |
| B.为加快反应速率,装置A中可用酒精灯大火加热制取NO |
C.浓硫酸和无水 可以阻止水蒸气进入,避免亚硝酰氯水解 可以阻止水蒸气进入,避免亚硝酰氯水解 |
| D.冰盐水温度可达-10℃,装置D三颈烧瓶中充满黄色气体NOCl |
Ⅱ.NOCl的制备,也可以由下列装置(夹持仪器已省略)来实现。

(6)①将催化剂负载在玻璃棉上的目的是
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在
A.
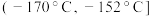 B.
B.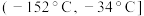 C.
C.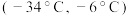
(7)NOCl样品中NOCl的质量分数测定。取m g NOCl样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用c
 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。NOCl的质量分数为
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。NOCl的质量分数为
您最近一年使用:0次
7 . Cu与浓 反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
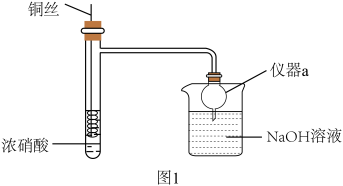
回答下列问题:
(1)Cu与浓 反应的离子方程式为
反应的离子方程式为_______ 。
(2)关于该实验下列说法错误的是_______ 。
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a: 浓度大
浓度大
猜想b: 溶解在
溶解在 溶液中
溶液中
猜想c:由于 与水反应能够生成
与水反应能够生成 ,
, 与
与 能够发生可逆反应
能够发生可逆反应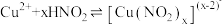 (绿色)
(绿色)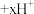
【实验探究】
实验i:配制饱和 溶液,溶液呈蓝色。
溶液,溶液呈蓝色。
实验ii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到
反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色。
实验iii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
【实验结论】
对比实验ii与实验iii,可推测 溶液为绿色的原因主要是
溶液为绿色的原因主要是_______ 。
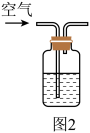
(4)小组同学还针对产物 的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对
的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为
固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为 。当反应结束以后,试管中残留固体为红色。
。当反应结束以后,试管中残留固体为红色。
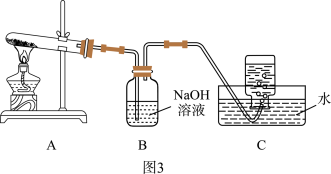
①从实验安全角度考虑,需要在A、B间加入_______ 装置。
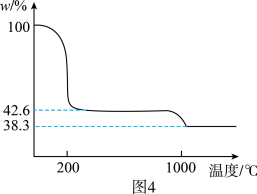
②图4为 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。 加热到200℃的化学方程式为
加热到200℃的化学方程式为_______ ,继续高温至1000℃生成_______ (填化学式)固体。
 反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
回答下列问题:
(1)Cu与浓
 反应的离子方程式为
反应的离子方程式为(2)关于该实验下列说法错误的是
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓
 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。【提出猜想】
猜想a:
 浓度大
浓度大猜想b:
 溶解在
溶解在 溶液中
溶液中猜想c:由于
 与水反应能够生成
与水反应能够生成 ,
, 与
与 能够发生可逆反应
能够发生可逆反应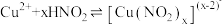 (绿色)
(绿色)
【实验探究】
实验i:配制饱和
 溶液,溶液呈蓝色。
溶液,溶液呈蓝色。实验ii:取适量Cu与浓
 反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到
反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到实验iii:取适量Cu与浓
 反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
【实验结论】
对比实验ii与实验iii,可推测
 溶液为绿色的原因主要是
溶液为绿色的原因主要是(4)小组同学还针对产物
 的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对
的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为
固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为 。当反应结束以后,试管中残留固体为红色。
。当反应结束以后,试管中残留固体为红色。
①从实验安全角度考虑,需要在A、B间加入
②图4为
 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。 加热到200℃的化学方程式为
加热到200℃的化学方程式为
您最近一年使用:0次
2023-06-06更新
|
606次组卷
|
4卷引用:福建省泉州第一中学2023届高三毕业班适应性测试化学试题
福建省泉州第一中学2023届高三毕业班适应性测试化学试题福建省漳州市华安县第一中学2023-2024学年高三上学期开学考试化学试题(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
8 . 以硫化铜(CuS)精矿为原料生产CuCl的工艺过程如下:
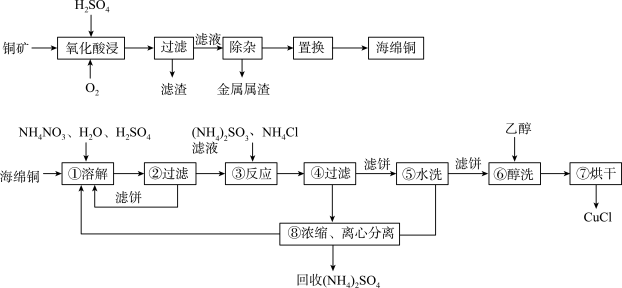
已知:CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜Cu中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式___________ 。
(2)步骤①中得到的氧化产物是___________ ,溶解温度应控制在60~70℃,原因是___________ 。
(3)写出步骤③中主要反应的离子方程式___________ 。
(4)步骤③先加 、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因
、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因___________ 。
(5)步骤⑤包括用 的酸洗、水洗两步操作,酸洗采用的酸是
的酸洗、水洗两步操作,酸洗采用的酸是___________ (写名称)。
(6)上述工艺中,步骤⑥不能省略,理由是___________ 。
(7)准确称取所制备的氯化亚铜样品mg,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,和
溶液中,待样品完全溶解后,加入适量稀硫酸,和 的
的 溶液恰好完全反应,消耗
溶液恰好完全反应,消耗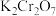 溶液bmL,反应中
溶液bmL,反应中 被还原为
被还原为 ,样品中CuCl的质量分数为
,样品中CuCl的质量分数为___________ 。

已知:CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化,海绵铜Cu中含少量CuO等。
(1)经测定氧化酸浸过程有单质S生成,写出此过程中的化学方程式
(2)步骤①中得到的氧化产物是
(3)写出步骤③中主要反应的离子方程式
(4)步骤③先加
 、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因
、再加入亚硫酸铵时无沉淀,加水稀释就产生大量白色沉淀,其原因(5)步骤⑤包括用
 的酸洗、水洗两步操作,酸洗采用的酸是
的酸洗、水洗两步操作,酸洗采用的酸是(6)上述工艺中,步骤⑥不能省略,理由是
(7)准确称取所制备的氯化亚铜样品mg,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,和
溶液中,待样品完全溶解后,加入适量稀硫酸,和 的
的 溶液恰好完全反应,消耗
溶液恰好完全反应,消耗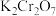 溶液bmL,反应中
溶液bmL,反应中 被还原为
被还原为 ,样品中CuCl的质量分数为
,样品中CuCl的质量分数为
您最近一年使用:0次
名校
9 . 下列实验方案、现象和结论都正确的是:
| 实验目的 | 实验方案 | 现象和结论 | |
| A | 探究乙醇消去反应的 产物 | C2H5OH与浓硫酸(体积比约为 1 : 3)的混合液,放入几块碎瓷片, 170°C共热,将产生的气体通入酸性 KMnO4溶液中 | 若酸性KMnO4溶液褪色,则乙醇消去反应的产物为乙烯 |
| B | 探究乙酰水杨酸(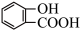 )样品中是否含有水杨酸 )样品中是否含有水杨酸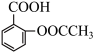 | 取少量样品,加入3mL蒸馏水和少量乙醇,振荡,再加入1-2滴FeCl3 溶液 | 若有紫色沉淀生成,则该样品中含有水杨酸 |
| C | 探究麦芽糖是否发生水解 | 取2mL20%的麦芽糖溶液于试管中,加入适量稀h2so4后水浴加热5min,冷却后加入适量新制Cu(OH)2悬浊液并加热煮沸 | 若没有砖红色沉淀生成,则麦芽糖没有水解 |
| D | 探究KI与FeCl3反应的限度 | 取5 mL 0.1 mol KI溶液于试管中,加入1 mL 0. 1 mol • L-1 FeCl3溶液,充分反应后滴入5滴15% KSCN溶液 | 若溶液变血红色,则 KI与FeCl3的反应有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3,并测定所得产品中氯的含量
(一)制备MgCl2•6NH3
I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
(1)滴液漏斗中支管的作用为___________ 。
(2)三颈瓶中发生反应的化学方程式为___________ 。
(3)该实验装置中的不足之处为___________ 。
II.将NH3通入无水MgCl2的乙二醇溶液中,充分反应(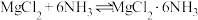 )后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
)后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
(4)生成MgCl2•6NH3的反应需在冰水浴中进行,其可能原因有___________(填字母)。
(5)洗涤产品时,应选择的洗涤剂为___________(填字母)。
(二)测定产品中氯的含量,步骤如下:
步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20 的AgNO3标准液滴定溶液中
的AgNO3标准液滴定溶液中 ,记录消耗标准液的体积;
,记录消耗标准液的体积;
步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(6)步骒1中,用稀硝酸溶解样品的目的为___________ 。
(7)该品中氯的质量分数为___________ (保留小数点后2位);该实验值与理论值(36.04%)有偏差,造成该偏差的可能原因是(已知滴定操作均正确)___________ 。
(一)制备MgCl2•6NH3
I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点
 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。(1)滴液漏斗中支管的作用为
(2)三颈瓶中发生反应的化学方程式为
(3)该实验装置中的不足之处为
II.将NH3通入无水MgCl2的乙二醇溶液中,充分反应(
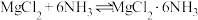 )后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
)后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
| NH3 | MgCl2 | MgCl2•NH3 |
| 水 | 易溶 | 易溶 | 易溶 |
| 甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
| 乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
| A.反应吸热,促进反应正向进行 | B.加快反应速率 |
| C.防止氨气挥发,提高氨气利用率 | D.降低产物的溶解度 |
| A.冰浓氨水 | B.乙二醇和水的混合液 |
| C.氨气饱和的甲醇溶液 | D.氨气饱和的乙二醇溶液 |
(二)测定产品中氯的含量,步骤如下:
步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20
 的AgNO3标准液滴定溶液中
的AgNO3标准液滴定溶液中 ,记录消耗标准液的体积;
,记录消耗标准液的体积;步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(6)步骒1中,用稀硝酸溶解样品的目的为
(7)该品中氯的质量分数为
您最近一年使用:0次
2022-05-10更新
|
465次组卷
|
7卷引用:化学(福建B卷)-学易金卷:2023年高考第一次模拟考试
(已下线)化学(福建B卷)-学易金卷:2023年高考第一次模拟考试河南省商丘市2022届高三下学期第三次模拟考试化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)天津市耀华中学2022-2023学年高三上学期第三次月考化学试题湖南省株洲市北附高级中学2022-2023学年高三上学期第五次月考化学试题




