名校
解题方法
1 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,现利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
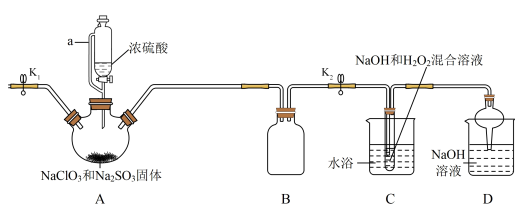
(1)A装置中仪器a的名称为______ 。装置D中NaOH溶液的作用是______ 。
(2)装置A中生成ClO2的化学方程式为______ 。
(3)关于装置C及后续操作的下列说法中,错误的是______ 。
(4)仪器A中NaClO3需稍微过量,原因是______ 。
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是______ 。
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是______ ;Cl2O键角比F2O键角______ (填“大”“小”或“相等”)。
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为______ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)关于装置C及后续操作的下列说法中,错误的是
| A.装置C中H2O2作氧化剂 |
| B.为获得NaClO2晶体,可将C试管中的溶液在55℃蒸发浓缩结晶并趁热过滤 |
| C.用50℃左右温水洗涤所得晶体 |
| D.高温烘干过滤后所得滤渣即可得到产物 |
(4)仪器A中NaClO3需稍微过量,原因是
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
2023-10-27更新
|
1111次组卷
|
5卷引用:江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题
江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题广西部分高中2024届高三第一次摸底测试化学试题广西南宁市2024届高三上学期毕业班摸底测试化学试题河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
2 . 亚硝酰氯( ,沸点:
,沸点: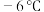 ;易水解,能与
;易水解,能与 反应)可作为有机合成试剂。在实验室可用
反应)可作为有机合成试剂。在实验室可用 (沸点:
(沸点: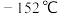 )和
)和 (沸点:
(沸点: )在一定条件下反应制备,其反应原理为
)在一定条件下反应制备,其反应原理为 。回答下列问题:
。回答下列问题:
(1)实验室常用铜与稀硝酸反应制备 ,若将
,若将 加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则
加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则 物质的量浓度为
物质的量浓度为_______ 。
(2)实验室若以 和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的
和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的 ,则其连接顺序为
,则其连接顺序为_______ →jh(按气流方向,用小写字母表示)。

(3) 的制备,装置(夹持仪器已省略)如下图所示。
的制备,装置(夹持仪器已省略)如下图所示。
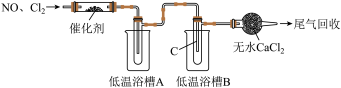
①将催化剂负载在玻璃棉上的目的是_______ 。
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在_______ (填字母)。
A.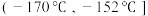 B.
B.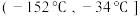 C.
C.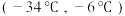
③仪器C中收集的物质是_______ (填化学式)。
(4) 样品中
样品中 的质量分数测定。取
的质量分数测定。取
 样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用
样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。 的质量分数为
的质量分数为_______ 。
 ,沸点:
,沸点: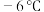 ;易水解,能与
;易水解,能与 反应)可作为有机合成试剂。在实验室可用
反应)可作为有机合成试剂。在实验室可用 (沸点:
(沸点: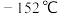 )和
)和 (沸点:
(沸点: )在一定条件下反应制备,其反应原理为
)在一定条件下反应制备,其反应原理为 。回答下列问题:
。回答下列问题:(1)实验室常用铜与稀硝酸反应制备
 ,若将
,若将 加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则
加入100mL稀硫酸(足量)和稀硝酸的混合溶液中制备NO,最多溶解19.2g铜,则 物质的量浓度为
物质的量浓度为(2)实验室若以
 和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的
和浓盐酸为原料,利用以下装置(部分夹持仪器已省略)制备一瓶干燥纯净的 ,则其连接顺序为
,则其连接顺序为
(3)
 的制备,装置(夹持仪器已省略)如下图所示。
的制备,装置(夹持仪器已省略)如下图所示。
①将催化剂负载在玻璃棉上的目的是
②为分离产物和未反应的原料,低温浴槽A的温度区间应控制在
A.
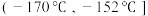 B.
B.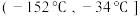 C.
C.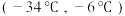
③仪器C中收集的物质是
(4)
 样品中
样品中 的质量分数测定。取
的质量分数测定。取
 样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用
样品(杂质中不含有氯元素)溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用 的
的 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。 的质量分数为
的质量分数为
您最近一年使用:0次
名校
3 . 从废旧锂电池中回收锂具有重要意义,下图为碳热还原—水浸—高温固相焙烧法工艺路线图,该方法可以选择性回收锂和其他有价金属并再生正极材料,为废旧锂电池回收提供一条可开发、环境友好的简单途径。
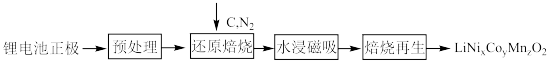
(1)预处理时需用NaOH溶液将包裹正极的铝箔溶解,然后过滤烘干得到正极粉末。写出溶解时主要的离子方程式___________ 。
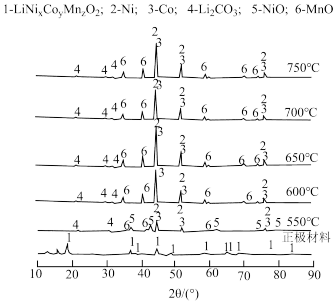
(2)以N2为保护气,通过X射线衍射分析不同焙烧温度下产物的组成如图所示。写出550℃-600℃发生的主要反应的方程式___________ 。
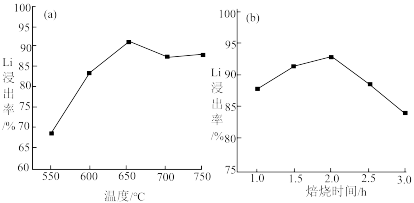
(3)水浸时,利用磁吸附法分离Ni、Co、MnO后,测得不同焙烧条件下Li的浸出率如图所示,则还原焙烧时的最佳条件为___________ 。
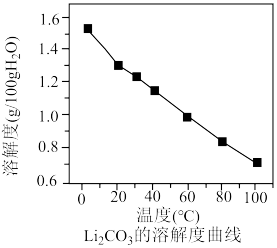
(4)水浸磁吸分离Ni、Co、Mn后的溶液为Li2CO3,其溶解度曲线如图所示,则从Li2CO3溶液中获得Li2CO3固体的操作方法为___________ 。
(5)一种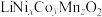 中Mn含量的测定方法:取mg样品加入足量的稀硫酸和H2O2的混合溶液,反应完毕后,继续加热一段时间,冷却、加入足量
中Mn含量的测定方法:取mg样品加入足量的稀硫酸和H2O2的混合溶液,反应完毕后,继续加热一段时间,冷却、加入足量 使
使 完全转化为MnO2沉淀。过滤、洗涤,将沉淀用
完全转化为MnO2沉淀。过滤、洗涤,将沉淀用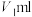
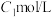 H2C2O4完全溶解,然后转移至250ml容量瓶定容得到试液A,移取试液A25.00mL于锥形瓶,加入足量稀硫酸,用
H2C2O4完全溶解,然后转移至250ml容量瓶定容得到试液A,移取试液A25.00mL于锥形瓶,加入足量稀硫酸,用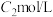 KMnO4溶液滴定至终点,平均消耗体积
KMnO4溶液滴定至终点,平均消耗体积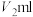 。回答下列问题
。回答下列问题
①写出MnO2溶于H2C2O4的离子方程式___________ 。
②滴定终点的现象为___________ 。
③样品中Mn的质量分数为___________ 。(不用化简,列出计算式即可)
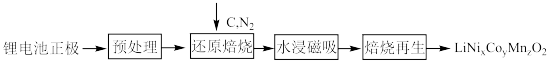
(1)预处理时需用NaOH溶液将包裹正极的铝箔溶解,然后过滤烘干得到正极粉末。写出溶解时主要的离子方程式
(2)以N2为保护气,通过X射线衍射分析不同焙烧温度下产物的组成如图所示。写出550℃-600℃发生的主要反应的方程式

(3)水浸时,利用磁吸附法分离Ni、Co、MnO后,测得不同焙烧条件下Li的浸出率如图所示,则还原焙烧时的最佳条件为

(4)水浸磁吸分离Ni、Co、Mn后的溶液为Li2CO3,其溶解度曲线如图所示,则从Li2CO3溶液中获得Li2CO3固体的操作方法为

(5)一种
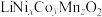 中Mn含量的测定方法:取mg样品加入足量的稀硫酸和H2O2的混合溶液,反应完毕后,继续加热一段时间,冷却、加入足量
中Mn含量的测定方法:取mg样品加入足量的稀硫酸和H2O2的混合溶液,反应完毕后,继续加热一段时间,冷却、加入足量 使
使 完全转化为MnO2沉淀。过滤、洗涤,将沉淀用
完全转化为MnO2沉淀。过滤、洗涤,将沉淀用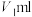
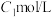 H2C2O4完全溶解,然后转移至250ml容量瓶定容得到试液A,移取试液A25.00mL于锥形瓶,加入足量稀硫酸,用
H2C2O4完全溶解,然后转移至250ml容量瓶定容得到试液A,移取试液A25.00mL于锥形瓶,加入足量稀硫酸,用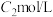 KMnO4溶液滴定至终点,平均消耗体积
KMnO4溶液滴定至终点,平均消耗体积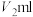 。回答下列问题
。回答下列问题①写出MnO2溶于H2C2O4的离子方程式
②滴定终点的现象为
③样品中Mn的质量分数为
您最近一年使用:0次
名校
4 . 无水四氯化锡常用于合成染色的媒染剂。实验室可用熔融的锡与氯气反应制备无水 ,可选用的装置如正图所示:
,可选用的装置如正图所示:

有关信息如表:
(1)A装置中盛放浓盐酸的仪器名称为_________ 。
(2)整个实验装置的连接顺序是:A、_________ 、D(装置可重复选用)。
(3)加热B装置,锡熔化,与 反应,产物有
反应,产物有 和
和 ,为了确认B中生成的
,为了确认B中生成的 ,可选以下试剂_________(填序号)检验。
,可选以下试剂_________(填序号)检验。
(4)B中反应需要通入过量的 ,并控制温度在232~652℃范围,控制温度目的是
,并控制温度在232~652℃范围,控制温度目的是_________ 。
(5)收集器C中收集到的液体略显黄色,可能的原因是_________ ;若缺少装置F,则收集器C中发生反应的化学方程式为_________ 。
(6)除氯后测定最终产品的纯度。量取 、密度为
、密度为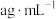 的样品,置于含20mL水的称量瓶中,混合后移入锥形瓶,加入200mL水和2滴1%甲基橙指示剂,用
的样品,置于含20mL水的称量瓶中,混合后移入锥形瓶,加入200mL水和2滴1%甲基橙指示剂,用 的NaOH标准液滴定至终点时,消耗标准液
的NaOH标准液滴定至终点时,消耗标准液 (接近终点时,每滴加一滴标准液须待沉淀沉降后观察澄清液体的颜色)。滴定至终点的实验现象为
(接近终点时,每滴加一滴标准液须待沉淀沉降后观察澄清液体的颜色)。滴定至终点的实验现象为_________ ,产品的纯度为_________ %。
 ,可选用的装置如正图所示:
,可选用的装置如正图所示:
有关信息如表:
| 化学式 | Sn |  |  |
| 熔点/℃ | 232 | 246 |  |
| 沸点/℃ | 2260 | 652 | 114 |
| 其他性质 | 银白色固体金属 | 无色晶体,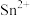 易被 易被 、 、 等氧化为 等氧化为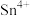 | 无色液体,易水解生成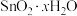 |
(1)A装置中盛放浓盐酸的仪器名称为
(2)整个实验装置的连接顺序是:A、
(3)加热B装置,锡熔化,与
 反应,产物有
反应,产物有 和
和 ,为了确认B中生成的
,为了确认B中生成的 ,可选以下试剂_________(填序号)检验。
,可选以下试剂_________(填序号)检验。| A.酸性高锰酸钾 | B.加入有KSCN的 溶液 溶液 |
C. 溶液 溶液 | D.稀盐酸 |
 ,并控制温度在232~652℃范围,控制温度目的是
,并控制温度在232~652℃范围,控制温度目的是(5)收集器C中收集到的液体略显黄色,可能的原因是
(6)除氯后测定最终产品的纯度。量取
 、密度为
、密度为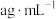 的样品,置于含20mL水的称量瓶中,混合后移入锥形瓶,加入200mL水和2滴1%甲基橙指示剂,用
的样品,置于含20mL水的称量瓶中,混合后移入锥形瓶,加入200mL水和2滴1%甲基橙指示剂,用 的NaOH标准液滴定至终点时,消耗标准液
的NaOH标准液滴定至终点时,消耗标准液 (接近终点时,每滴加一滴标准液须待沉淀沉降后观察澄清液体的颜色)。滴定至终点的实验现象为
(接近终点时,每滴加一滴标准液须待沉淀沉降后观察澄清液体的颜色)。滴定至终点的实验现象为
您最近一年使用:0次
5 . 阿司匹林被誉为“百年新药”,是世界上应用最广泛的解热、镇痛药。
已知:①阿司匹林药片的有效成分是乙酰水杨酸,它是一种白色晶体,微溶于水,结构简式为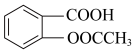 。
。
②阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应)
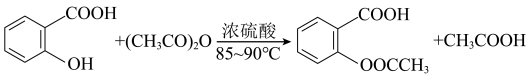
③工业上以水杨酸与醋酸酐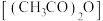 为主要原料合成阿司匹林,原理为:
为主要原料合成阿司匹林,原理为:
某课外学习小组模拟工业合成阿司匹林,装置如图所示(夹持仪器及加热装置略去):
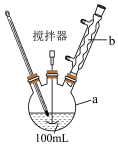
(1)装置中仪器a的名称是___________ ,仪器b的作用是___________ 。
(2)合成阿司匹林时,最合适的加热方法是___________ 。
(3)本实验中副产物的结构简式为___________ (写一种即可)。
该学习小组还设计了如下实验方案测定乙酰水杨酸在药片中的含量:
①称取阿司匹林样品mg;
②将样品研碎,溶于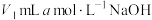 溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加几滴指示剂,用浓度为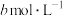 的标准盐酸反滴未反应的NaOH,消耗盐酸的体积为
的标准盐酸反滴未反应的NaOH,消耗盐酸的体积为 。
。
(4)阿司匹林中加入过量的NaOH溶液并加热发生反应的化学方程式为___________ 。其中,加热的目的是___________ 。
(5)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是___________ 。
(6)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的计算式为___________ 。
已知:①阿司匹林药片的有效成分是乙酰水杨酸,它是一种白色晶体,微溶于水,结构简式为
 。
。②阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应)
③工业上以水杨酸与醋酸酐
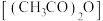 为主要原料合成阿司匹林,原理为:
为主要原料合成阿司匹林,原理为:
某课外学习小组模拟工业合成阿司匹林,装置如图所示(夹持仪器及加热装置略去):

(1)装置中仪器a的名称是
(2)合成阿司匹林时,最合适的加热方法是
(3)本实验中副产物的结构简式为
该学习小组还设计了如下实验方案测定乙酰水杨酸在药片中的含量:
①称取阿司匹林样品mg;
②将样品研碎,溶于
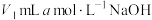 溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;③向锥形瓶中滴加几滴指示剂,用浓度为
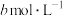 的标准盐酸反滴未反应的NaOH,消耗盐酸的体积为
的标准盐酸反滴未反应的NaOH,消耗盐酸的体积为 。
。(4)阿司匹林中加入过量的NaOH溶液并加热发生反应的化学方程式为
(5)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是
(6)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的计算式为
您最近一年使用:0次
名校
6 . 如图所示装置是用燃烧法确定有机物化学式常用的装置,这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:

(1)写出A装置中发生的反应的化学方程式:_______ 。
(2)写出E装置中所盛放试剂的名称:_______ 。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为_______ 。
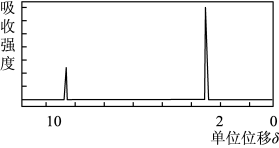
(4)若该有机物的核磁共振氢谱如图所示,则该化合物具有的性质是:_______。(填序号)
(5)某同学认E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是_______ 。

(1)写出A装置中发生的反应的化学方程式:
(2)写出E装置中所盛放试剂的名称:
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为
(4)若该有机物的核磁共振氢谱如图所示,则该化合物具有的性质是:_______。(填序号)

| A.能与水、乙醇、氯仿等互溶 |
| B.无色、无味液体 |
| C.能使酸性KMnO4溶液和溴水褪色 |
| D.任何条件下不能与H2反应 |
您最近一年使用:0次
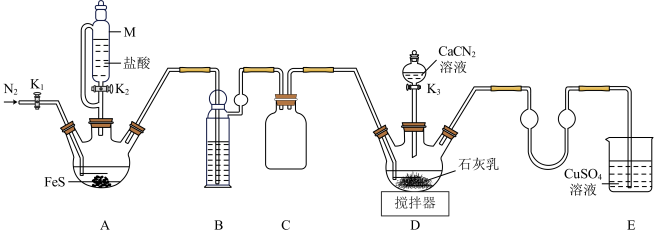
7 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备Ca(HS)2,再与CaCN2合成CS(NH2)2,实验装置(夹持及加热装置略)如图所示。
已知:CS(NH2)2易溶于水,易被氧化,受热(150℃左右)时发生异构化生成NH4SCN。
回答下列问题:
(1)仪器M名称_______ 。
(2)实验前先检查装置气密性。检查气密性后加入药品,打开K2,装置B中盛装的试剂为_______ 。反应结束后关闭K2,打开K₁通N2一段时间,目的是_______ 。
(3)撤走搅拌器,打开K₃,水浴加热D中三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是_______ ,D处合成硫脲的化学方程式为_______ 。判断制备Ca(HS)2反应中H2S已过量的方法是______
(4)将装置D中液体过滤后,结晶得到粗产品。
称取mg产品,加水溶解配成250mL溶液,量取50mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用c mol·L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液V mL。滴定时,硫脲发生反应的离子方程式为: 5[CS(NH2)2] +14 +32H+= 14Mn2++5CO2+5N2+5
+32H+= 14Mn2++5CO2+5N2+5 + 26H2O 。则样品中硫脲的质量分数为
+ 26H2O 。则样品中硫脲的质量分数为_______ (用含“m、c、V”的最简式表示)。
已知:NH4SCN、KSCN都易溶于乙醇、水,温度高时容易分解和氧化;常温下KSCN的溶解度为217g。利用硫脲制备KSCN的方法是:取一定量硫脲在隔绝空气的条件下加热至150℃充分反应,将加热后的产物溶于一定比例的无水乙醇和水中形成溶液,_______ (填写操作过程),得到KSCN晶体。(实验中可选用试剂:K2CO3、无水乙醇。)

已知:CS(NH2)2易溶于水,易被氧化,受热(150℃左右)时发生异构化生成NH4SCN。
回答下列问题:
(1)仪器M名称
(2)实验前先检查装置气密性。检查气密性后加入药品,打开K2,装置B中盛装的试剂为
(3)撤走搅拌器,打开K₃,水浴加热D中三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是
(4)将装置D中液体过滤后,结晶得到粗产品。
称取mg产品,加水溶解配成250mL溶液,量取50mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用c mol·L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液V mL。滴定时,硫脲发生反应的离子方程式为: 5[CS(NH2)2] +14
 +32H+= 14Mn2++5CO2+5N2+5
+32H+= 14Mn2++5CO2+5N2+5 + 26H2O 。则样品中硫脲的质量分数为
+ 26H2O 。则样品中硫脲的质量分数为已知:NH4SCN、KSCN都易溶于乙醇、水,温度高时容易分解和氧化;常温下KSCN的溶解度为217g。利用硫脲制备KSCN的方法是:取一定量硫脲在隔绝空气的条件下加热至150℃充分反应,将加热后的产物溶于一定比例的无水乙醇和水中形成溶液,
您最近一年使用:0次
名校
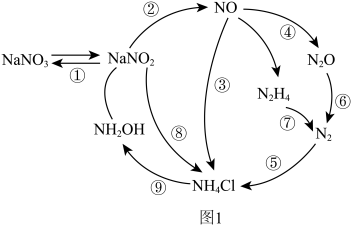
8 . 近年来,人们对微生物的氮转化进行了深入研究,将其归纳为如图1所示过程。请回答下列问题:
(1)N2的电子式为_____ ;羟胺(NH2OH)的结构式为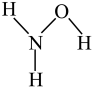 ,属于
,属于_____ (填“离子”或“共价”)化合物。
(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:_____ 。
(3)图1转化过程中具有固氮功能的是_____ (填标号)。
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。
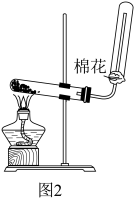
I.写出该反应的化学方程式:_____ 。
Ⅱ.棉花的作用为_____ 。
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。
I.请配平该离子方程式:_____ 。
Ⅱ.NaNO2的质量分数为_____ %。

(1)N2的电子式为
 ,属于
,属于(2)笑气(N2O)可用作医用麻醉剂、制冷剂,实验室通过加热NH4NO3分解制备N2O,只有两种产物,写出该反应的化学方程式:
(3)图1转化过程中具有固氮功能的是
(4)实验室常用氢氧化钙和氯化铵制备氨气,反应装置如图2所示。

I.写出该反应的化学方程式:
Ⅱ.棉花的作用为
(5)NaNO2和食盐性状相似,社会上曾多次发生将NaNO2误当食盐食用的事件。可用0.1mol•L-1酸性KMnO4溶液来测定某亚硝酸钠样品中NaNO2的含量(假设杂质不与KMnO4溶液反应),进行三次实验,每次取ag样品,消耗酸性KMnO4溶液的平均体积为20.00mL。测定原理为NO
 +MnO
+MnO +H+→NO
+H+→NO +Mn2++H2O。
+Mn2++H2O。I.请配平该离子方程式:
Ⅱ.NaNO2的质量分数为
您最近一年使用:0次
2023-04-18更新
|
406次组卷
|
3卷引用:江西省赣州市十六县二十校2022-2023学年高一下学期期中联考化学试题
解题方法
9 .  既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
Ⅰ.实验室中制备NaN3分2步进行:
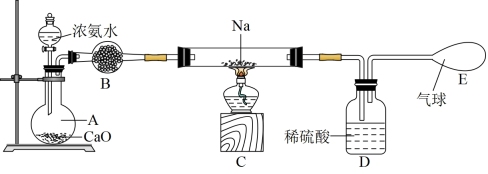
①制备氨基钠: ,装置如下图。已知氨基钠极易与水剧烈反应生成
,装置如下图。已知氨基钠极易与水剧烈反应生成 ,且易被空气氧化。
,且易被空气氧化。
②制备叠氮化钠:将得到的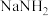 与
与 在210~220℃的条件下反应生成
在210~220℃的条件下反应生成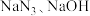 和
和 。
。
(1)盛放浓氨水的仪器名称为_______ ,B的作用是_______ 。
(2)连接好装置并检查装置的气密性后,装入试剂,然后应先_______ 。
a.向A中加入浓氨水 b.加热装置C
(3)若无B装置,C中生成的氨基钠会发生的化学方程式为_______ 。
(4)D装置中长导管不伸入液面的目的是_______ 。
(5) 可由
可由 (熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是
(熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是_______ (填标号)。
a. b.
b.  c.
c. 
Ⅱ.测定的纯度
精确称量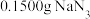 样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知:
样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知: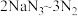 (其他产物略),反应中放出大量的热。
(其他产物略),反应中放出大量的热。
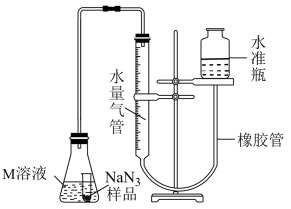
(6)常温下测得产生气体的体积为45.00mL ( 的密度为1.400g/L),计算
的密度为1.400g/L),计算 样品的纯度为(质量分数)
样品的纯度为(质量分数)_______ 。
 既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。Ⅰ.实验室中制备NaN3分2步进行:
①制备氨基钠:
 ,装置如下图。已知氨基钠极易与水剧烈反应生成
,装置如下图。已知氨基钠极易与水剧烈反应生成 ,且易被空气氧化。
,且易被空气氧化。
②制备叠氮化钠:将得到的
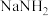 与
与 在210~220℃的条件下反应生成
在210~220℃的条件下反应生成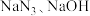 和
和 。
。(1)盛放浓氨水的仪器名称为
(2)连接好装置并检查装置的气密性后,装入试剂,然后应先
a.向A中加入浓氨水 b.加热装置C
(3)若无B装置,C中生成的氨基钠会发生的化学方程式为
(4)D装置中长导管不伸入液面的目的是
(5)
 可由
可由 (熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是
(熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是a.
 b.
b.  c.
c. 
Ⅱ.测定的纯度
精确称量
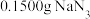 样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知:
样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知: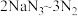 (其他产物略),反应中放出大量的热。
(其他产物略),反应中放出大量的热。
(6)常温下测得产生气体的体积为45.00mL (
 的密度为1.400g/L),计算
的密度为1.400g/L),计算 样品的纯度为(质量分数)
样品的纯度为(质量分数)
您最近一年使用:0次
名校
解题方法
10 . 已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
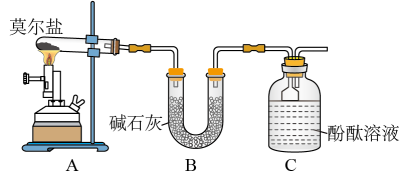
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
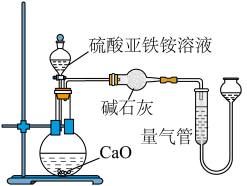
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 |  |  |  |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
2023-01-21更新
|
769次组卷
|
3卷引用:江西省吉安市永丰县永丰中学2022-2023学年高一上学期期末考试化学(B班)试题



