1 . 人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4,二元弱酸),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的含量。(配制KMnO4标准溶液)如图所示是配制50mLKMnO4标准溶液的过程示意图。
(1)请你观察图示判断,其中不正确的操作有___ (填序号)。
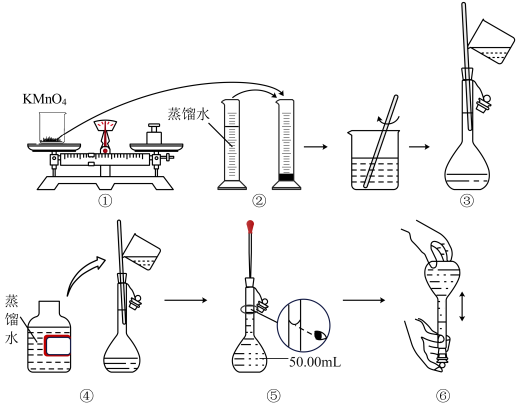
(2)如果用图示的操作配制溶液,所配制的溶液浓度将____ (填“偏大”或“偏小”)。(测定血液样品中Ca2+的浓度)抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mLKMnO4溶液。
(3)已知草酸跟酸化的KMnO4反应还原产物为Mn2+,反应离子方程式为:___ 。
(4)容量瓶上需标有以下五项中的__ 。
①温度②浓度③容量④压强⑤刻度线
(5)下列配制的KMnO4溶液浓度偏低的是___ 。
A.称量KMnO4时砝码错放在左盘(使用游码)
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
D.定容时俯视刻度线
E.容量瓶未经干燥就直接使用
(1)请你观察图示判断,其中不正确的操作有

(2)如果用图示的操作配制溶液,所配制的溶液浓度将
(3)已知草酸跟酸化的KMnO4反应还原产物为Mn2+,反应离子方程式为:
(4)容量瓶上需标有以下五项中的
①温度②浓度③容量④压强⑤刻度线
(5)下列配制的KMnO4溶液浓度偏低的是
A.称量KMnO4时砝码错放在左盘(使用游码)
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
D.定容时俯视刻度线
E.容量瓶未经干燥就直接使用
您最近一年使用:0次
2 . 亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
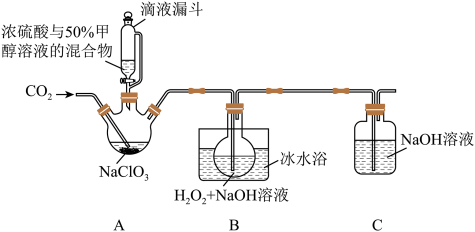
已知:
(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是______ 。
(2)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________ 。
(3)装置B中生成NaClO2的化学方程式是____ 。
(4)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.控制在38~60℃之间蒸发浓缩;b._____ ;c.用38~60℃的热水洗涤;d.在低于60℃的真空中蒸发,干燥。
(5)装置C的作用为___________ 。
(6)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水与过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________ 。

已知:
(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是
(2)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为
(3)装置B中生成NaClO2的化学方程式是
(4)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.控制在38~60℃之间蒸发浓缩;b.
(5)装置C的作用为
(6)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水与过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为
您最近一年使用:0次
3 . 磷及其化合物在工农业生产中具有重要用途,下图所示为提纯白磷样品(含惰性杂质)的工艺流程。下列说法不正确的是
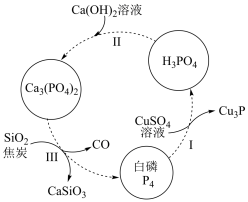

| A.过程I中,被氧化的元素是Cu和P |
| B.过程II 中,反应物的比例不同可获得不同产物,除Ca3(PO4)2和H2O外,可能还有Ca(H2PO4)2、CaHPO4 |
| C.过程Ⅲ的化学方程式为2Ca3(PO4)2 +6SiO2+10C =6CaSiO3+10CO↑+P4 |
| D.不慎将白磷沾到皮肤上,可用 0.2 mol·L-1CuSO4溶液冲洗 |
您最近一年使用:0次
名校
解题方法
4 . 亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
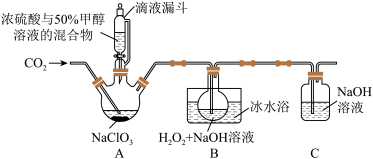
已知:①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:______________________ 。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是_________ 。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂别的物质的量之比为____________ 。
(4)装置B中生成NaClO2的化学方程式是_________________________ 。
(5)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2 =2I-+
=2I-+ ),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:
),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:___________________________ 。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________ 。

已知:①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂别的物质的量之比为
(4)装置B中生成NaClO2的化学方程式是
(5)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2
 =2I-+
=2I-+ ),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:
),以淀粉溶液做指示剂,判断达到滴定终点时的现象为:
您最近一年使用:0次
2020-10-13更新
|
141次组卷
|
2卷引用:江西省临川第一中学暨临川一中实验学校2021届高三上学期第一次月考化学试题
解题方法
5 . 环己烯是合成赖氨酸、环己酮、苯酚等的重要原料,也常用作石油萃取剂及高辛烷值汽油稳定剂。
(一)制备环己烯的反应原理:
主反应: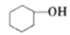

 +H2O
+H2O
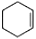
副反应:2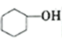

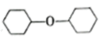 +H2O
+H2O
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
(三)实验流程

(四)制备环己烯的实验装置图如图(夹持装置及加热装置已省略):
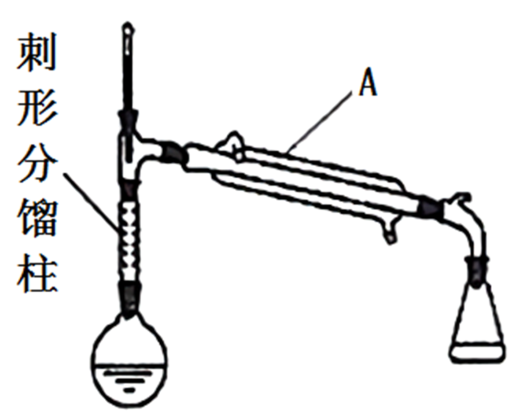
请回答:
(1)仪器A的名称是______ 。
(2)实验中不用浓硫酸,而用85% H3PO4溶液,说明理由_______ 。(写出一条即可)
(3)文献资料要求本实验的反应温度接近但又不超过90℃,根据图表数据分析其原因是_____ 。
(4)将较纯净环己烯样品按如图装置蒸馏,蒸馏时要加入生石灰,目的是____ 。
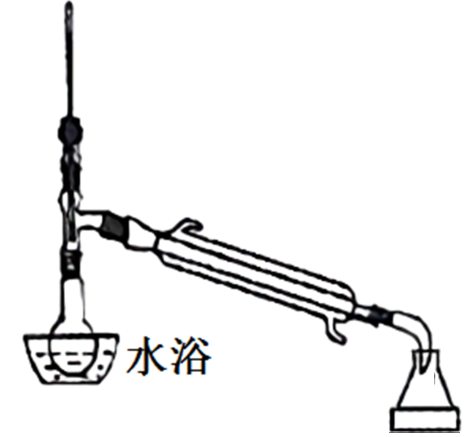
(5)在定条件下,向8.2 g环己烯样品中加入0.1 mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生I2,用0.1 mol/L的Na2S2O3标准溶液滴定,发生反应:I2+2S2O = S4O
= S4O +2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):
+2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):
①滴定所用指示剂为______ , 样品中环己烯的质量分数为____ 。
②下列情况会导致测定结果偏低的是____ (填序号)。
a.在测定过程中部分环己烯挥发
b.样品中含有苯酚杂质
c.Na2S2O3标准溶液部分被氧化
d.滴定后读数时,俯视刻度线
(一)制备环己烯的反应原理:
主反应:


 +H2O
+H2O副反应:2


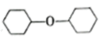 +H2O
+H2O(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
| 沸点/℃ | 密度/(g· cm3) | 水中溶解性 | |
| 环己醇 | 161 | 0.962 4 | 可溶于水 |
| 环己烯 | 83 | 0.811 | 微溶于水 |
| 85%H3PO4溶液 | 1.69 | 易溶于水 | |
| 环己烯与水形成的共沸物(含水10%) | 70.8 | ||
| 环己醇与水形成的共沸物(含水80%) | 97.8 |

(四)制备环己烯的实验装置图如图(夹持装置及加热装置已省略):

请回答:
(1)仪器A的名称是
(2)实验中不用浓硫酸,而用85% H3PO4溶液,说明理由
(3)文献资料要求本实验的反应温度接近但又不超过90℃,根据图表数据分析其原因是
(4)将较纯净环己烯样品按如图装置蒸馏,蒸馏时要加入生石灰,目的是

(5)在定条件下,向8.2 g环己烯样品中加入0.1 mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生I2,用0.1 mol/L的Na2S2O3标准溶液滴定,发生反应:I2+2S2O
 = S4O
= S4O +2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):
+2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):①滴定所用指示剂为
②下列情况会导致测定结果偏低的是
a.在测定过程中部分环己烯挥发
b.样品中含有苯酚杂质
c.Na2S2O3标准溶液部分被氧化
d.滴定后读数时,俯视刻度线
您最近一年使用:0次
名校
解题方法
6 . 亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
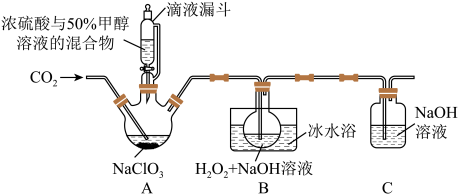
已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:___________ 。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是___________ 。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________ 。
(4)装置B中生成NaClO2的化学方程式是____ 。
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.___ ;b._____ ;c.用38~60℃的热水洗涤;d.在低于60oC的真空中蒸发,干燥。
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为______ 。
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为_____ 。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________ 。

已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为
(4)装置B中生成NaClO2的化学方程式是
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为
您最近一年使用:0次
2020-05-12更新
|
263次组卷
|
3卷引用:江西省鹰潭市2020-2021学年高二上学期期末质量检测化学试题
19-20高二上·江西南昌·期中
名校
解题方法
7 . 高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下(部分条件和产物省略):

请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有______ 。
(2)从经济性考虑试剂X宜选择(填名称)________ 。
(3)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为________ 。
②电解过程中,阴极附近电解质溶液的pH将____________ (填增大、减小或不变)。
(4)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式________ 。
(5)已知:常温下,Ksp[Mn(OH)2]=2.0×10−13,工业上,调节pH沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=___________ 。

请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有
(2)从经济性考虑试剂X宜选择(填名称)
(3)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为
②电解过程中,阴极附近电解质溶液的pH将
(4)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式
(5)已知:常温下,Ksp[Mn(OH)2]=2.0×10−13,工业上,调节pH沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=
您最近一年使用:0次
2013·江西·一模
解题方法
8 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
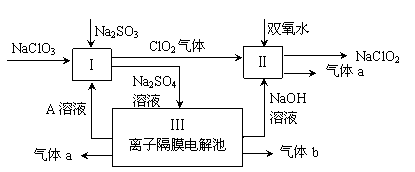
(1)双氧水的结构式为:___________ ;Ⅰ中发生反应的还原剂是_____ (填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________ 。
(3)A的化学式是________ ,装置Ⅲ中A在________ 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式_______ 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因_______________________________ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_______ (填相同、不相同或无法判断)

(1)双氧水的结构式为:
(2)Ⅱ中反应的离子方程式是
(3)A的化学式是
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量
您最近一年使用:0次
名校
解题方法
9 . 为探究Na与CO2反应产物,某化学兴趣小组按如图装置进行实验。已知:CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
回答下列问题:
(1)写出A中反应的离子方程式__________ ;
(2)仪器X的名称是_______ ,B中的溶液为_________ ;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是_____ (填标号);
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2,通入CO2至E中出现浑浊e.称量硬质玻璃管
f.冷却到室温重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:①钠块表面变黑,熔融成金属小球;②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③F中试管内壁有银白物质产生。产生上述②现象的原因是________ ;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____ 。

回答下列问题:
(1)写出A中反应的离子方程式
(2)仪器X的名称是
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2,通入CO2至E中出现浑浊e.称量硬质玻璃管
f.冷却到室温重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:①钠块表面变黑,熔融成金属小球;②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③F中试管内壁有银白物质产生。产生上述②现象的原因是
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
| 步骤 | 操作 | 结论 |
| 1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
| 2 | 往步骤1所得滤液中 现象: |
| m1 | m2 | m3 |
| 66.7g | 69.0g | 72.1g |
您最近一年使用:0次
2020-02-11更新
|
206次组卷
|
7卷引用:江西省上高县第二中学2019-2020学年高一上学期第三次月考化学试题
19-20高三上·江西南昌·阶段练习
名校
10 . 某化学兴趣小组利用下图装置探究验证黄铜矿(主要成分 )在空气中的氧化产物并测定
)在空气中的氧化产物并测定 的纯度(杂质为
的纯度(杂质为 )实验步骤:
)实验步骤:
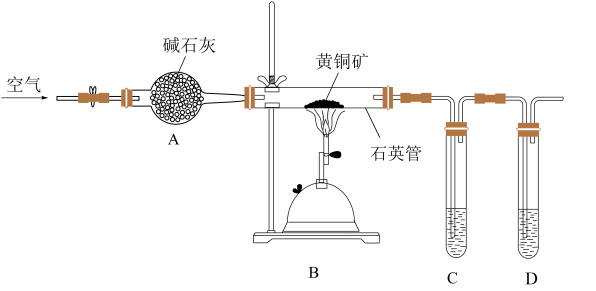
①组装好仪器,检查装置的气密性良好。
②加入药品,打开弹簧夹,从左口不断鼓入空气。
③点燃B处的酒精喷灯,高温灼烧石英管中黄铜矿的样品。
请回答下列问题。
(1)仪器A中的试剂是________ ,其作用是________ 。
(2)为检验灼烧氧化黄铜矿产生的气体,则C、D中的试剂可选择________ (多选)。
A. 溶液、NaOH溶液 B.
溶液、NaOH溶液 B. 溶液、NaOH溶液
溶液、NaOH溶液
C.品红溶液、NaOH溶液 D. 溶液、NaOH溶液
溶液、NaOH溶液
(3)查阅资料
①样品经煅烧后得到的体可能为泡铜(Cu、 )和熔渣(
)和熔渣( 、FeO)。
、FeO)。
② 与稀
与稀 的反应为:
的反应为:
探究:设计实验方案验证泡铜中是否含有 ?
?________ 。
(4)为测定 的纯度,称取ag的黄铜矿样品充分燃烧后,甲、乙两组同学设计如下两个不同的实验方案(以下纯度结果均用含相应字母的代数式表示)
的纯度,称取ag的黄铜矿样品充分燃烧后,甲、乙两组同学设计如下两个不同的实验方案(以下纯度结果均用含相应字母的代数式表示)
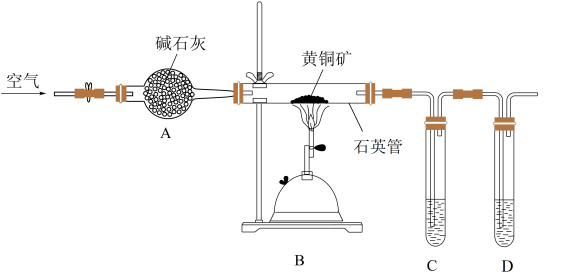
甲方案:若C试管中为足量的 和NaOH的混合溶液,吸收完气体后向C中加入过量的
和NaOH的混合溶液,吸收完气体后向C中加入过量的 溶液振荡且静置,经过滤后处理得到固体为w g,则
溶液振荡且静置,经过滤后处理得到固体为w g,则 的纯度为
的纯度为________ 。写出C试管中吸收气体时的总反应的离子方程式________ 。
乙方案:从上述烧产物中分离出泡铜,使其完全溶于稀硝酸并配成250mL的溶液,取出25.00mL该溶液用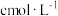 的标准液EDTA(用
的标准液EDTA(用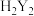 表示)滴定至终点(滴定剂不与杂质反应),消耗EDTA标准液VmL,则
表示)滴定至终点(滴定剂不与杂质反应),消耗EDTA标准液VmL,则 的纯度为
的纯度为________ 。(滴定时的反应为: )
)
 )在空气中的氧化产物并测定
)在空气中的氧化产物并测定 的纯度(杂质为
的纯度(杂质为 )实验步骤:
)实验步骤:
①组装好仪器,检查装置的气密性良好。
②加入药品,打开弹簧夹,从左口不断鼓入空气。
③点燃B处的酒精喷灯,高温灼烧石英管中黄铜矿的样品。
请回答下列问题。
(1)仪器A中的试剂是
(2)为检验灼烧氧化黄铜矿产生的气体,则C、D中的试剂可选择
A.
 溶液、NaOH溶液 B.
溶液、NaOH溶液 B. 溶液、NaOH溶液
溶液、NaOH溶液C.品红溶液、NaOH溶液 D.
 溶液、NaOH溶液
溶液、NaOH溶液(3)查阅资料
①样品经煅烧后得到的体可能为泡铜(Cu、
 )和熔渣(
)和熔渣( 、FeO)。
、FeO)。②
 与稀
与稀 的反应为:
的反应为:
探究:设计实验方案验证泡铜中是否含有
 ?
?(4)为测定
 的纯度,称取ag的黄铜矿样品充分燃烧后,甲、乙两组同学设计如下两个不同的实验方案(以下纯度结果均用含相应字母的代数式表示)
的纯度,称取ag的黄铜矿样品充分燃烧后,甲、乙两组同学设计如下两个不同的实验方案(以下纯度结果均用含相应字母的代数式表示)
甲方案:若C试管中为足量的
 和NaOH的混合溶液,吸收完气体后向C中加入过量的
和NaOH的混合溶液,吸收完气体后向C中加入过量的 溶液振荡且静置,经过滤后处理得到固体为w g,则
溶液振荡且静置,经过滤后处理得到固体为w g,则 的纯度为
的纯度为乙方案:从上述烧产物中分离出泡铜,使其完全溶于稀硝酸并配成250mL的溶液,取出25.00mL该溶液用
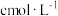 的标准液EDTA(用
的标准液EDTA(用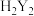 表示)滴定至终点(滴定剂不与杂质反应),消耗EDTA标准液VmL,则
表示)滴定至终点(滴定剂不与杂质反应),消耗EDTA标准液VmL,则 的纯度为
的纯度为 )
)
您最近一年使用:0次



